Trắc nghiệm Bài 4: Mol và tỉ khối của chất khí Khoa học tự nhiên 8 Cánh diều có đáp án
Đề bài
Tỉ khối của chất X có khối lượng mol là 28 so với khí helium là:
-
A.
14
-
B.
7
-
C.
3
-
D.
28
Tỉ khối của chất X so với H2 là 16, biết khối lượng của chất X là 6,4 g. Số mol chất X là:
-
A.
0,1 mol
-
B.
0,25 mol
-
C.
0,2 mol
-
D.
0,3 mol
Một hợp chất có công thức hóa học là XO2 có khối lượng mol phân tử là 44 g/mol. Nguyên tố X là
-
A.
N
-
B.
C
-
C.
Na
-
D.
H
Số mol của 25g CaCO3 là
-
A.
0,25 mol
-
B.
0,5 mol
-
C.
25 mol
-
D.
1 mol
Khối lượng của 2 mol Mg(OH)2 là:
-
A.
58g
-
B.
116g
-
C.
29g
-
D.
120g
a mol khí chlorine có chứa 12,04 x 10^23 phân tử Cl2. Giá trị của a là
-
A.
2.
-
B.
6.
-
C.
4.
-
D.
0,5
Số nguyên tử hydrogen trong 0.05 mol khí hydrogen là
-
A.
3,011 x 1022
-
B.
3,011 x 1023
-
C.
6,02 x 1022
-
D.
6,022 x 1024
Số mol nguyên tử tương ứng với 10,0 gam kim loại Ca là
-
A.
0,5 (mol).
-
B.
10,0 (mol).
-
C.
0,01 (mol).
-
D.
0,25 (mol).
Số Avogadro có giá trị bằng:
-
A.
6.10-23.
-
B.
6.10-24.
-
C.
6.1023.
-
D.
6.1024.
Số phân tử H2O có trong một giọt nước (0,05 gam) là:
-
A.
1,777.1023 phân tử
-
B.
1,767.1022 phân tử
-
C.
2,777.1021 phân tử
-
D.
1,667.1021 phân tử
Số nguyên tử sắt có trong 280 gam sắt là:
-
A.
20,1.1023
-
B.
25,1.1023
-
C.
30,1.1023
-
D.
35,1.1023
Phải lấy bao nhiêu mol phân tử CO2 để có 1,5.1023 phân tử CO2?
-
A.
0,20 mol
-
B.
0,25 mol
-
C.
0,30 mol
-
D.
0,35 mol
Khí nào có thể thu được bằng cách đặt ngược bình (hình vẽ):
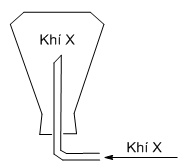
-
A.
Khí Cacbonic (CO2).
-
B.
Khí Oxi (O2).
-
C.
Khí Clo (Cl2).
-
D.
Khí Hiđro (H2).
Khí N2 nặng hơn khí H2 bằng bao nhiêu lần? (N = 14, H = 1)
-
A.
10 lần.
-
B.
12 lần.
-
C.
8 lần.
-
D.
14 lần.
Một hỗn hợp X gồm H2 và O2 (không có phản ứng xảy ra) có tỉ khối so với không khí là 0,3276. Phần trăm theo số mol của khí H2 trong hỗn hợp là
-
A.
25%
-
B.
75%
-
C.
30%
-
D.
70%
Tỉ khối của hỗn hợp chứa N2 và O3 theo tỉ lệ 1 : 2 so với không khí là:
-
A.
$\dfrac{{128}}{{47}}$
-
B.
$\dfrac{{127}}{{48}}$
-
C.
$\dfrac{{124}}{{87}}$
-
D.
$\dfrac{{148}}{{27}}$
Khí A có công thức dạng RO2. Biết dA/KK = 1,5862. Hãy xác định công thức của khí A.
-
A.
SO2
-
B.
NO2
-
C.
CO2
-
D.
H2O
Tỉ khối của khí B đối với oxi là 0,5 và tỉ khối của khí A đối với khí B là 2,125. Khối lượng mol của khí A là
-
A.
32 g/mol.
-
B.
34 g/mol.
-
C.
36 g/mol.
-
D.
28 g/mol.
Tỉ khối của A đối với H2 là 22. A là khí nào sau đây?
-
A.
NO2.
-
B.
N2.
-
C.
CO2.
-
D.
Cl2.
Chất nào sau đây nặng hơn không khí?
-
A.
SO2.
-
B.
H2.
-
C.
CH4.
-
D.
N2.
Khí N2 nhẹ hơn khí nào sau đây?
-
A.
H2.
-
B.
NH3.
-
C.
C2H2.
-
D.
O2.
Lời giải và đáp án
Tỉ khối của chất X có khối lượng mol là 28 so với khí helium là:
-
A.
14
-
B.
7
-
C.
3
-
D.
28
Đáp án : B
Dựa vào công thức tính tỉ khối của chất khí
\({d_{X/He}} = \frac{{28}}{4} = 7\)
Tỉ khối của chất X so với H2 là 16, biết khối lượng của chất X là 6,4 g. Số mol chất X là:
-
A.
0,1 mol
-
B.
0,25 mol
-
C.
0,2 mol
-
D.
0,3 mol
Đáp án : C
Dựa vào tỉ khối của chất khí
\({d_{X/H2}} = \frac{{{M_X}}}{{{M_{H2}}}}\)--> MX = 16 x 2 = 32 --> nX = 6,4 : 32 = 0,2 (mol)
Một hợp chất có công thức hóa học là XO2 có khối lượng mol phân tử là 44 g/mol. Nguyên tố X là
-
A.
N
-
B.
C
-
C.
Na
-
D.
H
Đáp án : B
Dựa vào khối lượng mol của phân tử
M X + M O2 = 44 --> MX = 12
Nguyên tố X là nguyên tố Carbon.
Số mol của 25g CaCO3 là
-
A.
0,25 mol
-
B.
0,5 mol
-
C.
25 mol
-
D.
1 mol
Đáp án : A
Dựa vào công thức tính số mol: n = m : M
\({n_{CaC{O_3}}} = 25:100 = 0,25mol\)
Khối lượng của 2 mol Mg(OH)2 là:
-
A.
58g
-
B.
116g
-
C.
29g
-
D.
120g
Đáp án : B
Dựa vào công thức tính khối lượng: m = n.M
M Mg(OH)2 = 58
\({m_{Mg{{(OH)}_2}}} = 2.58 = 116g\)
a mol khí chlorine có chứa 12,04 x 10^23 phân tử Cl2. Giá trị của a là
-
A.
2.
-
B.
6.
-
C.
4.
-
D.
0,5
Đáp án : A
1mol = \(6,02x{10^{23}}\)
\(\frac{{12,04x{{10}^{23}}}}{{6,02x{{10}^{23}}}} = 2\)
Số nguyên tử hydrogen trong 0.05 mol khí hydrogen là
-
A.
3,011 x 1022
-
B.
3,011 x 1023
-
C.
6,02 x 1022
-
D.
6,022 x 1024
Đáp án : A
1mol = \(6,022x{10^{23}}\)
\(0,05x2x6,022x{10^{23}} = 3,01x{10^{22}}\)
Số mol nguyên tử tương ứng với 10,0 gam kim loại Ca là
-
A.
0,5 (mol).
-
B.
10,0 (mol).
-
C.
0,01 (mol).
-
D.
0,25 (mol).
Đáp án : D
Công thức tính số mol: \({n_{Ca}} = \dfrac{{{m_{Ca}}}}{{{M_{Ca}}}} = ?\,(mol)\)
Ca có phân tử khối = 40 (g/mol)
Số mol của nguyên tử Ca là: \({n_{Ca}} = \dfrac{{{m_{Ca}}}}{{{M_{Ca}}}} = \dfrac{{10,0}}{{40}} = 0,25\,(mol)\)
Số Avogadro có giá trị bằng:
-
A.
6.10-23.
-
B.
6.10-24.
-
C.
6.1023.
-
D.
6.1024.
Đáp án : C
Số Avogadro có giá trị bằng: 6.1023
Số phân tử H2O có trong một giọt nước (0,05 gam) là:
-
A.
1,777.1023 phân tử
-
B.
1,767.1022 phân tử
-
C.
2,777.1021 phân tử
-
D.
1,667.1021 phân tử
Đáp án : D
Xem lại khái niệm khối lượng mol
\({M_{{H_2}O}} = 1.2 + 16 = 18(g)\)
Vậy 0,05g nước chứa số mol là: \({n_{{H_2}O}} = \dfrac{{{m_{{H_2}O}}}}{M} = \dfrac{{0,05}}{{18}} = 2,{77.10^{ - 3}}mol\)
Trong 1 mol H2O chứa 6,02.1023 phân tử nước
\( \to \) 2,77.10-3 mol H2O chứa x phân tử nước
Vậy \(x = \dfrac{{2,{{77.10}^{ - 3}}.6,{{02.10}^{23}}}}{1} = 1,{667.10^{21}}\)
Số nguyên tử sắt có trong 280 gam sắt là:
-
A.
20,1.1023
-
B.
25,1.1023
-
C.
30,1.1023
-
D.
35,1.1023
Đáp án : C
1 mol nguyên tử sắt nặng 56 gam
=> Số mol nguyên tứ sắt trong 280 gam là
nFe= \(\frac{m}{M} = \frac{{1.280}}{{56}} = 5\) mol
Ta có trong 1 mol nguyên tử có 6,02.1023 nguyên tử;
=> số nguyên tử sắt là: 5.6,02.1023 = 30,1.1023 nguyên tử
Phải lấy bao nhiêu mol phân tử CO2 để có 1,5.1023 phân tử CO2?
-
A.
0,20 mol
-
B.
0,25 mol
-
C.
0,30 mol
-
D.
0,35 mol
Đáp án : B
6,02.1023 phân tử CO2 = 1 mol
=> 1,5.1023 phân tử CO2 = $\dfrac{{1,{{5.10}^{23}}.1}}{{{{6.10}^{23}}}} \approx 0,25$ mol
Khí nào có thể thu được bằng cách đặt ngược bình (hình vẽ):

-
A.
Khí Cacbonic (CO2).
-
B.
Khí Oxi (O2).
-
C.
Khí Clo (Cl2).
-
D.
Khí Hiđro (H2).
Đáp án : D
Khí thu được bằng cách đặt úp bình \( \to\) khí này có phân tử khối nhẹ hơn không khí (Mkk≈ 29 g/mol)
Khí thu được bằng cách đặt úp bình \( \to\) khí này có phân tử khối nhẹ hơn không khí
\( \to\) khí X là khí H2 (\({M_{{H_2}}} = 2\,\,g/mol\))
Khí N2 nặng hơn khí H2 bằng bao nhiêu lần? (N = 14, H = 1)
-
A.
10 lần.
-
B.
12 lần.
-
C.
8 lần.
-
D.
14 lần.
Đáp án : D
Lấy phân tử khối của N2 chia cho phân tử khối của H2
Phân tử khối của N2 = 14×2 = 28 (gam/mol)
Phân tử khối của H2 = 2×1 = 2 (gam/mol)
Suy ra
\({d_{{N_2}/{H_2}}} =\dfrac{{28}}{2}= 14\)
Vậy N2 nặng hơn H2 14 lần
Một hỗn hợp X gồm H2 và O2 (không có phản ứng xảy ra) có tỉ khối so với không khí là 0,3276. Phần trăm theo số mol của khí H2 trong hỗn hợp là
-
A.
25%
-
B.
75%
-
C.
30%
-
D.
70%
Đáp án : B
+) Tỉ khối của X so với không khí : ${d_{X/kk}} = \dfrac{{{{\bar M}_X}}}{{29}} = > {\bar M_X}$
Công thức tính khối lượng trung bình của hỗn hợp X là
${M_X} = \dfrac{{{n_{{H_2}}}.{M_{{H_2}}} + {n_{{O_2}}}.{M_{{O_2}}}}}{{{n_{{H_2}}} + {n_{{O_2}}}}}$
+) phần trăm số mol khí H2 là: $\% {n_{{H_2}}} = \dfrac{{{n_{{H_2}}}}}{{{n_{{H_2}}} + {n_{{O_2}}}}}.100\% $
Gọi số mol của H2 và O2 trong hỗn hợp lần lượt là x và y mol
Tỉ khối của X so với không khí : ${d_{X/kk}} = \dfrac{{{{\bar M}_X}}}{{29}} = > {\bar M_X} = 29.0,3276 = 9,5$
Công thức tính khối lượng trung bình của hỗn hợp X là
${M_X} = \dfrac{{{n_{{H_2}}}.{M_{{H_2}}} + {n_{{O_2}}}.{M_{{O_2}}}}}{{{n_{{H_2}}} + {n_{{O_2}}}}} = \dfrac{{2{\text{x}} + 32y}}{{x + y}} = 9,5$
=> 2x + 32y = 9,5x + 9,5y => 7,5x = 22,5 => x = 3y
=> phần trăm số mol khí H2 là: $\% {n_{{H_2}}} = \dfrac{{{n_{{H_2}}}}}{{{n_{{H_2}}} + {n_{{O_2}}}}}.100\% = \dfrac{{3y}}{{3y + y}}.100\% = 75\% $
Tỉ khối của hỗn hợp chứa N2 và O3 theo tỉ lệ 1 : 2 so với không khí là:
-
A.
$\dfrac{{128}}{{47}}$
-
B.
$\dfrac{{127}}{{48}}$
-
C.
$\dfrac{{124}}{{87}}$
-
D.
$\dfrac{{148}}{{27}}$
Đáp án : C
Khối lượng trung bình của hỗn hợp khí là:
$\bar M = \frac{{{n_{{N_2}}}.{M_{{N_2}}} + {n_{{O_3}}}.{M_{{O_3}}}}}{{{n_{{N_2}}} + {n_{{O_3}}}}} $
=> tỉ khối của hỗn hợp so với không khí là: ${d_{hh/kk}} = \frac{{\bar M}}{{{M_{kk}}}}$
Gọi số mol của N2 là a mol => số mol của O3 là 2a mol
Khối lượng trung bình của hỗn hợp khí là:
$\bar M = \frac{{{n_{{N_2}}}.{M_{{N_2}}} + {n_{{O_3}}}.{M_{{O_3}}}}}{{{n_{{N_2}}} + {n_{{O_3}}}}} = \frac{{a.28 + 2{\text{a}}.48}}{{a + 2{\text{a}}}} = \frac{{124}}{3}$
=> tỉ khối của hỗn hợp so với không khí là: ${d_{hh/kk}} = \frac{{\bar M}}{{{M_{kk}}}} = \frac{{124}}{{3.29}} = \frac{{124}}{{87}}$
Khí A có công thức dạng RO2. Biết dA/KK = 1,5862. Hãy xác định công thức của khí A.
-
A.
SO2
-
B.
NO2
-
C.
CO2
-
D.
H2O
Đáp án : B
+) Tỉ khối của A so với không khí là 1,5862 => MA = 29 . dA/KK
+) Khối lượng mol của khí A là: ${M_{R{O_2}}} = {M_R} + 2.{M_O}$ => MR
Tỉ khối của A so với không khí là 1,5862 => MA = 29 . dA/KK = 29.1,5862 = 46 g/mol
Khối lượng mol của khí A là:
${M_{R{O_2}}} = {M_R} + 2.{M_O}$ => MR = 46 – 2.16 = 14 gam
=> R là N
=> Công thức của A là NO2
Tỉ khối của khí B đối với oxi là 0,5 và tỉ khối của khí A đối với khí B là 2,125. Khối lượng mol của khí A là
-
A.
32 g/mol.
-
B.
34 g/mol.
-
C.
36 g/mol.
-
D.
28 g/mol.
Đáp án : B
+) ${d_{B/{O_2}}} = \frac{{{M_B}}}{{{M_{{O_2}}}}} = 0,5 = > {M_B}$
+) ${d_{A/B}} = \frac{{{M_A}}}{{{M_B}}} = 2,125 = > {M_A}$
Ta có: ${d_{B/{O_2}}} = \frac{{{M_B}}}{{{M_{{O_2}}}}} = 0,5 = > {M_B} = 32.0,5 = 16$
Mặt khác: ${d_{A/B}} = \frac{{{M_A}}}{{{M_B}}} = 2,125 = > {M_A} = 2,125.16 = 34$
Vậy khối lượng mol của A là 34 g/mol
Tỉ khối của A đối với H2 là 22. A là khí nào sau đây?
-
A.
NO2.
-
B.
N2.
-
C.
CO2.
-
D.
Cl2.
Đáp án : C
Tỉ khối của A đối với H2 : ${d_{A/{H_2}}} = \dfrac{{{M_A}}}{{{M_{{H_2}}}}} = 22 = > {M_A} = 22.{M_{{H_2}}}$
Tỉ khối của A đối với H2 : ${d_{A/{H_2}}} = \dfrac{{{M_A}}}{{{M_{{H_2}}}}} = 22 = > {M_A} = 22.{M_{{H_2}}} = 22.2 = 44$ g/mol
Loại A vì NO2 có M = 14 + 16.2 = 46
Loại B vì N2 có M = 2.14 = 28
Chọn C vì CO2 có M = 12 + 16.2 = 44
Loại D vì Cl2 có M = 2.35,5 = 71
Chất nào sau đây nặng hơn không khí?
-
A.
SO2.
-
B.
H2.
-
C.
CH4.
-
D.
N2.
Đáp án : A
Xem lại công thức tính tỉ khối của khí A so với không khí
Không khí có M = 29 g/mol => chất nặng hơn không khí là chất có M > 29 g/mol
+) ${M_{S{O_2}}} = 32 + 16.2 = 64$ > 29 => khí SO2 nặng hơn không khí
+) ${M_{{H_2}}} = 2.1 = 2$ < 29 => khí H2 nhẹ hơn không khí
+) ${M_{C{H_4}}} = 12 + 1.4 = 16$ < 29 => khí CH4 nhẹ hơn không khí
+) ${M_{{N_2}}} = 2.14 = 28$ < 29 => khí N2 nhẹ hơn không khí
Khí N2 nhẹ hơn khí nào sau đây?
-
A.
H2.
-
B.
NH3.
-
C.
C2H2.
-
D.
O2.
Đáp án : D
Xem lại công thức tính tỉ khối
Ta có: ${d_{{N_2}/{H_2}}} = \frac{{{M_{{N_2}}}}}{{{M_{{H_2}}}}} = \frac{{28}}{2} = 14 > 1$ => khí N2 nặng hơn khí H2
${d_{{N_2}/N{H_3}}} = \frac{{{M_{{N_2}}}}}{{{M_{N{H_3}}}}} = \frac{{28}}{{17}} = 1,647 > 1$ => khí N2 nặng hơn NH3
${d_{{N_2}/{C_2}{H_2}}} = \frac{{{M_{{N_2}}}}}{{{M_{{C_2}{H_2}}}}} = \frac{{28}}{{26}} = 1,07 > 1$ => khí N2 nặng hơn khí C2H2
${d_{{N_2}/{O_2}}} = \frac{{{M_{{N_2}}}}}{{{M_{{O_2}}}}} = \frac{{28}}{{32}} = 0,875 < 1$ => khí N2 nhẹ hơn khí O2
Luyện tập và củng cố kiến thức Bài 5: Tính theo phương trình hóa học với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 6: Nồng độ dung dịch với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 7: Tốc độ phản ứng và chất xúc tác với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 3: Định luật bảo toàn khối lượng. Phương trình hóa học với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 2: Phản ứng hóa học và năng lượng của phản ứng hóa học với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 1: Biến đổi vật lí và biến đổi hóa học với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
- Trắc nghiệm Bài 43: Khái quát về sinh quyển và các khu sinh học Khoa học tự nhiên 8 Cánh diều
- Trắc nghiệm Bài 42: Cân bằng tự nhiên và bảo vệ môi trường Khoa học tự nhiên 8 Cánh diều
- Trắc nghiệm Bài 41: Hệ sinh thái Khoa học tự nhiên 8 Cánh diều
- Trắc nghiệm Bài 40: Quần xã sinh vật Khoa học tự nhiên 8 Cánh diều
- Trắc nghiệm Bài 39: Quần thể sinh vật Khoa học tự nhiên 8 Cánh diều









