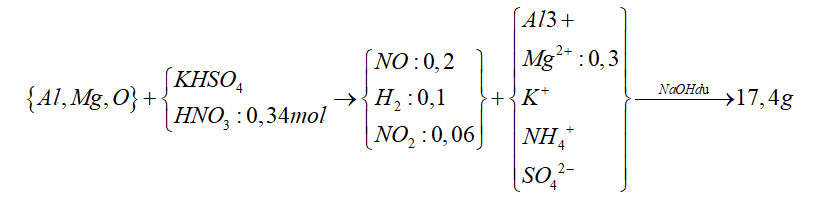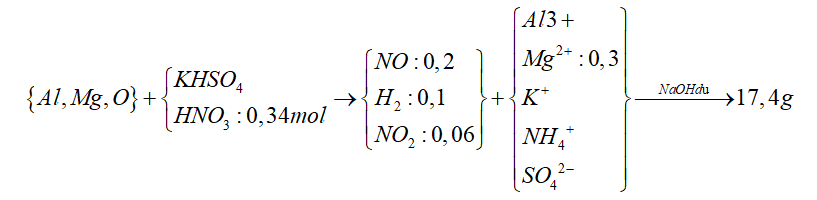Giải bài tập hóa học 12, Hóa 12 - Để học tốt hóa học 12
Giải bài tập hóa học 12, Hóa 12 - Để học tốt hóa học 12
 Đề thi học kì 2 của các trường có lời giải – Mới nhất
Đề thi học kì 2 của các trường có lời giải – Mới nhất
Giải đề thi học kì 2 hoá lớp 12 năm 2019 - 2020 sở giáo dục Bắc Ninh
Giải chi tiết đề thi học kì 2 môn hoá lớp 12 năm 2019 - 2020 sở giáo dục Bắc Ninh với cách giải nhanh và chú ý quan trọng
Đề bài
Câu 1: Trong các loại quặng sắt, quặng có hàm lượng sắt cao nhất là
A. xiđerit.
B. hematit đỏ.
C. hematit nâu
D. Manhetit.
Câu 2: Cho sơ đồ chuyển hoá:
Fe\(\xrightarrow{X}\)FeCl3\(\xrightarrow{Y}\)Fe(OH)3
(mỗi mũi tên ứng với một phản ứng). Hai chất X, Y lần lượt là
A. NaCl, Cu(OH)2.
B. Cl2, NaOH.
C. HCl, Al(OH)3.
D. HCl, NaOH.
Câu 3: Cấu hình electron đúng của Fe là
A. [Ar]3d64s2.
B. [Ar] 4s23d6.
C. [Ar]3d6.
D. [Ar]3d5
Câu 4: Cho phản ứng: aAl + bHNO3 \(\xrightarrow{{}}\) cAl(NO3)3 + dNO + eH2O.
Nếu a = 2 thì b bằng
|
A. 6. |
B. 4. |
C. 8. |
D. 5. |
Câu 5: Trong bảng tuần hoàn, Mg là kim loại thuộc nhóm
|
A. IIIA. |
B. IA. |
C. IIA. |
D. IVA. |
Câu 6: Cho 9,12g hỗn hợp gồm FeO, Fe2O3, Fe3O4 tác dụng với dd HCl dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được dd Y . Cô cạn Y thu được 7,62g FeCl2 và m g FeCl3. Giá trị của m là?
|
A. 9,75g |
B. 8,75g |
|
C. 7,8g |
D. 6,5g |
Câu 7: Hòa tan hết m gam hỗn hợp E gồm Al, Mg, MgO trong dung dịch hỗn hợp gồm HNO3 (0,34 mol) và KHSO4. Sau phản ứng thu được 8,064 lít (đktc) hỗn hợp khí X gồm NO, H2 và NO2 với tỉ lệ mol tương ứng 10 : 5 : 3 và dung dịch Y chỉ chứa muối. Cho NaOH dư vào Y thì có 2,28 mol NaOH tham gia phản ứng, đồng thời thu được 17,4 gam kết tủa xuất hiện. Phần trăm về khối lượng đơn chất Mg trong E là
|
A. 26,28%. |
B. 17,65%. |
|
C. 28,36%. |
D. 29,41%. |
Câu 8: Để bảo vệ vỏ tàu biển làm bằng thép người ta thường gắn vào vỏ tàu (phần ngâm dưới nước) những tấm kim loại
|
A. Pb. |
B. Zn. |
C. Cu. |
D. Sn. |
Câu 9: Oxit bazo là
|
A. SO3. |
B. CO2. |
|
C. Fe(OH)2. |
D. Na2O. |
Câu 10: Khi dẫn từ từ khí CO2 đến dư vào dung dịch Ca(OH)2 thấy có
A. bọt khí và kết tủa trắng.
B. bọt khí bay ra.
C. kết tủa trắng xuất hiện.
D. kết tủa trắng, sau đó kết tủa tan dần.
Câu 11: Nung hỗn hợp gồm 0,12 mol Al và 0,04 mol Fe3O4 một thời gian, thu được hỗn hợp rắn X. Hòa tan hoàn toàn X trong dung dịch HCl dư thu được 0,15 mol khí H2 và m gam muối. Giá trị của m là
|
A. 32,58. |
B. 34,10. |
|
C. 31,97. |
D. 41,01. |
Câu 12: Al2O3 phản ứng được với cả hai dung dịch
|
A. Na2SO4, KOH. |
B. KCl, NaNO3. |
|
C. NaOH, HCl. |
D. NaCl, H2SO4. |
Câu 13: Hai chất được dùng để làm mềm nước cứng vĩnh cửu là
|
A. Na2CO3 và Na3PO4. |
B. Na2CO3 và Ca(OH)2.
C. Na2CO3 và HCl.
D. NaCl và Ca(OH)2.
Câu 14: Nhiệt phân hoàn toàn 100 gam đá vôi (có thành phần chính là CaCO3 và tạp chất không bị nhiệt phân) ta thu được 60,4 gam chất rắn. Hàm lượng CaCO3 trong đá vôi là
|
A. 90% |
B. 92% |
C. 80% |
D. 88% |
Câu 15: Để bảo quản natri, người ta phải ngâm natri trong
|
A. dầu hỏa. |
B. nước. |
|
C. rượu etylic. |
D. phenol lỏng. |
Câu 16: Sục V lít CO2(đktc) vào 100ml dung dịch Ca(OH)2 2M thu được 10g kết tủa. Giá trị lớn nhất của V là
|
A. 5,6 |
B. 8,40 |
C. 4,48 |
D. 6,72 |
Câu 17: Cho các thí nghiệm sau:
a) Cho Na vào dung dịch CuSO4.
b) Cho dd HCl dư vào dd Na2CO3.
c) Cho dd KHSO4 vào dd Ba(HCO3)2
d) Cho bột Cu vào dung dịch FeCl3.
e) điện phân dd CuSO4 điện cực trơ.
f) Cho hỗn hợp Na2O, Al vào nước.
Số thí nghiệm có sinh ra chất khí là:
|
A. 6 |
B. 4 |
C. 5 |
D. 3 |
Câu 18: Phương pháp thích hợp điều chế kim loại Ca từ CaCl2 là
A. Dùng Na khử Ca2+ trong dung dịch CaCl2
B. Nhiệt phân CaCl2.
C. Điện phân dung dịch CaCl2.
D. Điện phân CaCl2 nóng chảy.
Câu 19: Phản ứng nào sau đây sai?
A. Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
B. 2Fe + 3Cl2\(\xrightarrow{{{t}^{0}}}\) 2FeCl3
C. 2Fe + 3H2SO4 loãng → Fe2(SO4)3 + 3H2
D. 4CO + Fe3O4\(\xrightarrow{{{t}^{0}}}\) 3Fe + 4CO2
Câu 20: Cho 5,4 gam bột nhôm tác dụng với 100 ml dung dịch NaOH 0,2M. Sau khi phản ứng xảy ra hoàn toàn thu được V lít khí hiđro (đktc). Giá trị của V là
|
A. 4,48 |
B. 0,672 |
C. 0,448 |
D. 6,72 |
Câu 21: Trường hợp nào sau đây không tạo thành hợp chất Fe(III)
A. Nhiệt phân Fe(NO3)2.
B. Cho Fe vào dung dịch HCl đặc dư.
C. Cho FeCO3 vào dung dịch HNO3 loãng.
D. Cho Fe(NO3)2 vào dung dịch H2SO4 loãng.
Câu 22: Nguyên liệu chính dùng để sản xuất nhôm là
|
A. quặng đôlômit. |
B. quặng boxit. |
|
C. quặng cromit |
D. quặng pirit. |
Câu 23: Nước cứng là nước có chứa nhiều các ion
|
A. Ca2+, Mg2+. |
B. Cu2+, Fe3+. |
|
C. Al3+, Fe3+. |
D. Na+, K+. |
Câu 24: Hai dung dịch đều phản ứng được với kim loại Fe là
|
A. HCl , AlCl3. |
B. CuSO4 ,HCl. |
|
C. CuSO4 ,ZnCl2. |
D. ZnCl2, FeCl3. |
Câu 25: Tính chất hóa học đặc trưng của kim loại là
|
A. tính oxi hóa. |
B. tính axit. |
|
C. tính bazơ. |
D. tính khử. |
Câu 26: Kim loại nào sau đây có tính dẫn điện, dẫn nhiệt tốt nhất.
|
A. Đồng. |
B. Nhôm. |
|
C. Bạc. |
D. Vàng. |
Câu 27: Điện phân muối clorua kim loại kiềm nóng chảy thu được 1,792 lít khí đktc ở anot và 6,24 gam kim loại ở catot. Công thức hoá học của muối đem điện phân là
|
A. KCl |
B. LiCl |
|
C. NaCl |
D. RbCl |
Câu 28: Cho phương trình hóa học sau:
Fe + CuSO4 → FeSO4 + Cu
Phát biểu nào sau đây đúng?
A. Ion Fe2+ có tính oxi hoá mạnh hơn ion Cu2+.
B. Kim loại Cu có tính khử mạnh hơn kim loại Fe.
C. Kim loại Cu khử được ion Fe2+.
|
D. Ion Cu2+ có tính oxi hoá mạnh hơn ion Fe2+. |
Câu 29: Cho 2,3g Na vào 180g H2O. Sau khi phản ứng xảy ra hoàn toàn, nồng độ phần trăm chất tan trong dung dịch thu được là:
|
A. 3,25% |
B. 2,2% |
|
C. 3,5% |
D. 6,65% |
Câu 30: Hoà tan m gam Al vào dung dịch HNO3 loãng chỉ thu được hỗn hợp 2 sản phẩm khử gồm 0,1 mol N2O và 0,1 mol N2. Giá trị của m là
|
A. 48,6 gam. |
B. 13,5 gam. |
|
C. 16,2 gam. |
D. 21,6 gam. |
Câu 31: Kim loại có tính khử mạnh nhất là
|
A. Na. |
B. Mg. |
C. Al. |
D. Fe. |
Câu 32: Cho 100 ml dd FeCl2 1,5M vào 100 ml dd AgNO3 dư thu được a gam kết tủa. Giá trị của a là
|
A. 16,2 |
B. 43,5 |
C. 59,25 |
D. 24,6 |
Câu 33: Kim loại nào sau đây không được điều chế bằng phương pháp thủy luyện?
|
A. Al. |
B. Cu. |
C. Ag. |
D. Ni. |
Câu 34: Cho 18,4g hỗn hợp 2 muối cacbonat của kim loại thuộc nhóm IIA ở 2 chu kì liên tiếp tác dụng hết với dung dịch HCl. Cô cạn dung dịch sau khi phản ứng thu được 20,6g muối khan. Hai kim loại đó là
|
A. Be và Mg |
B. Mg và Ca |
|
C. Ca và Sr |
D. Sr và Ba |
Câu 35: Natri hidroxit hay xút ăn da là chất rắn không màu dễ nóng chảy, tan nhiều trong nước có CTHH là
|
A. NaOH |
B. Na2CO3 |
|
C. NaHSO3 |
D. NaNO3 |
Câu 36: Hoà tan m gam Fe trong dung dịch HCl dư, sau khi phản ứng kết thúc thu được 4,48 lít khí H2 (ở đktc). Giá trị của m là
|
A. 1,4 gam. |
B. 5,6 gam. |
|
C. 2,8 gam. |
D. 11,2 gam. |
Câu 37: Hỗn hợp X gồm Al, Ba, Na và K. Hòa tan hoàn toàn m gam X vào nước dư, thu được dung dịch Y và 0,0405 mol khí H2. Cho từ từ đến hết dung dịch chứa 0,018 mol H2SO4 và 0,03 mol HCl vào Y, thu được 1,089 gam hỗn hợp kết tủa và dung dịch Z chỉ chứa 3,335 gamhỗn hợp các muối clorua và muối sunfat trung hòa. Phần trăm khối lượng của kim loại Ba trong X là
|
A. 42,33%. |
B. 37,78%. |
|
C. 29,87%. |
D. 33,12%. |
Câu 38: Dẫn hỗn hợp khí gồm CO2, O2, N2 và H2 qua dung dịch NaOH. Khí bị hấp thụ là
|
A. H2 |
B. N2 |
C. O2 |
D. CO2 |
Câu 39: Cho khí CO khử hoàn toàn Fe2O3 thấy tạo thành 8,4 gam kim loại. Thể tích CO (đktc) đã tham gia phản ứng là
|
A. 1,12 lít. |
B. 3,36 lít. |
|
C. 2,24 lít. |
D. 5,04 lít. |
Câu 40: Thạch cao sống là:
|
A. 2CaSO4. H2O. |
B. CaSO4.2H2O. |
|
C. CaSO4.H2O. |
D. CaSO4. |
Lời giải chi tiết
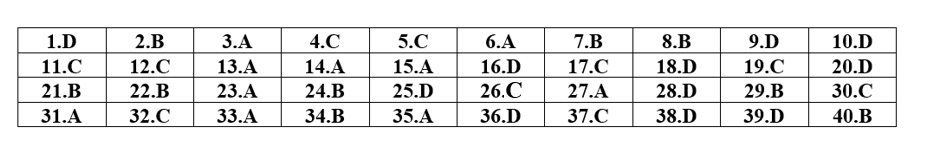
ĐÁP ÁN
HƯỚNG DẪN GIẢI CHI TIẾT
Câu 1:
Phương pháp:
Viết CTPT của mỗi quặng sắt rồi tính %Fe
Hướng dẫn giải:
Quặng xiderit: FeCO3
%Fe = 56/(56+60) * 100% = 48,27%
Quặng manhetit: Fe3O4
%Fe = (56*3) / (56*3 + 16*4) = 72,41%
Quặng hemantit đỏ: Fe2O3
%Fe = (56*2) / (56*2 + 16*3) = 70%
Quặng hemantit nâu: Fe2O3. nH2O
%Fe = (56*2) / (56*2 + 16*3 + 18*n) < 70%
Đáp án D
Câu 2:
Phương pháp:
Dựa vào đáp án (chất tham gia phản ứng) và dãy chuyển hóa để chọn đáp án đúng
Hướng dẫn giải:
Đáp án A sai vì Fe không tác dụng với NaCl
Đáp án C,D sai vì Fe tác dụng với HCl ra muối Fe (II)
Đáp án B
Câu 3:
Phương pháp:
Dựa vào điện tích hạt nhân và quy tắc viết cấu hình e để viết cấu hình e của Fe
Hướng dẫn giải:
ZFe = 26 => Cấu hình e là: 1s22s22p63s23p63d64s2
Đáp án A
Câu 4:
Phương pháp:
Áp dụng phương pháp cân bằng electron để cân bằng phương trình.
Từ giá trị của a => b
Hướng dẫn giải:
Phương trình sau khi được cân bằng là:
Al + 4HNO3 \(\xrightarrow{{}}\) Al(NO3)3 + 3NO + H2O
=> b = 4a
Mà a = 2 => b = 8
Đáp án C
Câu 5:
Phương pháp:
Xem lại lý thuyết Kim loại kiềm thổ
Hướng dẫn giải:
Mg là kim loại kiềm thổ, thuộc nhóm IIA
Đáp án C
Câu 6:
Phương pháp:
- Quy đổi hỗn hợp thành: FeO; Fe2O3
- Áp dụng định luật bảo toàn nguyên tố để giải bài toán
Hướng dẫn giải:
Sau khi quy đổi ta có:
\((FeO,F{{e}_{2}}{{O}_{3}})\xrightarrow{+HCl}(FeC{{l}_{2}},FeC{{l}_{3}})\)
Ta có nFeCl2 = 0,06 (mol)
Áp dụng định luật bảo toàn nguyên tố
1 mol FeO tác dụng với HCl tạo ra 1 mol FeCl2
=> nFeO = nFeCl2 = 0,06 (mol)
mFe2O3 = 9,12 – 0,06 * (56 + 16) = 4,8g
nFe2O3 = 0,03 (mol)
1 mol Fe2O3 tác dụng với HCl tạo ra 2 mol FeCl3
=> nFeCl3 = 2 nFe2O3 = 0,06 (mol)
=> mFe2O3 = 9,75g
Đáp án A
Câu 7:
Phương pháp:
Áp dụng các định luật bảo toàn để giải bài toán
Hướng dẫn giải:
Ta có
Khi cho NaOH dư vào thì kết tủa thu được sau phản ứng chỉ có chứa Mg(OH)2
nMg = nMg(OH)2 = 0,3 (mol)
Mặt khác, X chứa H2 nên Y sẽ không còn NO3-
Áp dụng định luật bảo toàn nguyên tố N
=> nNH4+ = 0,34 – 0,2 – 0,06 = 0,08 (mol)
Vậy nNaOH phản ứng
= 4 * nAl + 2 * nMg + nNH4+ = 2,28
=> nAl = 0,4 (mol)
Gọi nKHSO4 là x => nSO42- = x
Áp dụng định luật bảo toàn điện tích ta có
3 * nAl + 2 * nMg + x + 0,08 = 2x
=> 3 * 0,4 + 2 * 0,3 + x + 0,08 = 2x
=> x = 1,88 (mol)
Ta lại có :
nH+ = 2 * nO+ 4 * nNO + 2 * nNO2 + 2 * nH2 + 10 * nNH4
=> 0,34 + 1,88 = 2 * NO + 4 * 0,2 + 2 * 0,06 + 2 * 0,1 + 10 * 0,08
=> nO = 0,15 (mol)
nO = nMgO = 0,15 mol => nMg = 0,3 – 0,15 = 0,15 (mol)
=> % Mg = 0,15 * 40 : (0,15 * 40 + 0,15 * 24 + 0,4 * 27 ) = 17,65%
Đáp án B
Câu 8:
Phương pháp:
Để bảo vệ kim loại A theo phương pháp điện hóa ta cần dùng kim loại B có khả năng hoạt động hóa học mạnh hơn A để chống ăn mòn
Hướng dẫn giải:
Tàu bằng thép chứa thành phần chủ yếu là Fe, ta cần chọn kim loại có khả năng hoạt động hóa học mạnh hơn Fe => đó là kim loại Zn
Đáp án B
Câu 9:
Phương pháp:
Áp dụng định nghĩa oxit bazo, dựa vào đáp án để chọn phương án đúng
Hướng dẫn giải:
Oxit bazơ: là những oxit tác dụng với axit tạo thành muối và nước.(trừ một số oxit lưỡng tính: Al2O3; ZnO,…)
Đáp án A,B là oxit axit
Đáp án C là bazo
Đáp án D
Câu 10:
Phương pháp:
Xét quá trình phản ứng và hiện tượng thu được khi cho CO2 đến dư vào Ca(OH)2
Hướng dẫn giải:
Thứ tự phản ứng là
CO2 + Ca(OH)2 → CaCO3↓ + H2O
CO2 + CaCO3 + H2O → Ca(HCO3)2
=> xuất hiện kết tủa sau đó kết tủa tan
Đáp án D
Câu 11:
Phương pháp:
Áp dụng định luật bảo toàn nguyên tố và bảo toàn khối lượng để giải bài toán
Hướng dẫn giải:
nHCl phản ứng = 2nO + 2nH2
Ta có
nO = 4 * nFe3O4 = 0,04 * 4 = 0,16 (mol)
=> nHCl = 2 * 0,16 + 2 * 0,15 = 0,62 (mol)
=> nCl- = 0,62 (mol)
=> m muối = mAl + mFe + mCl-
= 0,12 * 27 + 0,04 * 3 * 56 + 0,62 * 35,5 = 31,97 (g)
Đáp án C
Câu 12:
Phương pháp:
Xem lại tính chất hóa học của nhôm oxit
Hướng dẫn giải:
Nhôm oxit là một oxit lưỡng tính, nên có thể tác dụng với axit, dung dịch kiềm, hay muối có môi trường axit, kiềm
NaOH là dung dịch kiềm; HCl là 1 axit
Đáp án C
Câu 13:
Phương pháp:
Xem lại phần nước cứng trong chương trình hóa học lớp 12
Hướng dẫn giải:
Nước cứng vĩnh cửu là nước cứng chứa các ion: Ca2+; Mg2+; Cl-; SO42-
Để làm mềm nước cứng vĩnh cửu ta cần kết tủa hết ion Ca2+ và Mg2+
Vậy 2 dung dịch có thể làm được điều này là Na2CO3 và Na3PO4
Đáp án A
Câu 14:
Phương pháp:
Áp dụng định luật bảo toàn khối lượng để giải bài toán này
Hướng dẫn giải:
CaCO3 \(\xrightarrow{{{t}^{0}}}\) CaO + CO2
Sau khi nung, khối lượng chất rắn giảm đi chính là khối lượng của CO2 bay ra
=> m CO2 = 100 – 60,4 = 39,6 (g)
n CO2 = nCaCO3 = 39,6 : 44 = 0,9 (mol)
%m CaCO3 = 0,9*100/100 *100% = 90%
Đáp án A
Câu 15:
Phương pháp:
Xem lại phần tính chất kim loại kiềm trong chương trình hóa học lớp 12
Hướng dẫn giải:
Để bảo quản Na người ta cần ngâm trong dầu hỏa để tránh tiếp xúc với không khí, nước ngoài môi trường
Đáp án A
Câu 16:
Phương pháp:
Để VCO2 max => Qúa trình hóa học diễn ra 2 phản ứng, tạo ra kết tủa, sau đó kết tủa tan một phần
Áp dụng định luật bảo toàn nguyên tố để giải bài toán
Hướng dẫn giải:
Vì VCO2 max => nCO2 phản ứng phải lớn nhất
Qúa trình hóa học diễn ra 2 phản ứng, tạo ra kết tủa, sau đó kết tủa tan một phần
Vậy sau phản ứng sẽ sinh ra kết tủa CaCO3 và trong dung dịch sẽ có chứa Ca(HCO3)2
nCaCO3 = 10/100 = 0,1 (mol)
Áp dụng định luật bảo toàn nguyên tố Canxi
=> nCa(HCO3)2 = nCa(OH)2 – nCaCO3
= 0,2 – 0,1 = 0,1 (mol)
Áp dụng định luật bảo toàn nguyên tố Cacbon
=> n CO2 = n CaCO3 + 2 n Ca(HCO3)2 = 0,3 (mol)
=> VCO2 = 0,3 * 22,4 = 6,72 (lit)
Đáp án D
Câu 17:
Phương pháp:
Khảo sát phản ứng hóa học => hiện tượng dựa vào sản phẩm
Hướng dẫn giải:
(a) Na + H2O → NaOH + ½ H2
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
(b) HSO4- + HCO3- → SO42- + CO2 + H2O
(c) 2HCl + Na2CO3 → 2NaCl + CO2 + H2O
(d) Cu + 2 FeCl3 → CuCl2 + 2 FeCl2
(e) CuSO4 + H2O \(\xrightarrow{dp\text{dd}}\) Cu + H2SO4 + ½ O2
(f) Na2O + H2O → NaOH
Al + NaOH + H2O → NaAlO2 + 3/2 H2
Vậy có tất cả 5 thí nghiệm sinh ra khí
Đáp án C
Câu 18:
Phương pháp:
Xem lại phần điều chế kim loại trong chương trình hóa học lớp 12
Hướng dẫn giải:
Ca là kim loại mạnh đứng trước Al trong dãy hoạt động hóa học, nên để điều chế Canxi người ta sẽ dùng phương pháp điện phân nóng chảy
Đáp án D
Câu 19:
Phương pháp:
Xem xét hệ số cân bằng, sản phẩm sau phản ứng của mỗi phương trình
Hướng dẫn giải:
Đáp án C sai do Fe tác dụng với H2SO4 loãng thì chỉ thu được muối Fe (II)
Đáp án C
Câu 20:
Phương pháp:
Tính được nAl; nNaOH => chất dư => nH2 => VH2
Hướng dẫn giải:
Al + NaOH + H2O → NaAlO2 + 3/2 H2
nAl = 0,2 (mol); nNaOH = 0,2 (mol)
ð 2 chất phản ứng vừa đủ
Ta có nH2 = 3/2 nAl = 0,3 (mol)
ð VH2 = 6,72 (lit)
Đáp án D
Câu 21:
Phương pháp:
Xét sản phẩm sinh ra sau mỗi phản ứng => sản phẩm
Hướng dẫn giải:
Đáp án A: Nhiệt phân Fe(NO3)2 sẽ sinh ra Fe2O3 => loại
Đáp án C,D đều chứa Fe2+ và H+, NO3- => sinh ra Fe3+ => loại
Đáp án B
Câu 22:
Phương pháp:
Xem lại phần lý thuyết bài Nhôm trong chương trình hóa học lớp 12
Hướng dẫn giải:
Nguyên liệu chính để sản xuất nhôm là quặng boxit
Đáp án B
Câu 23:
Phương pháp:
Xem lại phần lý thuyết nước cứng hóa lớp 12
Hướng dẫn giải:
Nước cứng là nước trong thành phần chứa nhiều ion Ca2+ và Mg2+
Đáp án A
Câu 24:
Phương pháp:
Dung dịch có khả năng phản ứng với Fe là: dung dịch axit (trừ HNO3 đặc nguội; H2SO4 đặc nguội) và dung dịch muối của kim loại đứng sau Fe trong dãy hoạt động hóa học
Hướng dẫn giải:
Hai dung dịch có khả năng tác dụng với Fe là CuSO4 và HCl
Đáp án B
Câu 25:
Phương pháp:
Xem lại Đại cương kim loại phần tính chất hóa học trong chương trình hóa học lớp 12
Hướng dẫn giải:
Tính chất hóa học đặc trung của kim loại là tính khử
Đáp án D
Câu 26:
Phương pháp:
Xem lại Đại cương kim loại phần tính chất vật lý trong chương trình hóa học lớp 12
Hướng dẫn giải:
Bạc là kim loại có tính dẫn điện, dẫn nhiệt tốt nhất.
Đáp án A
Câu 27:
Phương pháp:
Xét CTPT là MCl => Viết phương trình => Kim loại kiềm
Hướng dẫn giải:
Gọi CTPT của muối clorua kim loại kiềm là : MCl
Ta có phương trình:
2 MCl → 2M + Cl2
nCl2 = 1,792 : 22,4 = 0,08 (mol)
nM = 2 nCl2= 0,16 mol
=> MM = 6,24 : 0,16 = 39 (g/mol)
=> M là K
Đáp án A
Câu 28:
Phương pháp:
Xem lại phần dãy điện hóa, cặp OXH – khử để chọn phương án đúng
Hướng dẫn giải:
Ta có
chất khử mạnh + chất OXH mạnh → chất khử yếu + chất OXH yếu
=> Fe có tính khử mạnh hơn Cu
=> Cu2+ có tính OXH mạnh hơn Fe2+
Đáp án D
Câu 29:
Phương pháp:
Xác định lượng chất tan (NaOH) trong dung dịch
Tìm được mdd sau phản ứng => C%
Hướng dẫn giải:
nNa = nNaOH = 2,3 : 23 = 0,1 (mol)
n H2 = ½ n Na = 0,05 (mol)
Khối lượng dung dịch sau phản ứng là:
mNa + m H2O – m H2
= 2,3 + 180 – 0,05 * 2= 182,2 (g)
C% NaOH = mct/mdd * 100%
= (0,1 * 40) : 182,2 * 100% = 2,2%
Đáp án B
Câu 30:
Phương pháp:
Áp dụng định luật bảo toàn e để làm bài toán này
Hướng dẫn giải:
Al + HNO3 sinh ra 2 sản phẩm khử là 0,1 mol N2O và 0,1 mol N2
Áp dụng định luật bảo toàn e ta có
3 * nAl = 8 * n N2O + 10 * n N2
= 8 * 0,1 + 10 * 0,1 = 1,8 (mol)
=> nAl = 1,8 : 3 = 0,6 (mol)
=> mAl = 16,2 (gam)
Đáp án C
Câu 31:
Phương pháp:
Xem lại phần tính chất hóa học trong đại cương kim loại
Hướng dẫn giải:
Kim loại có tính khử mạnh nhất là kim loại kiềm thuộc nhóm IA
Đáp án A
Câu 32:
Phương pháp:
Áp dụng định luật bảo toàn nguyên tố và bảo toàn khối lượng để giải bài toán
Hướng dẫn giải:
nFeCl2 = 0,15 (mol)
Kết tủa thu được sau phản ứng gồm có AgCl và Ag.
nAg = n FeCl2 = 0,15 (mol)
nAgCl = nCl- = 2 nFeCl2 = 0,3 (mol)
=> a = mAg + mAgCl = 0,15 * 108 + 0,3 * 143,5 = 59,25 (gam)
Đáp án C
Câu 33:
Phương pháp:
Xem lại phần điều chế kim loại trong chương trình hóa học lớp 12
Hướng dẫn giải:
Kim loại không được điều chế bằng phương pháp thủy luyện là kim loại mạnh, đứng trước Al
Đáp án A
Câu 34:
Phương pháp:
Ta gọi chung công thức phân tử muối cacbonat của 2 muối trên là MCO3
Áp dụng phương pháp tăng giảm khối lượng => Số mol 2 kim loại
=> Khối lượng mol trung bình => 2 kim loại cần tìm
Hướng dẫn giải:
MCO3 + 2HCl → MCl2 + CO2 + H2O
1 mol MCO3 tạo ra 1 mol MCl2 khiến khối lượng muối tăng lên
(M +71) – (M + 60) = 11 gam
Theo đề bài, x mol MCO3 tạo ra x mol MCl2 thì khối lượng tăng lên là:
20,6 – 18,4 = 2,2 gam
=> X = 0,2 (mol)
=> Khối lượng mol trung bình của MCO3 là:
18,4 : 0,2 = 92 (gam/mol)
=> Khối lượng mol trung bình của M là:
92 – 60 = 32 (g/mol)
Mặt khác đây là 2 kim loại kiềm thổ, thuộc 2 chu kì liên tiếp
=> 2 KL đó là Mg và Ca
Đáp án B
Câu 35:
Phương pháp:
Xem lại bài hợp chất của kim loại kiềm trong chương trình hóa học lớp 12
Hướng dẫn giải:
Chất mà đề bài đang đề cập là NaOH
Đáp án A
Câu 36:
Phương pháp:
Bài tập này đơn giản và có nhiều cách để xử lý, em có thể viết phương trình hay dùng phương pháp bảo toàn e để giải
Hướng dẫn giải:
Ta có nFe = nH2 = 0,2 (mol)
ð mFe = 0,2 * 56 =11,2 (g)
Đáp án D
Câu 37:
Phương pháp:
Áp dụng định luật bảo toàn nguyên tố và bảo toàn khối lượng để giải bài tập này
Hướng dẫn giải:
Vì sau khi ta cho Y vào axit chỉ thu được muối => Y phản ứng vừa đủ với axit
Vậy, nếu như ta cho X vào axit thì lượng khí H2 thu được sau phản ứng là:
nH2 = ½ nH(axit) = ½ * 0,066 = 0,033 (mol)
Mặt khác khi cho X vào nước thì thu được 0,0405 mol H2
=> nH2 sinh ra từ H2O là: 0,0405 – 0,033 = 0,0075 (mol)
=> nAl = 2/3 * 0,0075 = 0,005 (mol)
m↓ = 1,089 (g) => nBaSO4 = (1,089 – 0,005 * 78) = 0,003 (mol)
Dung dịch Z có nSO42- = 0,018 – 0,003 = 0,015 (mol)
Áp dụng định luật bảo toàn khối lượng ta có:
mionKL = mmuối – mCl- - mSO42-
= 3,335 – 0,03 * 35,5 – 0,015 * 96 = 0,83 (gam)
mX = mionKL + mBa2+ + mAl3+(trong Al(OH)3)
= 0,83 + 0,003 * 137 + 0,005 * 27 = 1,376 (g)
%Ba = 29,87%
Đáp án C
Câu 38:
Phương pháp:
Khí bị hấp thụ là khí có khả năng tác dụng được với NaOH
Hướng dẫn giải:
Khí bị hấp thụ bởi dung dịch NaOH là CO2
Đáp án
Câu 39:
Phương pháp:
Áp dụng định luật bảo toàn nguyên tố ta luôn có nCO = nO (trong oxit kim loại)
Hướng dẫn giải:
Ta có n Fe = 8,4 : 56 = 0,15 (mol)
Vậy n O trong Fe2O3 là:
0,15 :2 * 3 = 0,225 (mol)
=> nCO = nO = 0,225 mol
VCO = 0,225 * 22,4 = 5,04 (lít)
Đáp án D
Câu 40:
Phương pháp:
Xem lại phần bài kim loại kiềm thổ trong chương trình hóa học lớp 12
Hướng dẫn giải:
Thạch cao sống có CTPT là CaSO4.2H2O
Đáp án B
Nguồn: Sưu tầm
Loigiaihay.com
- Giải đề thi học kì 2 hoá lớp 12 năm 2019 - 2020 sở giáo dục Khánh Hòa
- Giải đề thi học kỳ II môn Hóa 12 sở GD-ĐT Tây Ninh
- Đề thi hết học kì II năm học 2017 - 2018 sở GDDT Nam Định có lời giải
- Giải đề thi học kì 2 hoá lớp 12 năm 2019 - 2020 trường THPT Trần Hưng Đạo
- Giải đề thi hết học kì II Hóa 12 năm học (2019 - 2020) THPT Yên Lạc Vĩnh Phúc có lời giải
>> Xem thêm
Các bài khác cùng chuyên mục
- Đề số 10 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 9 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 8 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 7 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 6 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 10 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 9 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 8 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 7 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 6 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết