Giải bài tập hóa học 12, Hóa 12 - Để học tốt hóa học 12
Giải bài tập hóa học 12, Hóa 12 - Để học tốt hóa học 12
 Đề thi học kì 2 của các trường có lời giải – Mới nhất
Đề thi học kì 2 của các trường có lời giải – Mới nhất
Giải đề thi học kì 2 hoá lớp 12 năm 2019 - 2020 sở giáo dục Khánh Hòa
Giải chi tiết đề thi học kì 2 môn hoá lớp 12 năm 2019 - 2020 sở giáo dục Khánh Hòa với cách giải nhanh và chú ý quan trọng
Đề bài
Câu 1: Nước cứng là nước chứa nhiều ion nào sau đây?
A. Na+, K+
B.Ca2+, Mg2+
C.Cu2+, Fe2+
D. Al3+, Fe3+
Câu 2: Cho lượng dư Fe lần lượt tác dụng với các chất: khí Cl2; dung dịch HNO3 loãng, dung dịch HCl và dung dịch CuSO4. Sau khi các phản ứng xảy ra hoàn toàn, số trường hợp sinh ra muối sắt (II) là?
A.3 B. 2
C. 4 D. 1
Câu 3 : Kim loại Al phản ứng với dung dịch nào sau đây?
A.Mg(NO3)2 B.H2SO4 đặc nguội
C.BaCl2 D. NaOH
Câu 4 : Khi dẫn CO2 từ từ đến dư vào dung dịch Ca(OH)2 thấy có
A. bọt khí bay ra
B. kết tủa trắng xuất hiện
C. kết tủa trắng sau đó kết tủa tan dần
D. bọt khí và kết tủa trắng
Câu 5 : Cho 6,145 gam hỗn hợp gồm FeCl2 và FeCl3 có tỉ lệ mol tương ứng là 1:3 tác dụng hết với dung dịch NaOH dư thu được kết tủa Y. đem nung Y trong không khí đến khối lượng không đổi thu được chất rắn có khối lượng m gam. Gía trị của m là
A. 1,6 B. 3,2
C. 2,4 D. 12,8
Câu 6 : Có 4 dung dịch riêng biệt: a) HCl, b) CuCl2, c) FeCl2, d) HCl có lẫn ZnCl2. Nhúng vào mỗi dung dịch 1 thanh Zn nguyên chất. Số trường hợp xuất hiện ăn mòn điện hóa là?
A. 1 B. 3
C. 4 D. 2
Câu 7 : Dẫn V lít CO2 (dktc) vào dung dịch Ca(OH)2 thu được 30 gam kết tủa và dung dịch X, đun nóng dung dịch lại thu thêm được 10 gam kết tủa nữa. Gía trị của V là?
A. 6,72 B. 11,2
C. 5,6 D. 7,84
Câu 8 : Sắt có thể tan trong dung dịch nào sau đây?
A.FeCl2 B.FeCl3
C. AlCl3 D. ZnCl2
Câu 9 : Phèn chua được dùng trong ngành công nghiệp thuộc da, công nghiệp giấy, chất cầm màu trong ngành nhuộm vải, chất làm trong nước. Công thức hóa học của phèn chua là?
A. K2SO4.Al2(SO4)3.24H2O
B. Li2SO4.Al2(SO4)3.24H2O
C (NH4)2SO4.Al2(SO4)3.24H2O
D. Na2SO4.Al2(SO4)3.24H2O
Câu 10 : Hòa tan hoàn toàn 3,25 gam hỗn hợp Fe2O3, ZnO, MgO trong dung dịch H2SO4 0,1M (vừa đủ). Sau phản ứng, cô cạn dung dịch thu được muối khan có khổi lượng là:
A.5,65 gam B. 6,81 gam
C. 3,18 gam D. 5,81 gam
Câu 11 : Kim loại Fe không tác dụng được với dung dịch nào sau đây?
A. HCl B.CuSO4
C. MgCl2 D. HNO3 loãng
Câu 12 : Chất nào sau đây được dùng trong y học bó bột khi xương gãy
A. CaSO4.H2O B. MgSO4.7H2O
C. CaSO4 D. CaSO4.2H2O
Câu 13 : Công thức của Fe(II) hidroxit là?
A. Fe2O3 B.FeO
C.Fe(OH)3 D. Fe(OH)2
Câu 14 : Để bảo quản kim loại kiềm có thể thực hiện cách nào sau đây?
A. Ngâm trong ancol etylic nguyên chất
B. Ngâm trong dung dịch kiềm
C. Ngâm trong nước
D. Ngâm trong dầu hỏa
Câu 15 : Cho dãy các kim loại: Fe, Na, K, Ca, Al, Be. Số kim loại trong dãy tác dụng được với nước ở nhiệt độ thường là?
A. 4 B. 1
C. 2 D. 3
Câu 16 : Nung nóng m gam hỗn hợp Al và Fe2O3 (trong môi trường không có không khí) đến khi phản ứng xảy ra hoàn toàn thu được hỗn hơp rắn Y. Chia Y thành 2 phần bằng nhau:
- Phần 1: tác dụng với dung dịch H2SO4 loãng (dư) sinh ra 7,84 lít khí H2 (đktc)
- Phần 2: Tác dụng với dung dịch NaOH dư sinh ra 3,36 lít khí H2 (đktc). Gía trị của m là?
A. 40,85 B. 44,8
C. 21,4 D. 48,2
Câu 17 : Hai kim loại có thể được điều chế bằng phương pháp điện phân dung dịch là?
A. Na, Fe B. Al, Mg
C. Cu, Ag D. Mg, Zn
Câu 18 : Cấu hình e nào sau đây là của ion Fe3+
A. [Ar]3d3 B. [Ar]3d6
C. [Ar]3d4 D. [Ar]3d5
Câu 19 : Cho khí CO dư gồm hỗn hợp Fe2O3, Al2O3, MgO (nung nóng). Khi phản ứng xảy ra hoàn toàn thu được chất rắn gồm
A. Fe2O3, Al2O3, Mg
B. Fe, Al, Mg
C. Fe, Al2O3, MgO
D. Fe, Al, MgO
Câu 20 : Cho sơ đồ chuyển hoá: Fe\(\xrightarrow{X}\)FeCl2\(\xrightarrow{Y}\)Fe(OH)2 (mỗi mũi tên ứng với một phản ứng). Hai chất X, Y lần lượt là
A. NaCl, Cu(OH)2 B. Cl2, NaOH
C. HCl, Al(OH)3 D. HCl, KOH
Câu 21 : Nhôm có số hiệu nguyên tử là 13. Vị trí nhôm trong bảng tuần hoàn là?
A. Ô thứ 13, chu kì 3, nhóm IIIB
B. Ô thứ 13, chu kì 2, nhóm IIIA
C. Ô thứ 13, chu kì 3, nhóm IIIA
D. Ô thứ 13, chu kì 2, nhóm IIIB
Câu 22 : Khi điện phân nóng chảy muối clorua của kim loại M, người ta thu được 0,896 lít khí (đktc) ở anot và 3,12 gam kim loại ở catot. Công thức muối clorua đã điện phân là?
A. NaCl B. MgCl2
C. KCl D. CaCl2
Câu 23 : Khử 1 oxit sắt bằng CO ở nhiệt độ cao phản ứng xong người ta thu được 1,68 gam Fe và 896 ml khí CO2 (đktc). Công thức phân tử của oxit sắt trên là?
A. Không xác định được
B. Fe3O4
C. Fe2O3
D. FeO
Câu 24 : Cho 5,4 Al tác dụng hoàn toàn với dung dịch NaOH dư. Sau khi phản ứng kết thúc, thể tích khí H2 thoát ra là?
A. 4,48 lít B. 6,72 lít
C. 2,24 lít D. 3,36 lít
Câu 25 : Kim loại nào sau đây có tính dẫn điện tốt nhất trong tất cả các kim loại
A. Bạc B. Nhôm
C. Vàng D. Đồng
Câu 26 : Để bảo vệ vỏ tàu biển làm bằng thép người ta thường gắn vào vỏ tàu (phần ngâm dưới nước) những tấm kim loại sau đây?
A. Zn B. Cu
C. Pb D. Sn
Câu 27 : Sục khí CO2 đến dư vào NaAlO2. Hiện tượng xảy ra là?
A. Có kết tủa nâu đỏ
B. Có kết tủa keo trắng
C. Dung dịch vẫn trong suốt
D. Có kết tủa keo trắng sau đó kết tủa tan
Câu 28 : Kim loại phản ứng được với dung dịch H2SO4 loãng là?
A. Mg B. Cu
C. Au D. Ag
Câu 29 : Kim loại nào sau đây có tính oxi hóa yếu nhất?
A. Mg2+ B. Al3+
C. Ag+ D. Fe2+
Câu 30 : Cho các thí nghiệm sau:
(a) Cho CaCO3 vào dung dịch HCl dư
(b) Cho hỗn hợp Na2O và Al2O3 (tỉ lệ mol tương ứng 1:1) vào H2O dư
(c) Cho Ag vào dung dịch HCl dư
(d) Cho Na vào dung dịch NaCl dư
(e) Cho Cu vào dung dịch FeCl3 dư
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm có sự hòa tan chất rắn là
A. 3 B. 4
C. 5 D. 2
Câu 31 : Hỗn hợp X gồm Al, Al2O3, Fe3O4, CuO, Fe, Cu (trong đó oxi chiếm 20,4255% về khối lượng). Cho 6,72 lít khí CO đi qua 35,25 gam X nung nóng, sau một thời gian thu được hỗn hợp chất rắn Y và hỗn hợp khí Z có tỉ khối so với H2 bằng 18. Hòa tan Y trong dung dịch HNO3 loãng dư, sau khi các phản ứng hoàn toàn thu được dung dịch chứa m gam muối (không có NH4NO3) VÀ 4,48 lít hỗn hợp khí T gồm NO và N2O. Tỉ khối của T so với H2 bằng 16,75. Gía trị của m là?
A. 96,25 B. 117,95
C. 80,75 D. 139,5
Câu 32 : Kim loại nào sau đây là kim loại kiềm?
A. Mg B. Ca
C. Al D. Li
Câu 33 : Chất có thể dùng làm mềm nước cứng tạm thời là?
A. NaHSO4 B. HCl
C. Ca(OH)2 D. NaCl
Câu 34 : Sản phẩm tạo thành có chất kết tủa khi cho Na2CO3 tác dụng với chất nào sau đây?
A. CaCl2 B. KCl
C. NaNO3 D. KOH
Câu 35 : Nhúng thanh sắt vào dung dịch CuSO4, sau một thời gian lấy thanh sắt ra rửa sạch, sấy khô thấy khối lượng tăng 1,6 gam. Khối lượng Cu bám vào thanh sắt là?
A. 9,5 gam B. 12,8 gam
C. 9,6 gam D. 9,4 gam
Câu 36 : Một hỗn hợp X gồm 2 kim loại kiềm A,B thuộc 2 chu kì liên tiếp, có khối lượng 8,5 gam. Cho hỗn hợp X phản ứng hoàn toàn với H2O thấy thoát ra 3,36 lít khí H2. Hai kim loại A,B là?
A. Li, Na B. Na, K
C. K, Rb D. K, Cs
Câu 37 : Cho phản ứng: aAl + bHNO3 \(\xrightarrow{{}}\) cAl(NO3)3 + dNO + eH2O.
Hệ số a,b,c,d,e là các số nguyên, tối giản. Tổng hệ số (a+b) là?
A. 5 B. 6
C. 7 D. 4
Câu 38 : Chỉ dùng dung dịch NaOH để phân biệt được các chất riêng biệt trong nhóm nào sau đây?
A. Mg, Al2O3, Al B. Mg, Na, K
C. Fe, Al2O3, Mg D. Zn, Al2O3, Al
Câu 39 : Điện phân 150 ml dung dịch AgNO3 1M (điện cực trơ) với cường độ dòng điện không đổi 2,68 A sau thời gian t giờ thu được dung dịch X. Cho 12,6 gam Fe vào dung dịch X, sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y, khí NO (sản phẩm khử duy nhất của N+5) và 14,5 gam hỗn hợp kim loại. Gỉa thiết hiệu suất điện phân là 100%, nước bay hơi không đáng kể. Gía trị của t là?
A. 1,0 B. 1,2
C. 0,3 D. 0,8
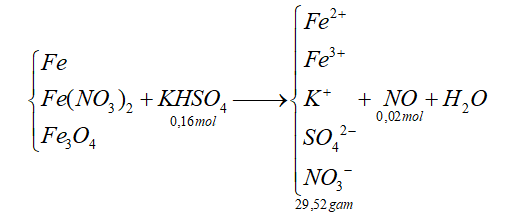
Câu 40 : Cho hỗn hợp X gồm Fe, Fe3O4 và Fe(NO3)2 tan hết trong 400 ml dung dịch KHSO4 0,4M. Sau phản ứng thu được dung dịch Y chỉ chứa 29,52 gam muối trung hòa và 0,448 lít NO (đktc, sản phẩm khử duy nhất). Cho dung dịch NaOH dư vào Y thì có 8,8 gam NaOH phản ứng. Dung dịch Y hòa tan tối đa m gam bột Cu. Biết các phản ứng xảy ra hoàn toàn. Gía trị của m là?
A. 0,96 B. 1,92
C. 2,4 D. 2,24
Lời giải chi tiết
ĐÁP ÁN
|
1.B |
2. A |
3. D |
4. C |
5.B |
6.D |
7.B |
8.B |
9.A |
10.A |
|
11.C |
12.A |
13.D |
14.D |
15.D |
16.D |
17.C |
18.D |
19.C |
20.D |
|
21.C |
22.C |
23.B |
24.B |
25.A |
26.A |
27.C |
28.A |
29.A |
30.B |
|
31.B |
32.C |
33.A |
34.B |
35.B |
36.B |
37.A |
38.A |
39.A |
40.D |
Câu 1:
Phương pháp:
Xem lại phần nước cứng trong chương trình hóa học lớp 12
Hướng dẫn giải:
Nước cứng là nước có chứa nhiều ion: Ca2+ và Mg2+
Đáp án B
Câu 2:
Phương pháp:
Fe dư tác dụng với axit, dung dịch muối của kim loại đứng sau Fe trong dãy hoạt động thì sẽ cho ra dung dịch muối Fe(II)
Hướng dẫn giải:
Fe dư tác dụng với các dung dịch HNO3 loãng, HCl, CuSO4 sẽ cho ra muối Fe(II)
Đáp án A
Câu 3:
Phương pháp:
Xem lại phần lý thuyết Al trong chương trình hóa học lớp 12
Hướng dẫn giải:
Đáp án A: Sai vì Mg đứng trước Al
Đáp án B: Sai vì Al thụ động trong H2SO4 đặc nguội
Đáp án C: Sai vì Ba đứng trước Al
Đáp án D
Câu 4:
Phương pháp:
Xét quá trình phản ứng => xem sản phẩm và suy ra hiện tượng
Hướng dẫn giải:
CO2 + Ca(OH)2 → CaCO3 + H2O
CO2 + H2O + CaCO3 → Ca(HCO3)2
=> Sau phản ứng xuất hiện kết tủa trắng, sau đó kết tủa tan dần
Đáp án C
Câu 5:
Phương pháp:
Tìm số mol FeCl2, FeCl3 có trong hỗn hợp
=> kết tủa Y => Khối lượng chất rắn
Hướng dẫn giải:
Gọi nFeCl2 là x => nFeCl3 là 3x
Ta có phương trình: 127x + 162,5 *3x = 6,145 => x = 0,01 (mol)
Vậy nFeCl2 = 0,01 mol; nFeCl3 = 0,03 mol
=> Kết tủa Y gồm có Fe(OH)2 và Fe(OH)3
Vì nung kết tủa trong không khí => chất rắn thu được là Fe2O3
nFe2O3 = ½ nFe có trong X = ½ (0,01 + 0,03) = 0,02 (mol)
nFe2O3 = m chất rắn = 0,02 * 160 = 3,2 (gam)
Đáp án B
Câu 6:
Phương pháp:
Điều kiện để xuất hiện ăn mòn điện hóa là: Có xuất hiện 2 cực, tiếp xúc trực tiếp hay gián tiếp và cùng được nhúng trong 1 dung dịch
Hướng dẫn giải:
(a) Zn + HCl →ZnCl2 + H2 => Loại vì không có 2 cực
(b) Zn + FeCl2 →ZnCl2 + Fe => thỏa mãn
(c) Zn + CuCl2→ ZnCl2 + Cu => thỏa mãn
(d) Dung dịch HCl có lẫn ZnCl2 không thỏa mãn
Đáp án D
Câu 7:
Phương pháp:
Dựa vào dữ kiện bài toán => sản phẩm sau phản ứng
ÁP dụng định luật bảo toàn nguyên tố => V
Hướng dẫn giải:
Theo đề bài, đung nóng dung dịch X lại thu thêm được kết tủa
Vậy dung dịch sau phản ứng có chứa Ca(HCO3)2
Ca(HCO3)2 → CaCO3 + CO2 + H2O
Xét trong đung dịch X:
nCa(HCO3)2 = nCaCO3 = 10 : 100 = 0,1 (mol)
Sau khi dẫn CO2 vào Ca(OH)2 thu được 30 gam kết tủa
Vậy nCaCO3 = 30 : 100 = 0,3 (mol)
Áp dụng định luật bảo toàn nguyên tố C
nCO2 = nCaCO3 + 2nCa(HCO3)2 = 0,3 + 0,2 = 0,5 (mol)
VCO2 = 0,5 * 22,4 = 11,2 (lit)
Đáp án B
Câu 8:
Phương pháp:
Sắt có thể tan trong dung dịch muối của kim loại đứng sau Fe trong dãy hoạt động hóa học và dung dịch axit (trừ HNO3 đặc nguội và H2SO4 đặc nguội)
Hướng dẫn giải:
Fe + 2FeCl3 →3FeCl2
Đáp án B
Câu 9:
Phương pháp:
Xem lại phần lý thuyết về nhôm trong chương trình hóa học lớp 12
Hướng dẫn giải
Công thức hóa học của phèn chua là K2SO4.Al2(SO4)3.24H2O
Đáp án A
Câu 10:
Phương pháp:
Áp dụng định luật bảo toàn khối lượng để giải bài toán này
Hướng dẫn giải:
Ta có n H2SO4 = 0,1 * 0,3 = 0,03 (mol)
M2On + nH2SO4 → M2(SO4)n + nH2O
Ta thấy nO (trong oxit) = nSO42- = 0,03 (mol)
=> mmuối = m KL + m SO42-
= moxit – mO + mSO42-
= 3,25 – 0,03 * 16 + 0,03 * 96 = 5,65 (g)
Đáp án A
Câu 11:
Phương pháp:
Sắt có thể tan trong dung dịch muối của kim loại đứng sau Fe trong dãy hoạt động hóa học và dung dịch axit (trừ HNO3 đặc nguội và H2SO4 đặc nguội)
Hướng dẫn giải:
Fe không tan trong dung dịch MgCl2 (do Mg đứng trước Fe)
Đáp án C
Câu 12:
Phương pháp:
Xem lại tính chất các hợp chất của kim loại kiềm thổ trong chương trình hóa học 12
Hướng dẫn giải:
Thạch cao nung được dùng để bó bột khi xương bị gãy có CTPT là CaSO4.H2O
Đáp án A
Câu 13:
Phương pháp:
Xem lại phần đọc tên bazo có trong chương trình hóa học lớp 9
Hướng dẫn giải:
Công thức sắt(II) hidroxit là Fe(OH)2
Đáp án D
Câu 14:
Phương pháp:
Xem lại phần lý thuyết kim loại kiềm có trong chương trình hóa học lớp 12
Hướng dẫn giải:
Để bảo quản kim loại kiềm người ta thường ngâm chúng trong dầu hỏa
Đáp án D
Câu 15:
Phương pháp:
Các kim loại có khả năng tác dụng được với nước ở nhiệt độ thường là: Kim loại kiềm và một số kim loại kiềm thổ: Canxi, Bari.
Hướng dẫn giải:
Các kim loại trong dãy có khả năng tác dụng với nước ở nhiệt độ thường là: Na, K, Ca
Đáp án D
Câu 16:
Phương pháp:
+) phần 2 : Bảo toàn e :\(3{n_{Al}} = 2{n_{{H_2}}}\)
+) phần 1 : Bảo toàn e :\(3{n_{Al}} + 2{n_{Fe}} = 2{n_{{H_2}\,(1)}}\)
+) Bảo toàn nguyên tố Fe : \({n_{F{e_2}{O_3}}} = \frac{{{n_{Fe}}}}{2}\)
+) Bảo toàn nguyên tố O :\({n_{A{l_2}{O_3}}}\; = {\text{ }}{n_{F{e_2}{O_3}}}\;\)
+) Bảo toàn khối lượng : mtrước phản ứng = msau phản ứng =
\({m_{A{l_2}{O_3}}} + {m_{Fe}} + {m_{Al}}\)
Hướng dẫn giải:
Y tác dụng với NaOH giải phóng H2 → hỗn hợp rắn Y gồm Al2O3, Fe và Al dư
Xét phần 2 : Bảo toàn e : \(3{n_{Al}} = 2{n_{{H_2}}}\,\, \to \,\,{n_{Al}} = \frac{2}{3}{n_{{H_2}\,(2)}} = \,\,0,1\,\,mol\)
Xét phần 1 : Bảo toàn e :
\(3{n_{Al}} + 2{n_{Fe}} = 2{n_{{H_2}\,(1)}}\,\, \to \,\,{n_{Fe}} = \frac{{2{n_{{H_2}(1)}} - 3{n_{Al}}}}{2} = \frac{{2.0,35 - 3.0,1}}{2} = 0,2\,\,mol\)
Bảo toàn nguyên tố Fe :\({n_{F{e_2}{O_3}}} = \frac{{{n_{Fe}}}}{2} = 0,1\,\,mol\)
Bảo toàn nguyên tố O :\({n_{A{l_2}{O_3}}}\; = {\text{ }}{n_{F{e_2}{O_3}}}\; = {\text{ }}0,1{\text{ }}mol\;\)
Bảo toàn khối lượng : mtrước phản ứng = msau phản ứng = \({m_{A{l_2}{O_3}}} + {m_{Fe}} + {m_{Al}}\)
→ m = (0,1.102 + 0,2.56 + 0,1.27).2 = 48,2 gam
Đáp án D
Câu 17:
Phương pháp:
Kim loại có thể điều chế được bằng phương pháp điện phân dung dịch là những kim loại thuộc nhóm trung bình yếu (đứng sau Al)
Hướng dẫn giải:
Cu và Ag là 2 kim loại có thể điều chế bằng phương pháp điện phân dung dịch
Đáp án C
Câu 18:
Phương pháp:
Xem lại cách viết cấu hình e và cấu hình ion trong phần đại cương kim loại thuộc chương trình hóa học lớp 12
Hướng dẫn giải:
Cấu hình electron của Fe là: [Ar]3d64s2
Cấu hình electron của Fe3+ là: [Ar]3d5
Đáp án D
Câu 19:
Phương pháp:
CO,H2 có khả năng khử oxit của các kim loại đứng sau Al
Hướng dẫn giải:
Khi cho CO đi qua hỗn hợp các oxit Fe2O3, Al2O3, MgO thì chất rắn thu được sau phản ứng hoàn toàn là Fe, Al2O3, MgO
Đáp án C
Câu 20:
Phương pháp:
Xem lại phần tính chất hóa học của Fe có trong chương trình hóa học lớp 12
Hướng dẫn giải:
Đáp án A sai vì Fe không tác dụng với NaCl
Đáp án B sai do Fe tác dụng với Cl2 sinh ra muối FeCl3
Đáp án C sai do FeCl2 không tác dụng với Al(OH)3
Đáp án D
Câu 21:
Phương pháp:
Dựa vào số hiệu nguyên tử => Cấu hình e => vị trí
Hướng dẫn giải:
Cấu hình e của Al là: 1s22s22p63s23p1
Al thuộc ô số 13, chu kì 3 nhóm IIIA
Đáp án C
Câu 22:
Phương pháp:
Viết phương trình điện phân nóng chảy
Dựa vào dữ kiện đề bài => kim loại M => CTPT muối
Hướng dẫn giải:
Ta có: 2MClx → 2M + xCl2 (1)
nCl2 = 0,896 : 22,4 = 0,04 (mol)
(1) nM = 0,08/x (mol)
Vậy MM = 3,12 : 0,08/x = 39x
Vì x là hóa trị của KL nên x có thể nhận giá trị là 1, 2,3
Với x = 1 thì thỏa mãn. X là Kali
Vậy CTPT của muối là KCl
Đáp án C
Câu 23:
Phương pháp:
Áp dụng định luật bảo toàn nguyên tố ta luôn có
nCO = nO (trong oxi kim loại) = nCO2 (đối với phản ứng hoàn toàn)
Hướng dẫn giải:
Ta có nCO2 = nO(trong oxit KL) = 0,896 :22,4 = 0,04 (mol)
nFe = 1,68 :56 = 0,03 (mol)
nFe/nO = 3:4 => oxit Fe là Fe3O4
Đáp án B
Câu 24:
Phương pháp:
Để nhanh gọn chúng ta nên bảo toàn e cho bài toán này để ra được VH2
Hướng dẫn giải:
nAl = 5,4 : 27 = 0,2 (mol)
nH2 = 3/2 nAl = 0,3 (mol)
VH2 = 0,3 * 22,4 = 6,72 (lit)
Đáp án B
Câu 25:
Phương pháp:
Xem lại Đại cương kim loại phần tính chất vật lý trong chương trình hóa học lớp 12
Hướng dẫn giải:
Bạc là kim loại có tính dẫn điện tốt nhất trong các KL
Đáp án A
Câu 26:
Phương pháp:
Để bảo vệ kim loại A theo phương pháp điện hóa, người ta sẽ sử dụng kim loại B có mức độ hoạt động hóa học mạnh hơn kim loại A để bảo vệ
Hướng dẫn giải:
Để bảo vệ thép, người ta thường gắn vào vỏ tàu kim loại Zn
Đáp án A
Câu 27:
Phương pháp:
Khảo sát phương trình hóa học để suy ra sản phẩm thu được sau phản ứng
Hướng dẫn giải:
Ta có phương trình hóa học:
CO2 + 2NaAlO2 + 3H2O → 2Al(OH)3 + Na2CO3
Vậy sau phản ứng ta thu được kết tủa keo trắng của Al(OH)3
Đáp án C
Câu 28:
Phương pháp:
Kim loại tác dụng được với H2SO4 loãng là những kim loại đứng trước H trong dãy hoạt động hóa học
Hướng dẫn giải:
Mg là kim loại có khả năng tác dụng được với dung dịch H2SO4 loãng
Đáp án A
Câu 29:
Phương pháp:
Xem lại phần dãy điện hóa có trong chương trình hóa học lớp 12
Hướng dẫn giải:
Kim loại có tính khử mạnh nhất sẽ có ion mang tính OXH yếu nhất
Đáp án A
Câu 30:
Phương pháp:
Viết phương trình hóa học, áp vào điều kiện đề bài để chọn thí nghiệm phù hợp
Hướng dẫn giải:
(a) CaCO3 + HCl → CaCl2 + CO2 + H2O
(b) Na2O + H2O → 2NaOH
Al2O3 +2NaOH → 2NaAlO2 + H2O
(c) Không phản ứng
(d) Na + H2O → NaOH + ½ H2
(e) Cu + 2FeCl3 → CuCl2 + 2FeCl2
Vậy có tất cả 4 thí nghiệm có sự hòa tan chất rắn
Đáp án B
Câu 31:
Phương pháp:
Hướng dẫn giải:
Đáp án A
Câu 32:
Phương pháp:
Xem lại phần lý thuyết kim loại kiềm có trong chương trình hóa học lớp 12
Hướng dẫn giải:
Liti là 1 kim loại kiềm
Đáp án D
Câu 33:
Phương pháp:
Xem lại phần lý thuyết nước cứng có trong chương trình hóa học lớp 12
Hướng dẫn giải:
Nước cứng tạm thời gồm có các ion: Ca2+; Mg2+; HCO3-
Để làm mềm nước cứng tạm thời, người ta dùng Ca(OH)2 làm kết tủa hết ion Ca2+; Mg2+
OH- + HCO3- → CO32- +H2O
Đáp án C
Câu 34:
Phương pháp:
Xem lại phần lý thuyết hợp chất kim loại kiềm
Hướng dẫn giải:
Đáp án B,C,D đều là hợp chất của kali và natri. Dung dịch muối của chúng không thể tạo kết tủa được với Na2CO3 (do muối của K và Na đều tan)
Na2CO3 + CaCl2 → CaCO3 + 2NaCl
Đáp án A
Câu 35:
Phương pháp:
Viết phương trình, sử dụng phương pháp tăng giảm khối lượng để giải bài toán
Hướng dẫn giải:
Ta có phương trình hóa học:
Fe + CuSO4 →FeSO4 + Cu
Gọi nFe tham gia phản ứng là x (mol)
Vậy nCu sinh ra là x mol
=> Khối lượng kim loại tăng lên là: 64x – 56x = 8x = 1,6 (gam)
=> x = 0,2 (mol)
Vậy mCu = 0,2 * 64 = 12,8 (gam)
Đáp án B
Câu 36:
Phương pháp:
- Gọi kí hiệu hóa học chung của 2 kim loại kiềm trên là M
- Viết phương trình => MM => A, B
Hướng dẫn giải:
Ta có nM =2 nH2 = 2 * 3,36 : 22,4 = 0,3 (mol)
Khôi lượng mol của M = 8,5 : 0,3 = 28,3 (g/mol)
Mặt khác A,B thuộc 2 chu kì liên tiếp của nhóm IA
=> 2 kim loại cần tìm là Na và K
Đáp án B
Câu 37:
Phương pháp:
Sử dụng phương pháp cân bằng e để cân bằng phương trình với hệ số tối giản
Tính a+b
Hướng dẫn giải:
Ta có phương trình phản ứng
Al + 4HNO3 → Al(NO3)3 + 3NO + 2H2O
Vậy a = 1; b = 4
=> a + b = 5
Đáp án A
Câu 38:
Phương pháp:
- Xem lại tính chất hóa học của NaOH có trong chương trình hóa học lớp 12
- Dựa vào các phương án và tính chất hóa học của NaOH để tìm ra đáp án đúng
Hướng dẫn giải:
Ta dùng NaOH để phân biệt Mg, Al2O3, Al
Hiện tượng: Mg không tham gia phản ứng
Al2O3 tan trong NaOH nhưng không có khí thoát ra
Al tan trong NaOH và có khí thoát ra
Al2O3 + NaOH→ NaAlO2 + H2O
Al + H2O + NaOH →NaAlO2 + 3/2H2
Đáp án A
Câu 39:
Phương pháp:
Áp dụng định luật bảo toàn nguyên tố và bảo toàn electron để giải bài toán
Hướng dẫn giải:
T
Ta có phương trình :
2 AgNO3 + H2O → 2Ag + 2 HNO3 + ½ O2
Gọi n H+ là a (mol) => n Ag sinh ra là a mol
-> Dung dịch Y gồm NO3- (0,15 mol); H+ (a mol); Ag+ (0,15-a mol)
Cho Fe vào Y thu được hỗn hợp kim loại và khí NO
=> nNO = nH+/4 = a/4 (mol)
Số mol NO3- sau phản ứng là: 0,15 – a/4 (mol)
(bảo toàn nguyên tố N)
Khi cho Fe dư vào dung dịch Y, sau khi phản ứng hoàn toàn trong dung dịch chỉ gồm có Fe (NO3)2
Vậy, nFe2+ tan trong dung dịch = n NO3-/2 = (0,15 – a/4)/2 (mol)
Áp dụng định luật bảo toàn khối lượng ta có:
12,6 – 56 * (0,15 – a/4)/2 + 108 * (0,15 – a) = 14,5
=> a = 0,1 mol
Vậy n e trao đổi = a = 0,1 mol
Áp dụng phương trình Faraday
t = 0,1.96500/(2,68.3600)= 1 giờ
Đáp án A
Câu 40:
Phương pháp:
Hướng dẫn giải:
Ta có nH+ = 4nNO + 2nO => nO = 0,04 => nFe3O4 = 0,01 (mol)
Xét dung dịch Y: Fe2+ (a mol ), Fe3+ (b mol ), NO3- (c mol ), K+ (0,16 mol ), SO42- (0,16 mol )
Áp dụng định luật bảo toàn điện tích ta có:
2a + 3b + 0,16 = c + 0,16.2 (1)
Xét dung dịch Y 29,52 gam
m muối = 56(a + b) + 62c + 0,16.39 + 0,16.96 = 29,52 (2)
Có 0,22 mol NaOH phản ứng với dịch Y
=> nNaOH = 2nFe2+ + 3nFe3+ = 2a +3b = 0,22 (3)
Từ (1), (2), (3) => a = 0,005; b = 0,07; c = 0,06
Cu + 2 Fe3+ → Cu2+ + 2 Fe2+
nCu = b/2 = 0,035 (mol) => mCu = 2,24 gam
Đáp án D
Nguồn: Sưu tầm
Loigiaihay.com
- Giải đề thi học kỳ II môn Hóa 12 sở GD-ĐT Tây Ninh
- Đề thi hết học kì II năm học 2017 - 2018 sở GDDT Nam Định có lời giải
- Giải đề thi học kì 2 hoá lớp 12 năm 2019 - 2020 trường THPT Trần Hưng Đạo
- Giải đề thi hết học kì II Hóa 12 năm học (2019 - 2020) THPT Yên Lạc Vĩnh Phúc có lời giải
- Giải đề thi hết học kì II Hóa 12 năm học 2019 - 2020 trường THPT Nghĩa Dân - Hưng Yên
>> Xem thêm
Các bài khác cùng chuyên mục
- Đề số 10 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 9 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 8 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 7 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 6 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 10 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 9 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 8 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 7 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết
- Đề số 6 - Đề kiểm tra giữa học kì I - Hóa học 12 có đáp án và lời giải chi tiết