Trắc nghiệm Tổng hợp bài tập Kim loại kiềm - kiềm thổ - nhôm hay và khó (phần 2) - Hóa 12
Đề bài
Hỗn hợp X gồm M2CO3, MHCO3 và MCl với M là kim loại kiềm. Nung nóng 15,97 gam hỗn hợp X, sau khi phản ứng xảy ra hoàn toàn, thu được 14,42 gam chất rắn. Mặt khác, cho 15,97 gam hỗn hợp X trên tác dụng hết với 500 ml dung dịch HCl 1M, thu được dung dịch Y và 3,36 lít khí (đktc). Cho Y tác dụng với dung dịch AgNO3 dư, thu được 74,62 gam kết tủa. Kim loại M là
-
A.
Li.
-
B.
K.
-
C.
Cs.
-
D.
Na.
Hòa tan hoàn toàn m gam hỗn hợp X gồm Ba, BaO, Al và Al2O3 vào nước dư, thu được dung dịch Y và 5,6 lít H2 (ở đktc). Nhỏ từ từ đến dư dung dịch HCl 1M vào dung dịch Y. Đồ thị biểu diễn sự phụ thuộc khối lượng kết tủa Al(OH)3 theo thể tích dung dịch HCl 1M như sau:
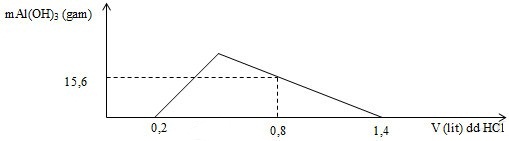
Giá trị của m là
-
A.
99,00.
-
B.
49,55.
-
C.
47,15.
-
D.
56,75
Cho 86,3 gam hỗn hợp X gồm Na, K, Ba và Al2O3 (trong đó oxi chiếm 19,47% về khối lượng) tan hết vào nước, thu được dung dịch Y và 13,44 lít khí H2 (đktc). Cho 3,2 lít dung dịch HCl 0,75M vào dung dịch Y. Sau khi các phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. Giá trị của m là
-
A.
10,4.
-
B.
23,4.
-
C.
54,5.
-
D.
27,3.
Hỗn hợp X gồm Na, Ba, Na2O và BaO. Hòa tan hoàn toàn 21,9 gam X vào nước thu được 1,12 lít khí H2 (đktc) và dung dịch Y trong đó có 5,6 gam dung dịch NaOH. Cho toàn bộ Y tác dụng với 100 ml dung dịch Al2(SO4)3 0,5M thu được m gam kết tủa. Giá trị của m là
-
A.
29,52
-
B.
27,96
-
C.
1,56
-
D.
36,52
Điện phân nóng chảy hỗn hợp Al2O3 và Na3AlF6 (criolit) với anot làm bằng than chì và catot làm bằng thép. Sau một thời gian tại catot sinh ra 8,1 kg Al và tại anot thấy thoát ra V m3 hỗn hợp khí (đo ở 819oC và áp suất 1 atm) gồm CO2 60%, CO 20% và O2 20% (theo thể tích). Giá trị của V tương ứng là
-
A.
≈33,6 m3.
-
B.
≈22,4 m3.
-
C.
≈56,0 m3.
-
D.
≈44,8 m3.
Hỗn hợp X gồm Mg, Al, Al2O3 và MgCO3 (trong đó oxi chiếm 25,157% về khối lượng). Hòa tan hết 19,08 gam X trong dung dịch chứa 1,32 mol NaHSO4 và x mol HNO3, kết thúc phản ứng thu được dung dịch Y chỉ chứa các muối trung hòa có khối lượng 171,36 gam và hỗn hợp khí Z gồm CO2, N2O, H2. Tỉ khối của Z so với He bằng 7,5. Cho dung dịch NaOH dư vào Y, thu được 19,72 gam kết tủa.Trong các nhận định dưới đây có bao nhiêu nhận định đúng :
(1) Trong X có 0,06 mol MgCO3
(2) Giá trị của x là 0,16
(3) Trong Z có 0,06 mol H2
(4) Khối lượng Al trong X là 4,86 g
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Nhỏ từ từ dung dịch Ba(OH)2 vào dung dịch hỗn hợp Al2(SO4)3 và AlCl3 thu được kết tủa có khối lượng theo số mol Ba(OH)2 như đồ thị:
Tổng giá trị (a+b) bằng:
-
A.
287,4.
-
B.
134,1.
-
C.
248,7.
-
D.
238,95.
Khi nhỏ từ từ đến dư dung dịch NaOH vào dung dịch hỗn hợp gồm a mol HCl và b mol AlCl3, kết quả thí nghiệm được biểu thị trên đồ thị sau: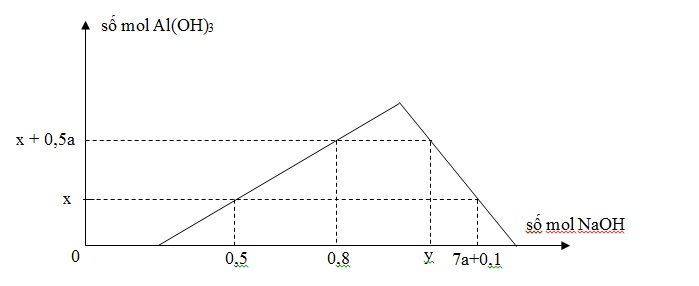
Tỉ lệ y : x là
-
A.
14.
-
B.
16.
-
C.
13.
-
D.
15.
Hòa tan hoàn toàn hỗn hợp X gồm Al2O3 và Na vào nước thu được dung dịch Y và x lít H2 đktc. Cho từ từ dung dịch HCl 1M vào dung dich Y, khối lượng kết tủa Al(OH)3 (m gam) phụ thuộc vào thể tích dung dịch HCl (V ml) được biểu diễn bằng đồ thị dưới đây.
Giá trị của x là
-
A.
1,68
-
B.
5,04
-
C.
3,36
-
D.
10,08
Nhỏ từ từ dung dịch Ba(OH)2 vào ống nghiệm chứa dung dịch gồm HCl và Al2(SO4)3. Đồ thị biểu diễn sự phụ thuộc của khối lượng kết tủa theo thể tích dung dịch Ba(OH)2 như sau:
Giá trị của ( mmax – mmin) là
-
A.
20,15.
-
B.
14,04.
-
C.
16,05.
-
D.
18,58.
Cho 10,8 gam bột Al và m gam hỗn hợp X gồm CuO và Fe3O4 vào bình chân không rồi nung nóng, thu được hỗn hợp rắn Y. Chia Y thành hai phần bằng nhau. Phần một cho tác dụng với dung dịch NaOH dư thấy thoát ra 0,06 mol khí H2, đồng thời thu được 18,08 gam hỗn hợp chất rắn không tan. Phần hai cho tác dụng hết với dung dịch HNO3 dư, thu được dung dịch Z chứa 106,16 gam muối và thoát ra 0,18 mol khí NO duy nhất. Khối lượng Fe3O4 có trong m gam X là
-
A.
27,84 gam.
-
B.
21,92 gam.
-
C.
19,21 gam.
-
D.
24,32 gam.
Lời giải và đáp án
Hỗn hợp X gồm M2CO3, MHCO3 và MCl với M là kim loại kiềm. Nung nóng 15,97 gam hỗn hợp X, sau khi phản ứng xảy ra hoàn toàn, thu được 14,42 gam chất rắn. Mặt khác, cho 15,97 gam hỗn hợp X trên tác dụng hết với 500 ml dung dịch HCl 1M, thu được dung dịch Y và 3,36 lít khí (đktc). Cho Y tác dụng với dung dịch AgNO3 dư, thu được 74,62 gam kết tủa. Kim loại M là
-
A.
Li.
-
B.
K.
-
C.
Cs.
-
D.
Na.
Đáp án : D
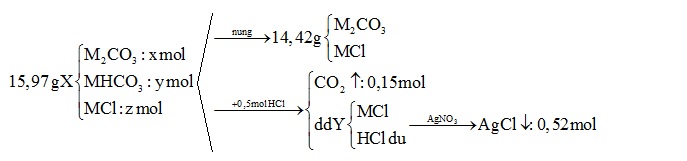 BTNT Cl => nMCl = nAgCl – nHCl = ? (mol)
BTNT Cl => nMCl = nAgCl – nHCl = ? (mol)
Khi nung chỉ có MHCO3 bị nhiệt phân theo phương trình:
2MHCO3 \(\xrightarrow{{{t}^{0}}}\) M2CO3 + CO2 ↑+ H2O
y →0,5y →0,5y (mol)
=> Khối lượng rắn giảm chính là khối lượng H2O và CO2
=> y = ? (mol)
BTNT C ta có: => nM2CO3 = nCO2 - nMHCO3 = ?
BTKL mX => Kloại M =?
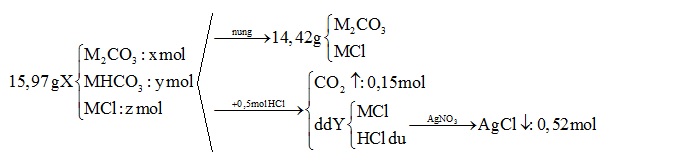
BTNT Cl => nMCl = nAgCl – nHCl = 0,52 – 0,5 = 0,02 (mol)
Khi nung chỉ có MHCO3 bị nhiệt phân theo phương trình:
2MHCO3 \(\xrightarrow{{{t}^{0}}}\)M2CO3 + CO2 ↑+ H2O
y →0,5y →0,5y (mol)
=> Khối lượng rắn giảm chính là khối lượng H2O và CO2
=> 0,5y.44 + 0,5y.18 = (15,97- 14,42)
=> y = 0,05 (mol)
BTNT C ta có: nM2CO3 + nMHCO3 = nCO2
=> nM2CO3 = nCO2 - nMHCO3 = 0,15 – 0,05 = 0,1 (mol)
mX = 0,1(2M + 60) + 0,05 (M + 61) + 0,02 (M + 35,5) = 15,97
=> 0,27M = 6,21
=> M = 23 (Na)
Hòa tan hoàn toàn m gam hỗn hợp X gồm Ba, BaO, Al và Al2O3 vào nước dư, thu được dung dịch Y và 5,6 lít H2 (ở đktc). Nhỏ từ từ đến dư dung dịch HCl 1M vào dung dịch Y. Đồ thị biểu diễn sự phụ thuộc khối lượng kết tủa Al(OH)3 theo thể tích dung dịch HCl 1M như sau:

Giá trị của m là
-
A.
99,00.
-
B.
49,55.
-
C.
47,15.
-
D.
56,75
Đáp án : B
Dd Y gồm: OH- dư và AlO2-
Khi nH+ = 0,8 mol: nH+ = nOH- + 4nAlO2- - 3nAl(OH)3 => x
Quy đổi hỗn hợp đầu thành: Ba, Al, O
nOH- pư = nAlO2-=> nOH- bđ => nBa = nBa(OH)2
BT e: 2nBa + 3nAl = 2nO + 2nH2 => nO = 0,45 mol
m = mBa + mAl + m
Dd Y gồm: OH- dư (0,2 mol) và AlO2- (x mol)
Khi nH+ = 0,8 mol: nH+ = nOH- dư + 4nAlO2- - 3nAl(OH)3
=> 0,8 = 0,2 + 4x – 3.0,2 => x = 0,3 mol
Quy dổi hỗn hợp đầu thành: Ba, Al, O
nOH- pư = nAlO2-= 0,3 mol => nOH- bđ = 0,5 mol => nBa = nBa(OH)2 = 0,25 mol
BT e: 2nBa + 3nAl = 2nO + 2nH2 => 0,25.2 + 0,3.3 = 2nO + 0,25.2
=> nO = 0,45 mol
m = mBa + mAl + mO = 0,25.137 + 0,3.27 + 0,45.16 = 49,55 gam
Cho 86,3 gam hỗn hợp X gồm Na, K, Ba và Al2O3 (trong đó oxi chiếm 19,47% về khối lượng) tan hết vào nước, thu được dung dịch Y và 13,44 lít khí H2 (đktc). Cho 3,2 lít dung dịch HCl 0,75M vào dung dịch Y. Sau khi các phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. Giá trị của m là
-
A.
10,4.
-
B.
23,4.
-
C.
54,5.
-
D.
27,3.
Đáp án : B
Tính được mO => nO => nAl2O3 = nO/3
\({{n}_{O{{H}^{-}}}}=2{{n}_{{{H}_{2}}}}\)
Viết PTHH và tính toán theo PTHH

Hỗn hợp X gồm Na, Ba, Na2O và BaO. Hòa tan hoàn toàn 21,9 gam X vào nước thu được 1,12 lít khí H2 (đktc) và dung dịch Y trong đó có 5,6 gam dung dịch NaOH. Cho toàn bộ Y tác dụng với 100 ml dung dịch Al2(SO4)3 0,5M thu được m gam kết tủa. Giá trị của m là
-
A.
29,52
-
B.
27,96
-
C.
1,56
-
D.
36,52
Đáp án : A
Quy đổi X thành Na : x mol, Ba: y mol và O : z mol
→ PT (1) khối lượng hỗn hợp X
Cho X vào nước : Na → Na+1 + 1e
Ba → Ba+2 + 2e
O + 2e → O-2
2H+1 + 2e → H2
+) Bảo toàn e => PT (2)
+) nNaOH = x
SO42- + Ba2+ → BaSO4
Al3+ + 3OH- → Al(OH)3
Al(OH)3 + OH- → AlO2- + H2
Quy đổi X thành Na : x mol, Ba: y mol và O : z mol
→ 23x + 137y + 16z = 21,9
Cho X vào nước : Na → Na+1 + 1e
Ba → Ba+2 + 2e
O + 2e → O-2
2H+1 + 2e → H2
Bảo toàn e có x + 2y -2z = 0,05.2
nNaOH = x = 0,14 nên y = 0,12 mol và z = 0,14 mol → dd Y có 0,14 mol NaOH và 0,12 mol Ba(OH)2
nAl2(SO4)3 = 0,05 mol
Vì: ${{n}_{SO_{4}^{2-}}}>{{n}_{B{{a}^{2+}}}}=>{{n}_{BaS{{O}_{4}}}}={{n}_{B{{a}^{+}}}}=0,12\,mol$
Al3+ + 3OH- → Al(OH)3
Ban đầu 0,1 0,38
Sau phản ứng: 0 0,08 0,1 mol
Al(OH)3 + OH- → AlO2- + 2H2O
Ban đầu 0,1 0,08
Sau phản ứng 0,02
=> kết tủa có 0,12 mol BaSO4 và 0,02 mol Al(OH)3
=> m = 0,12.233 + 0,02.78 = 29,52 (gam)
Điện phân nóng chảy hỗn hợp Al2O3 và Na3AlF6 (criolit) với anot làm bằng than chì và catot làm bằng thép. Sau một thời gian tại catot sinh ra 8,1 kg Al và tại anot thấy thoát ra V m3 hỗn hợp khí (đo ở 819oC và áp suất 1 atm) gồm CO2 60%, CO 20% và O2 20% (theo thể tích). Giá trị của V tương ứng là
-
A.
≈33,6 m3.
-
B.
≈22,4 m3.
-
C.
≈56,0 m3.
-
D.
≈44,8 m3.
Đáp án : B
Catot: Thu được Al
Anot: Thu được CO, CO2 (vì O2 tác dụng với điện cực làm bằng than chì)
Viết phương trình điện phân, từ mol Al => nO2
Viết PTHH của điện cực (làm bằng C) với O2, tính toán theo PTHH
nAl = 0,3 (kmol)

=> nkhí = x (kmol) $ \to \left\{ \begin{array}{l}{n_{C{O_2}}} = 0,6{\rm{x}}\\{n_{CO}} = 0,2{\rm{x}}\\{n_{{O_2}du}} = 0,2{\rm{x}}\end{array} \right.$
C + O2 $\xrightarrow{{{t}^{o}}}$ CO2
0,6x ← 0,6x
2C + O2 $\xrightarrow{{{t}^{o}}}$ 2CO
0,1x ← 0,2x
=> nO2 dư = nO2 sinh ra ở anot – nO2 pứ
=> 0,225 – (0,6x + 0,1x) = 0,2x => x = 0,25 (kmol)
=> $V=\frac{n.R.T}{p}=\frac{0,25.0,082.(819+273)}{1}=22,4\,{{m}^{3}}$
Hỗn hợp X gồm Mg, Al, Al2O3 và MgCO3 (trong đó oxi chiếm 25,157% về khối lượng). Hòa tan hết 19,08 gam X trong dung dịch chứa 1,32 mol NaHSO4 và x mol HNO3, kết thúc phản ứng thu được dung dịch Y chỉ chứa các muối trung hòa có khối lượng 171,36 gam và hỗn hợp khí Z gồm CO2, N2O, H2. Tỉ khối của Z so với He bằng 7,5. Cho dung dịch NaOH dư vào Y, thu được 19,72 gam kết tủa.Trong các nhận định dưới đây có bao nhiêu nhận định đúng :
(1) Trong X có 0,06 mol MgCO3
(2) Giá trị của x là 0,16
(3) Trong Z có 0,06 mol H2
(4) Khối lượng Al trong X là 4,86 g
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Đáp án : C
+) Tính nO (trong X) dựa vào phần trăm khối lượng
+) Dung dịch Y tác dụng với NaOH dư ta được : \({{n}_{M{{g}^{2+}}}}={{n}_{Mg{{\left( OH \right)}_{2}}}}\)
- Xét dung dịch Y, bảo toàn điện tích và khối lượng => số mol Al3+ và NH4+
- Quy đổi hỗn hợp rắn X thành Mg, Al, O và C → bảo toàn C → MgCO3
+) \({{n}_{Mg}}={{n}_{M{{g}^{2+}}}}-{{n}_{MgC{{O}_{3}}}}\)
+) Bảo toàn O → Al2O3
- Xét hỗn hợp khí Z ta có : nN2O = a và nH2 = b và nCO2 = 0,06 mol
+) Từ MZ = 30 => PT (1)
Bảo toàn e cho phản ứng với HNO3 có \(8{{n}_{{{N}_{2}}O}}~+2{{n}_{{{H}_{2}}}}+8{{n}_{NH_{4}^{+}}}~=3{{n}_{Al}}+2{{n}_{Mg}}\) => Pt (2)
→ a và b
+) Bảo toàn N : $2.{{n}_{{{N}_{2}}O}}+{{n}_{NH_{4}^{+}}}={{n}_{HN{{O}_{3}}}}$
=> x
- Theo đề bài ta có : ${{n}_{O\,(trong\,X)}}=\frac{0,25157.19,08}{16}=0,3\,mol$
- Khi cho dung dịch tác dụng với NaOH dư ta được: \({{n}_{M{{g}^{2+}}}}={{n}_{Mg{{\left( OH \right)}_{2}}}}=0,34\text{ }mol\)
- Xét dung dịch Y có
$\left\{ {\begin{array}{*{20}{l}}{3.{n_{A{l^{3 + }}}} + {n_{NH_4^ + }} = 2.{n_{SO_4^{2 - }}} - {n_{N{a^ + }}} - 2.{n_{M{g^{2 + }}}} = 0,64}\\{27.{n_{A{l^{3 + }}}} + 18.{n_{NH_4^ + }} = {m_Y} - 96.{n_{SO_4^{2 - }}} - 23.{n_{N{a^ + }}} - 24.{n_{M{g^{2 + }}}} = 6,12}\end{array}} \right. \to \left\{ {\begin{array}{*{20}{l}}{{n_{A{l^{3 + }}}} = 0,2{\mkern 1mu} mol}\\{{n_{NH_4^ + }} = 0,04{\mkern 1mu} mol}\end{array}} \right.$- Quy đổi hỗn hợp rắn X thành Mg, Al, O và C → bảo toàn C
${{n}_{MgC{{O}_{3}}}}={{n}_{C}}=\frac{{{m}_{X}}-24.{{n}_{Mg}}-27.{{n}_{Al}}-16.{{n}_{O}}}{12}=0,06\,mol$
- Quay lại hỗn hợp rắn X với Al, Al2O3, Mg và MgCO3 có :
${{n}_{Mg}}={{n}_{M{{g}^{2+}}}}-{{n}_{MgC{{O}_{3}}}}=0,28\,mol$
Bảo toàn O :
${{n}_{A{{l}_{2}}{{O}_{3}}}}=\frac{{{n}_{O(trong\,X)}}-3.{{n}_{MgC{{O}_{3}}}}}{3}=0,04\,mol=>{{n}_{Al}}={{n}_{A{{l}^{3+}}}}-2.{{n}_{A{{l}_{2}}{{O}_{3}}}}=0,12\,mol$
- Xét hỗn hợp khí Z ta có : nN2O = a và nH2 = b và nCO2 = 0,06 mol
\(\to {{M}_{Z}}~=30=\frac{44a+2b+0,06.44}{a+b+0,06}\) (1)
Bảo toàn e cho phản ứng với HNO3 có : \(8{{n}_{{{N}_{2}}O}}~+2{{n}_{{{H}_{2}}}}+8{{n}_{NH_{4}^{+}}}=3{{n}_{Al}}+2{{n}_{Mg}}\)
=> 8a + 2b + 8.0,04 = 3.0,12 + 2.0,28 (2)
→ a = 0,06 và b = 0,06 mol
Bảo toàn N: $2.{{n}_{{{N}_{2}}O}}+{{n}_{NH_{4}^{+}}}={{n}_{HN{{O}_{3}}}}$ => 2.0,06 + 0,04 = x
=> x = 0,16
(1) đúng vì MgCO3 :0,06 mol
(2) đúng
(3) đúng
(4) sai vì mAl = 0,12.27 = 3,24
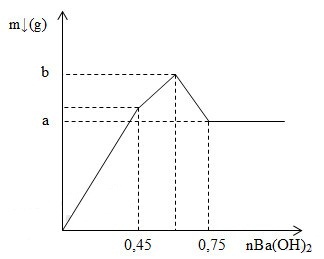
Nhỏ từ từ dung dịch Ba(OH)2 vào dung dịch hỗn hợp Al2(SO4)3 và AlCl3 thu được kết tủa có khối lượng theo số mol Ba(OH)2 như đồ thị:

Tổng giá trị (a+b) bằng:
-
A.
287,4.
-
B.
134,1.
-
C.
248,7.
-
D.
238,95.
Đáp án : D
GĐ 1: Kết tủa tăng mạnh nhất do vừa tạo thành BaSO4 và Al(OH)3
GĐ 2: Kết tủa BaSO4 đạt cực đại nên lượng kết tủa tăng chậm đi
GĐ 3: Al(OH)3 bắt đầu bị hòa tan nên lượng kết tủa giảm
GĐ 1: Kết tủa tăng mạnh nhất do vừa tạo thành BaSO4 và Al(OH)3
GĐ 2: Kết tủa BaSO4 đạt cực đại nên lượng kết tủa tăng chậm đi
GĐ 3: Al(OH)3 bắt đầu bị hòa tan nên lượng kết tủa giảm
nAl2(SO4)3 = x
nAlCl3 = y
+ Tại nBa(OH)2 = 0,45 mol thì BaSO4 đạt cực đại
nSO42- = nBa(OH)2 => 3x = 0,45 => x = 0,15
+ Tại nBa(OH)2 = 0,75 mol thì Al(OH)3 vừa bị hòa tan hết
nOH- = 4nAl3+ => 0,75.2 = 4.(2.0,15 + y) => y = 0,075 mol
a = mBaSO4 max = 0,45.233 = 104,85 gam
b = mBaSO4 max + mAl(OH)3 max = 104,85 + 78(2.0,15 + 0,075) = 134,1 gam
=> a + b = 104,85 + 134,1 = 238,95 gam
Khi nhỏ từ từ đến dư dung dịch NaOH vào dung dịch hỗn hợp gồm a mol HCl và b mol AlCl3, kết quả thí nghiệm được biểu thị trên đồ thị sau:
Tỉ lệ y : x là
-
A.
14.
-
B.
16.
-
C.
13.
-
D.
15.
Đáp án : A
Khi cho dd OH- vào hỗn hợp gồm H+ và muối Al3+
Sẽ xảy ra các phản ứng hóa học theo thứ tự sau:
OH- + H+ → H2O (1)
OH- + Al3+ → Al(OH)3↓ (2)
OH- + Al(OH)3↓ → AlO2- + 2H2O (3)
Khi phản ứng (1) kết thúc , bắt đầu xảy ra (2) thì xuất hiện kết tủa => đồ thị bắt đầu đi lên
Khi đồ thị đi lên từ từ đến điểm cực đại => xảy ra phản ứng (1) và (2)
Ta có công thức nhanh: nOH- = 3n↓ + nH+
Khi đồ thị bắt đầu đi xuống => phản ứng (3) xảy ra, kết tủa bắt đầu bị hòa tan dần dần đến hết
=> Ta có công thức tính nhanh: nOH- = 4nAl3+ - n↓ + nH+
Khi cho dd OH- vào hỗn hợp gồm H+ và muối Al3+
Sẽ xảy ra các phản ứng hóa học theo thứ tự sau:
OH- + H+ → H2O (1)
OH- + 3Al3+ → Al(OH)3↓ (2)
OH- + Al(OH)3↓ → AlO2- + 2H2O (3)
Khi phản ứng (1) kết thúc , bắt đầu xảy ra (2) thì xuất hiện kết tủa => đồ thị bắt đầu đi lên
Khi đồ thị đi lên từ từ đến điểm cực đại => xảy ra phản ứng (1) và (2)
Ta có công thức nhanh: nOH- = 3n↓ + nH+
Khi đồ thị bắt đầu đi xuống => phản ứng (3) xảy ra, kết tủa bắt đầu bị hòa tan dần dần đến hết
=> Ta có công thức tính nhanh: nOH- = 4nAl3+ - n↓ + nH+
Từ đây ta có các phương trình sau:
\(\begin{array}{l}\left\{ \begin{array}{l}0,5 = 3x + a\\0,8{\rm{ }} = {\rm{ }}3\left( {x{\rm{ }} + {\rm{ }}0,5a} \right){\rm{ }} + {\rm{ }}a\\y{\rm{ }} = {\rm{ }}4b{\rm{ }} - {\rm{ }}\left( {x{\rm{ }} + {\rm{ }}0,5a} \right){\rm{ }} + {\rm{ }}a\\7a{\rm{ }} + {\rm{ }}0,1{\rm{ }} = {\rm{ }}4b{\rm{ }} - {\rm{ }}x{\rm{ }} + {\rm{ }}a\end{array} \right. \Rightarrow \left\{ \begin{array}{l}a{\rm{ }} + {\rm{ }}3x{\rm{ }} = {\rm{ }}0,5\\2,5a{\rm{ }} + {\rm{ }}3x{\rm{ }} = {\rm{ }}0,8\\0,5a{\rm{ }} + {\rm{ }}4b{\rm{ }} - {\rm{ }}x{\rm{ }} = {\rm{ }}y\\6a{\rm{ }} - {\rm{ }}4b{\rm{ }} + {\rm{ }}x{\rm{ }} = {\rm{ }} - {\rm{ }}0,1\end{array} \right. \Rightarrow \left\{ \begin{array}{l}a{\rm{ }} = {\rm{ }}0,2\\x{\rm{ }} = {\rm{ }}0,1\\b{\rm{ }} = {\rm{ }}0,35\\y{\rm{ }} = {\rm{ }}1,4\end{array} \right.\\\Rightarrow \frac{y}{x} = \frac{{1,4}}{{0,1}} = 14\end{array}\)
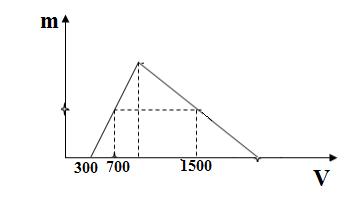
Hòa tan hoàn toàn hỗn hợp X gồm Al2O3 và Na vào nước thu được dung dịch Y và x lít H2 đktc. Cho từ từ dung dịch HCl 1M vào dung dich Y, khối lượng kết tủa Al(OH)3 (m gam) phụ thuộc vào thể tích dung dịch HCl (V ml) được biểu diễn bằng đồ thị dưới đây.

Giá trị của x là
-
A.
1,68
-
B.
5,04
-
C.
3,36
-
D.
10,08
Đáp án : D
2Na + 2H2O → 2NaOH + H2
2NaOH + Al2O3 → 2 NaAlO2 + H2O
Y dư NaOH
Thì HCl + NaOH → NaCl + H2O
HCl + NaAlO2 +H2O → NaCl + Al(OH)3
3HCl + Al(OH)3 → AlCl3 + 3H2O
Y có nNaOH = 0,3 mol và nNaAlO2 = a mol
Khi thêm 700 ml dung dịch HCl vào thì n↓ = 0,7 - 0,3 = 0,4 mol
Khi thêm 1500 ml dung dịch HCl vào thì n↓= a – (1,5 – 0,3 –a ): 3
→ a – (1,5 – a – 0,3) : 3 = 0,4 (mol) → a = 0,6 mol
2Na + 2H2O → 2NaOH + H2
2NaOH + Al2O3 → 2 NaAlO2 + H2O
Y dư NaOH
Thì HCl + NaOH → NaCl + H2O
HCl + NaAlO2 +H2O → NaCl + Al(OH)3
3HCl + Al(OH)3 → AlCl3 + 3H2O
Y có nNaOH = 0,3 mol và nNaAlO2 = a mol
Khi thêm 700 ml dung dịch HCl vào thì n↓ = 0,7 - 0,3 = 0,4 mol
Khi thêm 1500 ml dung dịch HCl vào thì n↓= a – (1,5 – 0,3 –a ): 3
→ a – (1,5 – a – 0,3) : 3 = 0,4 (mol) → a = 0,6 mol
→ bảo toàn Na có nNa = a + 0,3 = 0,9 mol → nH2 = 0,45 mol → x =0,45 . 22,4 = 10,08
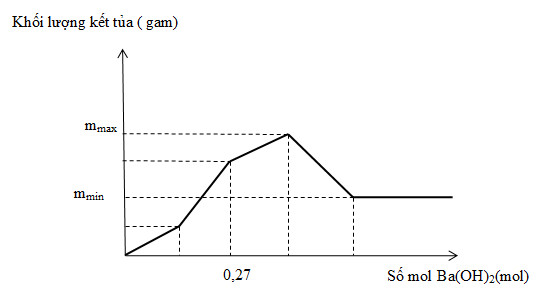
Nhỏ từ từ dung dịch Ba(OH)2 vào ống nghiệm chứa dung dịch gồm HCl và Al2(SO4)3. Đồ thị biểu diễn sự phụ thuộc của khối lượng kết tủa theo thể tích dung dịch Ba(OH)2 như sau:

Giá trị của ( mmax – mmin) là
-
A.
20,15.
-
B.
14,04.
-
C.
16,05.
-
D.
18,58.
Đáp án : B
Gọi số mol của HCl là a (mol) và số mol của Al2(SO4)3 là b (mol)
=> \({{n}_{{{H}^{+}}}}=a\text{ (mol)};\text{ }{{n}_{A{{l}^{3+}}}}=2b\,(mol);\text{ }{{n}_{SO_{4}^{2-}}}=3b\text{ (mol)}\)
Tại giá trị nBa(OH)2 = 0,27 (mol) => nBaSO4 max = 2b => b = ? (mol)
Kết tủa max bao gồm: \({{m}_{max}}~={{m}_{BaSO}}_{_{4}max}~+\text{ }{{m}_{Al{{\left( OH \right)}_{3}}}}_{max}\)
Kết tủa không thay đổi (đường đồ thị nằm ngang) chính là khi chỉ có kết tủa BaSO4, còn kết tủa Al(OH)3 bị hòa tan hoàn toàn.
=> mmax – mmin = mAl(OH)3max
Gọi số mol của HCl là a (mol) và số mol của Al2(SO4)3 là b (mol)
=> \({{n}_{{{H}^{+}}}}=a\text{ (mol)};\text{ }{{n}_{A{{l}^{3+}}}}=2b\,(mol);\text{ }{{n}_{SO_{4}^{2-}}}=3b\text{ (mol)}\)
Khi cho Ba(OH)2 từ từ vào dung dịch hỗn hợp, trong khi Ba2+ tạo kết tủa ngay khi xuất phát thì OH- lại phải trung hòa H+ trước rồi mới tạo kết tủa sau. Do đó Ba2+ sẽ đến đích trước OH-
=> BaSO4 đạt max khi kết thúc giai đoạn thứ 2 và nBaSO4 max = 3b (mol). Lúc này Al(OH)3 mới tạo được một lượng là:
\({{n}_{Al{{(OH)}_{3}}}}=\frac{1}{3}{{n}_{O{{H}^{-}}}}=\frac{6b-a}{3}(mol)\)
=> nBa(OH)2 = 3b = 0,27
=> b = 0,09 (mol)
Kết tủa max bao gồm : \({{m}_{max}}~={{m}_{BaSO}}_{_{4}max}~+\text{ }{{m}_{Al{{\left( OH \right)}_{3}}}}_{max}\)
Kết tủa không thay đổi (đường đồ thị nằm ngang) chính là khi chỉ có kết tủa BaSO4, còn kết tủa Al(OH)3 bị hòa tan hoàn toàn.
=> mmax – mmin = mAl(OH)3 max = 2b.78 = 2.0,09.78 = 14,04 (gam)
Cho 10,8 gam bột Al và m gam hỗn hợp X gồm CuO và Fe3O4 vào bình chân không rồi nung nóng, thu được hỗn hợp rắn Y. Chia Y thành hai phần bằng nhau. Phần một cho tác dụng với dung dịch NaOH dư thấy thoát ra 0,06 mol khí H2, đồng thời thu được 18,08 gam hỗn hợp chất rắn không tan. Phần hai cho tác dụng hết với dung dịch HNO3 dư, thu được dung dịch Z chứa 106,16 gam muối và thoát ra 0,18 mol khí NO duy nhất. Khối lượng Fe3O4 có trong m gam X là
-
A.
27,84 gam.
-
B.
21,92 gam.
-
C.
19,21 gam.
-
D.
24,32 gam.
Đáp án : A
Tóm tắt sơ đồ bài toán:
Coi trong mỗi phần có 0,2 mol Al
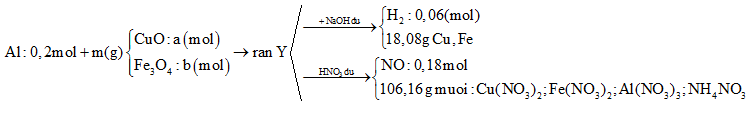
Dùng bảo toàn e, bảo toàn nguyên tố, bảo toàn khối lượng
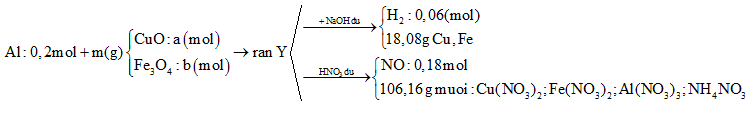
Coi trong mỗi phần có 0,2 mol Al
- Rắn Y + NaOH → 0,06 mol H2
BT: e => nAl dư \(=\frac{2}{3}.{{n}_{{{H}_{2}}}}=\frac{2}{3}.0,06=0,04\text{ (mol)}\)
BTNT: Al => nAl2O3 = ½.( nAl bđ – nAl dư) = ½.(0,2 – 0,04) = 0,08 (mol)
BTKL: m = mFe, Cu + mO = 18,08 + 0,08.3.16 = 21,92 (g)
=> 80a + 232b = 21,92 (1)
- Rắn Y + HNO3
Sau tất cả quá trình ta có: Al → Al+3 ; Fe+8/3 → Fe+3, N+5 → N+2; N+5→ N-3
BT e ta có: \(3{{n}_{Al}}~+{{n}_{F{{e}_{3}}{{O}_{4}}}}~=3{{n}_{NO}}+8{{n}_{N{{H}_{4}}N{{O}_{3}}}}\)
\(=>{{n}_{N{{H}_{4}}N{{O}_{3}}}}=\frac{0,2.3+b-0,18.3}{8}=\frac{b+0,06}{8}\)
mmuối \(={{m}_{Al{{\left( N{{O}_{3}} \right)}_{3}}}}+{{m}_{Cu{{\left( N{{O}_{3}} \right)}_{2}}}}+{{m}_{Fe{{\left( N{{O}_{3}} \right)}_{3}}}}~+{{m}_{N{{H}_{4}}N{{O}_{3}}}}\)
=> \(213.0,2+188a+242.3b+80.\frac{b+0,06}{8}=106,16\text{ }\left( 2 \right)\)
Từ (1) và (2) => a = 0,1 và b = 0,06
=> mFe3O4 = 232.2b = 232.2.0,1= 27,84 (g) (Vì hỗn hợp ban đầu nên phải nhân đôi số liệu)
Luyện tập và củng cố kiến thức Ôn tập chương 6 Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập Kim loại kiềm - kiềm thổ - nhôm hay và khó (phần 1) Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập phản ứng nhiệt nhôm không hoàn toàn Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập phản ứng nhiệt nhôm hoàn toàn Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập muối aluminat tác dụng với axit Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập nhôm và hợp chất của nhôm tác dụng với dung dịch kiềm Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 27. Hợp chất của nhôm Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 27. Nhôm và hợp chất Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập axit tác dụng với muối cacbonat Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập CO2 tác dụng với dung dịch kiềm Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 26. Nước cứng Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập kim loại kiềm và kiềm thổ tác dụng với nước Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 26. Kim loại kiềm thổ và hợp chất Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 25. Kim loại kiềm và hợp chất Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết










Danh sách bình luận