Đề thi giữa kì 2 Hóa 10 - Chân trời sáng tạo - Đề số 2
Phát biểu nào dưới đây không đúng?
Đề bài
Phát biểu nào dưới đây không đúng?
-
A.
Phản ứng oxi hóa – khử là phản ứng trong đó có sự thay đổi số oxi hóa của một nguyên tố
-
B.
Phản ứng oxi hóa – khử là phản ứng trong đó xảy ra sự trao đổi electron giữa các chất
-
C.
Phản ứng oxi hóa – khử là phản ứng trong đó có sự thay đổi số oxi hóa của tất cả các nguyên tố
-
D.
Phản ứng oxi hóa – khử là phản ứng luôn xảy ra đồng thời sự oxi hóa và sự khử
Ở điều kiện chuẩn, công thức tính biến thiên enthalpy của phản ứng theo nhiệt tạo thành là:
-
A.
\({\Delta _f}H_{298}^0 = \sum {{\Delta _r}H_{298}^0(sp) - \sum {{\Delta _r}H_{298}^0} } (c{\rm{d}})\)
-
B.
\({\Delta _f}H_{298}^0 = \sum {{\Delta _r}H_{298}^0(cd) - \sum {{\Delta _r}H_{298}^0} } (sp)\)
-
C.
\({\Delta _r}H_{298}^0 = \sum {{\Delta _f}H_{298}^0(cd) - \sum {{\Delta _f}H_{298}^0} } (sp)\)
-
D.
\({\Delta _r}H_{298}^0 = \sum {{\Delta _f}H_{298}^0(sp) - \sum {{\Delta _f}H_{298}^0} } (c{\rm{d}})\)
Cho quá trình Fe2+ \( \to \)Fe3+ + 1e, đây là quá trình
-
A.
Tự oxi hóa – khử
-
B.
khử
-
C.
nhận proton
-
D.
oxi hóa
Sự khử là
-
A.
sự kết hợp với oxygen
-
B.
sự khử bỏ oxygen
-
C.
sự nhận electron
-
D.
sự nhường electron
Cho phương trình nhiệt hóa học: N2 (g) + O2 (g) \( \to \)2NO (g) \({\Delta _r}H_{298}^0\)=179,20 kJ.
Phản ứng trên là phản ứng:
-
A.
có sự giải phóng nhiệt lượng ra môi trường
-
B.
không có sự thay đổi năng lượng
-
C.
thu nhiệt và hấp thu 179,20 kJ nhiệt
-
D.
tỏa nhiệt và giải phóng 179,20 kJ nhiệt
Trong phản ứng dưới đây: \(Mn{O_2} + 4HCl \to MnC{l_2} + C{l_2} + 2{H_2}O\). Nếu dùng 17,4g MnO2 thì điều chế được bao nhiêu lít khí chlorine?
-
A.
24,79
-
B.
2,479
-
C.
4,958
-
D.
49,58
Biến thiên enthalpy của một phản ứng được ghi ở sơ đồ dưới đây. Kết luận nào sau đây là đúng
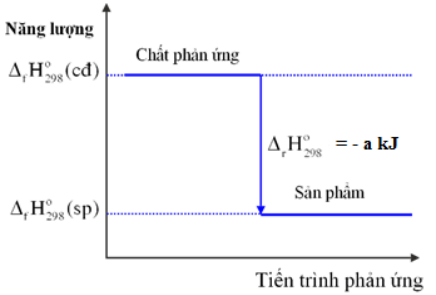
-
A.
Năng lượng chất tham gia phản ứng nhỏ hơn năng lượng sản phẩm
-
B.
Phản ứng tỏa nhiệt
-
C.
Phản ứng thu nhiệt
-
D.
Biến thiên enthalpy của phản ứng là a kJ/mol
Trong phản ứng: 2FeCl3 + H2S \( \to \)2FeCl2 + S + 2HCl. Vai trò của H2S là:
-
A.
chất oxi hóa
-
B.
Acid
-
C.
vừa là acid vừa là chất khử
-
D.
chất khử
Dung dịch glucose (C6H12O6) 5% có khối lượng riêng là 1,02 g/ml, phản ứng oxi hóa 1 mol glucose tạo thành CO2 (g) và H2O (l) tỏa ra nhiệt lượng là 2803,0 kJ. Một người bệnh được truyền một chai chứa 500ml dung dịch glucose 5%. Năng lượng tối đa từ phản ứng oxi hóa hoàn toàn glucose mà bệnh nhân đó có thể nhận được là
-
A.
397,09 kJ
-
B.
381,67 kJ
-
C.
389,30 kJ
-
D.
416,02 kJ
Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn:
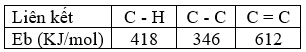
Biến thiên enthalpy của phản ứng: C3H8 (g) \( \to \)CH4(g) + C2H4(g) có giá trị là
-
A.
103 kJ
-
B.
-103 kJ
-
C.
80 kJ
-
D.
– 80 kJ
Dựa vào phương trình nhiệt hóa học của phản ứng sau:
CO2(g) \( \to \)CO(g) + ½ O2(g) \({\Delta _r}H_{298}^0\)=280kJ
Giá trị \({\Delta _r}H_{298}^0\)của phản ứng: 2CO2(g) \( \to \)2CO(g) + O2(g) là:
-
A.
140 kJ
-
B.
-1120 kJ
-
C.
560 kJ
-
D.
-420 kJ
Cho biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn:
4FeS2(s) + 11O2 \( \to \)2Fe2O3(s) + 8SO2(g)
Biết nhiệt tạo thành \({\Delta _f}H_{298}^0\)của FeS2(s), Fe2O3(s), và SO2(g) lần lượt là -177,9 kJ/mol, -825,5 kJ/mol và -296,8 kJ/mol. Phát biểu nào sau đây sai?
-
A.
\({\Delta _f}H_{298}^0\)(O2(g))= 0 kJ
-
B.
\(\sum {{\Delta _f}H_{298}^0} \)(sp) = -4025,4 kJ
-
C.
\(\sum {{\Delta _f}H_{298}^0} \)(cđ) = -771,6 kJ
-
D.
Đây là phản ứng thu nhiệt
Cho nhiệt tạo thành chuẩn của các chất trong phương trình:
Biến thiên enthalpy của phản ứng sau: N2O4(g) +3CO(g) \( \to \)N2O(g) + 3CO2(g)
-
A.
-776,11 kJ
-
B.
10,89 kJ
-
C.
20,1 kJ
-
D.
-20,1 kJ
Phương trình nhiệt hóa học cho biết thông tin nào về phản ứng hóa học:
-
A.
Nhiệt phản ứng
-
B.
Trạng thái của chất đầu
-
C.
Trạng thái của chất sản phẩm
-
D.
Cả A, B, C đúng
: Trong các phát biểu sau đây có bao nhiêu phát biểu đúng?
(1) Tất cả các phản ứng cháy đều tỏa nhiệt
(2) Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt
(3) Tất cả các phản ứng mà chất tham gia có chứa nguyên tố oxygen đều tỏa nhiệt
(4) Phản ứng thu nhiệt là phản ứng hấp thu năng lượng dưới dạng nhiệt
(5) Lượng nhiệt mà phản ứng hấp thụ hay giải phóng không phụ thuộc vào điều kiện thực hiện phản ứng và thể
(6) Sự cháy của nhiên liệu (xăng, dầu, khí gas, than, gỗ,…) là những ví dụ về phản ứng thu nhiệt vì cần phải khơi mào
-
A.
2
-
B.
4
-
C.
3
-
D.
5
: Xác định biến thiên enthalpy \({\Delta _r}H_{298}^0\)của mỗi phản ứng sau:
a, Phản ứng nhiệt phân đá vôi:
|
Chất |
CaCO3(s) |
CaO(s) |
CO2(g) |
|
\({\Delta _f}H_{298}^0\) |
-1206,9 |
-635,1 |
-393,5 |
b, Phản ứng đốt cháy methane: 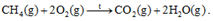
|
Liên kết |
C - H |
O = O |
C=O |
O-H |
|
Eb(kJ/mol) |
418 |
494 |
732 |
459 |
Lời giải và đáp án
Phát biểu nào dưới đây không đúng?
-
A.
Phản ứng oxi hóa – khử là phản ứng trong đó có sự thay đổi số oxi hóa của một nguyên tố
-
B.
Phản ứng oxi hóa – khử là phản ứng trong đó xảy ra sự trao đổi electron giữa các chất
-
C.
Phản ứng oxi hóa – khử là phản ứng trong đó có sự thay đổi số oxi hóa của tất cả các nguyên tố
-
D.
Phản ứng oxi hóa – khử là phản ứng luôn xảy ra đồng thời sự oxi hóa và sự khử
Đáp án : C
Dựa vào khái niệm về phản ứng oxi hóa khử
Phản ứng oxi hóa khử là phản ứng trong đó có sự thay đổi số oxi hóa của một hoặc một số nguyên tố
Đáp án C
Ở điều kiện chuẩn, công thức tính biến thiên enthalpy của phản ứng theo nhiệt tạo thành là:
-
A.
\({\Delta _f}H_{298}^0 = \sum {{\Delta _r}H_{298}^0(sp) - \sum {{\Delta _r}H_{298}^0} } (c{\rm{d}})\)
-
B.
\({\Delta _f}H_{298}^0 = \sum {{\Delta _r}H_{298}^0(cd) - \sum {{\Delta _r}H_{298}^0} } (sp)\)
-
C.
\({\Delta _r}H_{298}^0 = \sum {{\Delta _f}H_{298}^0(cd) - \sum {{\Delta _f}H_{298}^0} } (sp)\)
-
D.
\({\Delta _r}H_{298}^0 = \sum {{\Delta _f}H_{298}^0(sp) - \sum {{\Delta _f}H_{298}^0} } (c{\rm{d}})\)
Đáp án : C
Dựa vào công thức tính biến thiên năng lượng của phản ứng
\({\Delta _r}H_{298}^0 = \sum {{\Delta _f}H_{298}^0(sp) - \sum {{\Delta _f}H_{298}^0} } (c{\rm{d}})\)
Đáp án C
Cho quá trình Fe2+ \( \to \)Fe3+ + 1e, đây là quá trình
-
A.
Tự oxi hóa – khử
-
B.
khử
-
C.
nhận proton
-
D.
oxi hóa
Đáp án : D
Dựa vào khái niệm về chất khử và chất oxi hóa
Fe2+ \( \to \)Fe3+ + 1e: ion Fe2+ đã nhường 1 electron để trở thành ion Fe3+ => đây là chất khử có quá trình oxi hóa
Đáp án D
Sự khử là
-
A.
sự kết hợp với oxygen
-
B.
sự khử bỏ oxygen
-
C.
sự nhận electron
-
D.
sự nhường electron
Đáp án : C
Dựa vào khái niệm chất khử, chất oxi hóa
Sự khử là quá trình nhận electron
Đáp án C
Cho phương trình nhiệt hóa học: N2 (g) + O2 (g) \( \to \)2NO (g) \({\Delta _r}H_{298}^0\)=179,20 kJ.
Phản ứng trên là phản ứng:
-
A.
có sự giải phóng nhiệt lượng ra môi trường
-
B.
không có sự thay đổi năng lượng
-
C.
thu nhiệt và hấp thu 179,20 kJ nhiệt
-
D.
tỏa nhiệt và giải phóng 179,20 kJ nhiệt
Đáp án : C
Dựa vào dấu của \({\Delta _r}H_{298}^0\)
Phản ứng trên có \({\Delta _r}H_{298}^0\)> 0 => phản ứng thu nhiệt và hấp thu 179,20 kJ nhiệt
Đáp án C
Trong phản ứng dưới đây: \(Mn{O_2} + 4HCl \to MnC{l_2} + C{l_2} + 2{H_2}O\). Nếu dùng 17,4g MnO2 thì điều chế được bao nhiêu lít khí chlorine?
-
A.
24,79
-
B.
2,479
-
C.
4,958
-
D.
49,58
Đáp án : C
Dựa vào số mol của MnO2
n MnO2 = 17,4 : 87 = 0,2 mol
theo phản ứng: n MnO2 = n HCl = 0,2 mol => V Cl2 = 0,2 . 24,79 = 4,958l
Biến thiên enthalpy của một phản ứng được ghi ở sơ đồ dưới đây. Kết luận nào sau đây là đúng

-
A.
Năng lượng chất tham gia phản ứng nhỏ hơn năng lượng sản phẩm
-
B.
Phản ứng tỏa nhiệt
-
C.
Phản ứng thu nhiệt
-
D.
Biến thiên enthalpy của phản ứng là a kJ/mol
Đáp án : B
Dựa vào sơ đồ biến thiên enthalpy của phản ứng
Nhiệt tạo thành của sản phẩm nhỏ hơn nhiệt tạo thành của chất tham gia nên \({\Delta _r}H_{298}^0\)của phản ứng < 0 => phản ứng tỏa nhiệt
Đáp án B
Trong phản ứng: 2FeCl3 + H2S \( \to \)2FeCl2 + S + 2HCl. Vai trò của H2S là:
-
A.
chất oxi hóa
-
B.
Acid
-
C.
vừa là acid vừa là chất khử
-
D.
chất khử
Đáp án : D
Dựa vào sự thay đổi số oxi hóa H2S
\({H_2}\mathop S\limits^{ - 2} \to \mathop S\limits^o + 2{\rm{e}}\)=> nhường electron => chất khử
Đáp án D
Dung dịch glucose (C6H12O6) 5% có khối lượng riêng là 1,02 g/ml, phản ứng oxi hóa 1 mol glucose tạo thành CO2 (g) và H2O (l) tỏa ra nhiệt lượng là 2803,0 kJ. Một người bệnh được truyền một chai chứa 500ml dung dịch glucose 5%. Năng lượng tối đa từ phản ứng oxi hóa hoàn toàn glucose mà bệnh nhân đó có thể nhận được là
-
A.
397,09 kJ
-
B.
381,67 kJ
-
C.
389,30 kJ
-
D.
416,02 kJ
Đáp án : A
Tính số mol glucose trong 500ml dung dịch
m dung dịch glucose = 500.1,02 = 510g => m glucose = 510 . 5% = 25,5g
Năng lượng tối đa từ phản ứng oxi hóa hoàn toàn glucose mà bệnh nhân đó nhận được là:
\(\frac{{25,5.2830}}{{180}} = 397,09kJ\)
Đáp án A
Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn:

Biến thiên enthalpy của phản ứng: C3H8 (g) \( \to \)CH4(g) + C2H4(g) có giá trị là
-
A.
103 kJ
-
B.
-103 kJ
-
C.
80 kJ
-
D.
– 80 kJ
Đáp án : C
Dựa vào năng lượng liên kết của các chất
\({\Delta _r}H_{298}^0\)= E C3H8 – E CH4 – E C2H4 = (2.EC-C + 8.E C-H ) – 4.E C-H – E C=C – 4. E C-H
= 2.346 + 8.418 – 4.418 – 612 – 4.418 = 80 kJ
Đáp án C
Dựa vào phương trình nhiệt hóa học của phản ứng sau:
CO2(g) \( \to \)CO(g) + ½ O2(g) \({\Delta _r}H_{298}^0\)=280kJ
Giá trị \({\Delta _r}H_{298}^0\)của phản ứng: 2CO2(g) \( \to \)2CO(g) + O2(g) là:
-
A.
140 kJ
-
B.
-1120 kJ
-
C.
560 kJ
-
D.
-420 kJ
Đáp án : C
Dựa vào \({\Delta _r}H_{298}^0\)của phản ứng
Giá trị \({\Delta _r}H_{298}^0\)của phản ứng: 2CO2(g) \( \to \)3CO(g) + O2(g) là: 2. \({\Delta _r}H_{298}^0\)(1) = 2.280 = 560 kJ
Đáp án C
Cho biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn:
4FeS2(s) + 11O2 \( \to \)2Fe2O3(s) + 8SO2(g)
Biết nhiệt tạo thành \({\Delta _f}H_{298}^0\)của FeS2(s), Fe2O3(s), và SO2(g) lần lượt là -177,9 kJ/mol, -825,5 kJ/mol và -296,8 kJ/mol. Phát biểu nào sau đây sai?
-
A.
\({\Delta _f}H_{298}^0\)(O2(g))= 0 kJ
-
B.
\(\sum {{\Delta _f}H_{298}^0} \)(sp) = -4025,4 kJ
-
C.
\(\sum {{\Delta _f}H_{298}^0} \)(cđ) = -771,6 kJ
-
D.
Đây là phản ứng thu nhiệt
Đáp án : C
\(\sum {{\Delta _f}H_{298}^0} \)(cđ) = 4. \({\Delta _f}H_{298}^0\)(FeS2) = 4. – 177,9 = - 711,6 kJ
\(\sum {{\Delta _f}H_{298}^0} \)(sp) = 2. \({\Delta _f}H_{298}^0\)(Fe2O3) + 8. \({\Delta _f}H_{298}^0\)(SO2) = 2.(-825,5) + 8.(-296,8) = -4025,4 kJ
Đáp án C
Cho nhiệt tạo thành chuẩn của các chất trong phương trình:
Biến thiên enthalpy của phản ứng sau: N2O4(g) +3CO(g) \( \to \)N2O(g) + 3CO2(g)
-
A.
-776,11 kJ
-
B.
10,89 kJ
-
C.
20,1 kJ
-
D.
-20,1 kJ
Đáp án : A
Dựa vào công thức tính \({\Delta _r}H_{298}^0\)của phản ứng
\({\Delta _r}H_{298}^0\)= \({\Delta _f}H_{298}^0\)(N2O) + 3.\({\Delta _f}H_{298}^0\)(CO2) – 3. \({\Delta _f}H_{298}^0\)(CO) - \({\Delta _f}H_{298}^0\)(N2O4)
= 82,05 + 3.(-393,5) – 3.(-110,5) – 9,16 = -776,11 kJ
Đáp án A
Phương trình nhiệt hóa học cho biết thông tin nào về phản ứng hóa học:
-
A.
Nhiệt phản ứng
-
B.
Trạng thái của chất đầu
-
C.
Trạng thái của chất sản phẩm
-
D.
Cả A, B, C đúng
Đáp án : D
Dựa vào kiến thức của năng lượng hóa học
Phương trình nhiệt hóa học cho biết nhiệt của phản ứng, trạng thái chất đầu và chất cuối
Đáp án D
: Trong các phát biểu sau đây có bao nhiêu phát biểu đúng?
(1) Tất cả các phản ứng cháy đều tỏa nhiệt
(2) Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt
(3) Tất cả các phản ứng mà chất tham gia có chứa nguyên tố oxygen đều tỏa nhiệt
(4) Phản ứng thu nhiệt là phản ứng hấp thu năng lượng dưới dạng nhiệt
(5) Lượng nhiệt mà phản ứng hấp thụ hay giải phóng không phụ thuộc vào điều kiện thực hiện phản ứng và thể
(6) Sự cháy của nhiên liệu (xăng, dầu, khí gas, than, gỗ,…) là những ví dụ về phản ứng thu nhiệt vì cần phải khơi mào
-
A.
2
-
B.
4
-
C.
3
-
D.
5
Đáp án : C
Dựa vào kiến thức về năng lượng hóa học
(1) đúng
(2) đúng
(3) sai, vì phản ứng nung KNO3 là phản ứng thu nhiệt
(4) đúng
(5) sai, vì thể của các chất có nhiệt tạo thành khác nhau
(6) sai, sự cháy của nhiên liệu là phản ứng tỏa nhiệt
Đáp án C
n Fe = 2,8 : 56 = 0,05 mol
Fe + H2SO4 \( \to \)FeSO4 + H2
0,05 0,05 0,05
V H2 = 0,05 . 24,79 = 1,2395 lít
10FeSO4 + 2KMnO4 + 8H2SO4 \( \to \)5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
0,05 \( \to \) 0,01
V KMnO4 = 0,01 : 0,1 = 0,1 lít = 100ml
: Xác định biến thiên enthalpy \({\Delta _r}H_{298}^0\)của mỗi phản ứng sau:
a, Phản ứng nhiệt phân đá vôi:
|
Chất |
CaCO3(s) |
CaO(s) |
CO2(g) |
|
\({\Delta _f}H_{298}^0\) |
-1206,9 |
-635,1 |
-393,5 |
b, Phản ứng đốt cháy methane: 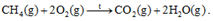
|
Liên kết |
C - H |
O = O |
C=O |
O-H |
|
Eb(kJ/mol) |
418 |
494 |
732 |
459 |
a) \({\Delta _r}H_{298}^0\)= \({\Delta _f}H_{298}^0\)(CaO) + \({\Delta _f}H_{298}^0\)(CO2) - \({\Delta _f}H_{298}^0\)(CaCO3)
= (-635,1) + (-393,5) – (-1206,9) = 178,3 kJ
b) \({\Delta _r}H_{298}^0\)= E CH4 + 2. E O2 – E CO2 – 2. E H2O
= 4. E C-H + 2. EO=O – 2. E C=O – 2. 2. E O-H = 4.418 + 2.494 – 2.732 – 4.459 = -640 kJ
Số oxi hóa của đơn chất luôn bằng
Cho hai phương trình nhiệt hóa học sau:
Methane là thành phần chính của khí thiên nhiên. Xét phản ứng đốt cháy methane:
Dấu hiệu để nhận ra một phản ứng oxi hóa – khử là dựa trên sự thay đổi đại lượng nào sau đây của
Chromium có số oxi hóa +2 trong hợp chất nào sau đây?
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |










Danh sách bình luận