Đề thi học kì 2 Hóa 10 Chân trời sáng tạo - Đề số 7
Phản ứng nào sau đây có thể tự xảy ra ở điều kiện thường?
Đề bài
Phản ứng nào sau đây có thể tự xảy ra ở điều kiện thường?
-
A.
Phản ứng nhiệt phân Cu(OH)2
-
B.
Phản ứng giữa H2 và O2 trong hỗn hợp khí.
-
C.
Phản ứng giữa Zn và dung dịch H2SO4
-
D.
Phản ứng đốt cháy cồn.
Dùng không khí nén thổi vào lò cao để đốt cháy than cốc (trong sản xuất gang), yếu tố ảnh hưởng tới tốc độ phản ứng là
-
A.
nhiệt độ, áp suất.
-
B.
tăng điện tích.
-
C.
nồng độ.
-
D.
chất xúc tác.
Cho các phát biểu sau:
(a) trong các phản ứng hóa học, flo chỉ thể hiện tính oxi hóa.
(b) HF là acid mạnh.
(c) trong hợp chất, các halogen (F, Cl, Br, I) đều có số oxi hóa: -1, +1, +3, +5 và +7.
(d) tính khử của các ion halogenua tăng dần theo thứ tự: F-, Cl-, Br-, I-.
Trong các phát biểu trên, số phát biểu đúng là:
-
A.
4
-
B.
3
-
C.
2
-
D.
1
Cho 100ml dung dịch FeCl3 1M tác dụng hoàn toàn với lượng dư dung dịch AgNO3, thì khối lượng kết tủa thu được là?
-
A.
53,85 gam.
-
B.
10,08 gam.
-
C.
43,05 gam.
-
D.
25,15 gam.
Thực hiện 2 thí nghiệm theo hình vẽ sau:

10mL dung dịch H2SO4 0,1M
10mL dung dịch Na2S2O3 0,1M
10mL dung dịch Na2S2O3 0,05M
Ở thí nghiệm nào có kết tủa xuất hiện trước?
-
A.
Thí nghiệm bên trái có kết tủa xuất hiện trước.
-
B.
Thí nghiệm bên phải có kết tủa xuất hiện trước.
-
C.
Kết tủa xuất hiện đồng thời.
-
D.
Không có kết tủa xuất hiện.
Phương trình nhiệt hóa học nào sau đây là phản ứng thu nhiệt ở điều kiện chuẩn, nhiệt độ 298K?
-
A.
\(Cu{(OH)_{2\,}}_{(s)} \to Cu{O_{(s)}} + {H_2}{O_{(l)}}\,\,\,{\Delta _r}H_{298}^0 = + 9,0\,kJ.\)
-
B.
\(2A{l_{(s)}} + \frac{3}{2}{O_{2\,(g)}} \to A{l_2}{O_3}_{(s)}\,\,{\Delta _r}H_{298}^0 = - 1675,7\,kJ.\)
-
C.
\({C_2}{H_{4\,(g)}} + {H_{2\,(g)}} \to {C_2}{H_6}_{(g)}\,\,\,{\Delta _r}H_{298}^0 = - 137,0\,kJ.\)
-
D.
\({C_{(s)}} + {O_{2\,(g)}} \to C{O_{2\,(g)}}\,\,\,{\Delta _r}H_{298}^0 = - 393,5\,kJ.\)
Cho các phản ứng sau :
(1) Nung NH4Cl(s) tạo ra HCl(g) và NH3(g).
(2) Cồn cháy trong không khí.
(3) Phản ứng thủy phân collagen thành gelatin (là một loại protein dễ tiêu hóa) diễn ra khi hầm xương động vật.
(4) Đốt cháy than là phản ứng.
(5) Đốt cháy khí gas trên bếp gas.
(6) Cho vôi sống vào nước là.
(7) Phản ứng nung vôi.
Các quá trình toả nhiệt hay thu nhiệt tương ứng là ?
-
A.
Tỏa nhiệt : (2), (4), (5), (6) và thu nhiệt : (1), (3) và (7).
-
B.
Tỏa nhiệt : (2), (3), (5), (6) và thu nhiệt : (1), (4) và (7).
-
C.
Tỏa nhiệt : (2), (3), (4), (6) và thu nhiệt : (1), (5) và (7).
-
D.
Tỏa nhiệt : (2), (3), (4), (5) và thu nhiệt : (1), (6) và (7).
Methane là thành phần chính của khí thiên nhiên. Xét phản ứng đốt cháy methane:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) \({\Delta _r}H_{298}^0\) = – 890,3 kJ
Biết nhiệt tạo thành chuẩn của CO2(g) và H2O(l) tương ứng là –393,5 –285,8 kJ/mol. Nhiệt tạo thành chuẩn của khí methane là
-
A.
\({\Delta _f}H_{298}^0\) (CH4 (g)) = –74,8 kJ/mol.
-
B.
\({\Delta _r}H_{298}^0\) (CH4 (g)) = +748 kJ/mol
-
C.
\({\Delta _r}H_{298}^0\) (CH4 (g)) = –748 kJ/mol
-
D.
\({\Delta _r}H_{298}^0\) (CH4 (g)) = +74,8 kJ/mol
Trường hợp nào không xảy ra phản ứng hóa học?
-
A.
Sục khí Cl2 vào dung dịch FeCl2
-
B.
Cho I2 vào dung dịch NaBr
-
C.
Cho Fe vào dung dịch HCl đặc, nguội
-
D.
Sục khí Cl2 vào dung dịch NaBr
Thể tích khí Cl2 (đkc) vừa đủ để tác dụng hết với dung dịch KI thu được 2,54g I2 là
-
A.
247,9 ml
-
B.
495,8ml
-
C.
371,85 ml
-
D.
112 ml
Đinh một mẩu giấy màu ẩm vào dây kim loại gần với nút đậy bình tam giác. Sau đó, đưa mẩu giấy vào bình tam giác có chứa khí chlorine. Hiện tượng quan sát được là
-
A.
mẩu giấy đậm màu hơn
-
B.
mẩu giấy bị nhạt màu dần rồi mất màu
-
C.
không có hiện tượng gì
-
D.
mẩu giấy chuyển màu xanh
Chất xúc tác là chất
-
A.
làm tăng tốc độ phản ứng và bị mất đi sau phản ứng
-
B.
làm giảm tốc độ phản ứng và không bị mất đi sau phản ứng
-
C.
làm giảm tốc độ phản ứng và bị mất đi sau phản ứng
-
D.
làm tăng tốc độ phản ứng và không bị mất đi sau phản ứng
Nguyên tố nào sau đây không thuộc nhóm halogen?
-
A.
Fluorine
-
B.
Chlorine
-
C.
Chromium
-
D.
Bromine
Cho phản ứng hóa học sau: Mg(s) + 2HCl(aq) \( \to \) MgCl2(aq) + H2(g).
Sau 40 giây, nồng độ của dung dịch HCl giảm từ 0,6M về còn 0,4M. Tốc độ trung bình của phản ứng theo HCl trong 40 giây là
-
A.
5.10-3(M/s)
-
B.
5.103 (M/s)
-
C.
2,5.10-3(M/S)
-
D.
2,5.103(M/s)
Khi nhiệt độ tăng thêm 10oC, tốc độ phản ứng hóa học tăng lên 2 lần. Để tốc độ phản ứng đó (đang tiến hành ở 20oC) tăng lên 32 lần thì cần thực hiện phản ứng ở nhiệt độ bao nhiêu?
-
A.
40oC
-
B.
50oC
-
C.
60oC
-
D.
70oC
Cho phương trình nhiệt hóa học của phản ứng: N2(g) + O2(g) \( \to \)2NO(g) \({\Delta _r}H_{298}^o > 0\)
a) Phản ứng thu nhiệt
b) Phản ứng xảy ra thuận lợi ở điều kiện thường
c) Phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường
d) Nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấp.
Trong tự nhiên và cuộc sống, có nhiều phản ứng hóa học xảy ra với tốc độ khác nhau phụ thuộc vào nồng độ chất phản ứng
a) Khi cho que đóm còn tàn đỏ vào bình oxygen thì que đóm bùng cháy, để ở ngoài thì không có hiện tượng là do nồng độ oxygen trong bình khí oxygen cao hơn.
b) Đám cháy xăng, dầu sẽ được dập tắt nhanh nếu chúng ta phun nước vào
c) Khi làm sữa chua, nếu cho nhiều sữa chua thì quá trình lên men diễn ra nhanh hơn
d) Khi làm bánh mì, nếu cho nhiều men vào bột thì quá trình lên men diễn ra nhanh hơn.
Cho các phát biểu sau:
a) Trong các phản ứng hóa học, fluorine chỉ thể hiện tính oxi hóa
b) Hydrofluoric acid là acid yếu
c) Dung dịch HF được dùng làm hóa chất để khắc thủy tinh
d) Tính khử của các ion halogenua tăng dần theo thứ tự: Cl-, Br-, I-.
Cho phản ứng hóa học có dạng: A + B \( \to \) C. Tốc độ phản ứng thay đổi như thế nào khi
a) Nồng độ A tăng 2 lần, giữ nguyên nồng độ B thì tốc độ phản ứng tăng 2 lần
b) Nồng độ của cả hai chất đều tăng lên 2 lần thì tốc độ phản ứng tăng lên 4 lần
c) Nồng độ của chất này tăng lên 2 lần, nồng độ của chất kia giảm đi 2 lần thì tốc độ phản ứng tăng lên 2 lần
d) Tăng áp suất lên 2 lần đối với hỗn hợp phản ứng, coi đây là phản ứng của các chất khí thì tốc độ phản ứng tăng lên 4 lần.
Lời giải và đáp án
Phản ứng nào sau đây có thể tự xảy ra ở điều kiện thường?
-
A.
Phản ứng nhiệt phân Cu(OH)2
-
B.
Phản ứng giữa H2 và O2 trong hỗn hợp khí.
-
C.
Phản ứng giữa Zn và dung dịch H2SO4
-
D.
Phản ứng đốt cháy cồn.
Đáp án : C
Phản ứng xảy ra ở nhiệt độ thường là phản ứng tỏa nhiệt
Phản ứng giữa Zn và dung dịch H2SO4
Đáp án C
Dùng không khí nén thổi vào lò cao để đốt cháy than cốc (trong sản xuất gang), yếu tố ảnh hưởng tới tốc độ phản ứng là
-
A.
nhiệt độ, áp suất.
-
B.
tăng điện tích.
-
C.
nồng độ.
-
D.
chất xúc tác.
Đáp án : A
Dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng
Dùng không khí nén thổi vào lò cao để đốt cháy than cốc, yếu tố nhiệt độ và áp suất làm ảnh hưởng tới tốc độ phản ứng.
Cho các phát biểu sau:
(a) trong các phản ứng hóa học, flo chỉ thể hiện tính oxi hóa.
(b) HF là acid mạnh.
(c) trong hợp chất, các halogen (F, Cl, Br, I) đều có số oxi hóa: -1, +1, +3, +5 và +7.
(d) tính khử của các ion halogenua tăng dần theo thứ tự: F-, Cl-, Br-, I-.
Trong các phát biểu trên, số phát biểu đúng là:
-
A.
4
-
B.
3
-
C.
2
-
D.
1
Đáp án : C
Dựa vào tính chất của nguyên tố halogen
(a) đúng
(b) sai, HF là một acid yếu
(c) sai, fluorine không có số oxi hóa +1,+3,+5,+7
(d) đúng
Đáp án C
Cho 100ml dung dịch FeCl3 1M tác dụng hoàn toàn với lượng dư dung dịch AgNO3, thì khối lượng kết tủa thu được là?
-
A.
53,85 gam.
-
B.
10,08 gam.
-
C.
43,05 gam.
-
D.
25,15 gam.
Đáp án : C
Dựa vào phản ứng FeCl3 + 3AgNO3 \( \to \)Fe(NO3)3 + 3AgCl
n FeCl3 = 0,1.1 = 0,1 mol
FeCl3 + 3AgNO3 \( \to \)Fe(NO3)3 + 3AgCl
0,1\( \to \) 0,3
n AgCl = 0,3.143,5 = 43,05g
Đáp án C
Thực hiện 2 thí nghiệm theo hình vẽ sau:

10mL dung dịch H2SO4 0,1M
10mL dung dịch Na2S2O3 0,1M
10mL dung dịch Na2S2O3 0,05M
Ở thí nghiệm nào có kết tủa xuất hiện trước?
-
A.
Thí nghiệm bên trái có kết tủa xuất hiện trước.
-
B.
Thí nghiệm bên phải có kết tủa xuất hiện trước.
-
C.
Kết tủa xuất hiện đồng thời.
-
D.
Không có kết tủa xuất hiện.
Đáp án : A
Dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng
ở thí nghiệm bến trái có xuất hiện kết tủa trước vì có nồng độ Na2S2O3 lớn hơn
Đáp án A
Phương trình nhiệt hóa học nào sau đây là phản ứng thu nhiệt ở điều kiện chuẩn, nhiệt độ 298K?
-
A.
\(Cu{(OH)_{2\,}}_{(s)} \to Cu{O_{(s)}} + {H_2}{O_{(l)}}\,\,\,{\Delta _r}H_{298}^0 = + 9,0\,kJ.\)
-
B.
\(2A{l_{(s)}} + \frac{3}{2}{O_{2\,(g)}} \to A{l_2}{O_3}_{(s)}\,\,{\Delta _r}H_{298}^0 = - 1675,7\,kJ.\)
-
C.
\({C_2}{H_{4\,(g)}} + {H_{2\,(g)}} \to {C_2}{H_6}_{(g)}\,\,\,{\Delta _r}H_{298}^0 = - 137,0\,kJ.\)
-
D.
\({C_{(s)}} + {O_{2\,(g)}} \to C{O_{2\,(g)}}\,\,\,{\Delta _r}H_{298}^0 = - 393,5\,kJ.\)
Đáp án : A
Dựa vào dấu của biến thiên enthalpy
Phương trình nhiệt hóa học \(Cu{(OH)_{2\,}}_{(s)} \to Cu{O_{(s)}} + {H_2}{O_{(l)}}\,\,\,{\Delta _r}H_{298}^0 = + 9,0\,kJ.\)là phản ứng thu nhiệt vì có \({\Delta _r}H_{298}^o\)> 0
Đáp án A
Cho các phản ứng sau :
(1) Nung NH4Cl(s) tạo ra HCl(g) và NH3(g).
(2) Cồn cháy trong không khí.
(3) Phản ứng thủy phân collagen thành gelatin (là một loại protein dễ tiêu hóa) diễn ra khi hầm xương động vật.
(4) Đốt cháy than là phản ứng.
(5) Đốt cháy khí gas trên bếp gas.
(6) Cho vôi sống vào nước là.
(7) Phản ứng nung vôi.
Các quá trình toả nhiệt hay thu nhiệt tương ứng là ?
-
A.
Tỏa nhiệt : (2), (4), (5), (6) và thu nhiệt : (1), (3) và (7).
-
B.
Tỏa nhiệt : (2), (3), (5), (6) và thu nhiệt : (1), (4) và (7).
-
C.
Tỏa nhiệt : (2), (3), (4), (6) và thu nhiệt : (1), (5) và (7).
-
D.
Tỏa nhiệt : (2), (3), (4), (5) và thu nhiệt : (1), (6) và (7).
Đáp án : A
Dựa vào khái niệm phản ứng thu nhiêt, phản ứng tỏa nhiệt
Tỏa nhiệt: (2), (4), (5), (6) và thu nhiệt: (1), (3) và (7)
Đáp án A
Methane là thành phần chính của khí thiên nhiên. Xét phản ứng đốt cháy methane:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) \({\Delta _r}H_{298}^0\) = – 890,3 kJ
Biết nhiệt tạo thành chuẩn của CO2(g) và H2O(l) tương ứng là –393,5 –285,8 kJ/mol. Nhiệt tạo thành chuẩn của khí methane là
-
A.
\({\Delta _f}H_{298}^0\) (CH4 (g)) = –74,8 kJ/mol.
-
B.
\({\Delta _r}H_{298}^0\) (CH4 (g)) = +748 kJ/mol
-
C.
\({\Delta _r}H_{298}^0\) (CH4 (g)) = –748 kJ/mol
-
D.
\({\Delta _r}H_{298}^0\) (CH4 (g)) = +74,8 kJ/mol
Đáp án : A
Dựa vào công thức tính biến thiên enthalpy của phản ứng
\(\begin{array}{l}{\Delta _r}H_{298}^o = {\Delta _f}H_{298}^o(C{O_2}) + 2.{\Delta _f}H_{298}^o({H_2}{\rm{O}}) - {\Delta _f}H_{298}^o(C{H_4}) = - 890,3\\ \to {\Delta _f}H_{298}^o(C{H_4}) = - 74,8kJ/mol\end{array}\)
Đáp án A
Trường hợp nào không xảy ra phản ứng hóa học?
-
A.
Sục khí Cl2 vào dung dịch FeCl2
-
B.
Cho I2 vào dung dịch NaBr
-
C.
Cho Fe vào dung dịch HCl đặc, nguội
-
D.
Sục khí Cl2 vào dung dịch NaBr
Đáp án : B
Dựa vào tính chất hóa học của halogen
I2 không tác dụng với NaBr do I2 có tính khử yếu hơn Br-
Đáp án B
Thể tích khí Cl2 (đkc) vừa đủ để tác dụng hết với dung dịch KI thu được 2,54g I2 là
-
A.
247,9 ml
-
B.
495,8ml
-
C.
371,85 ml
-
D.
112 ml
Đáp án : A
Dựa vào phản ứng của Cl2 và KI
n I2 = 2,54 : 254 = 0,01 mol
Cl2 + 2KI \( \to \)2KCl + I2
0,01 0,01
V Cl2 = 0,01. 24,79 = 0,2479 L = 247,9 ml
Đáp án A
Đinh một mẩu giấy màu ẩm vào dây kim loại gần với nút đậy bình tam giác. Sau đó, đưa mẩu giấy vào bình tam giác có chứa khí chlorine. Hiện tượng quan sát được là
-
A.
mẩu giấy đậm màu hơn
-
B.
mẩu giấy bị nhạt màu dần rồi mất màu
-
C.
không có hiện tượng gì
-
D.
mẩu giấy chuyển màu xanh
Đáp án : B
Dựa vào tính oxi hóa của khí chlorine
Khi đưa mẩu giấy màu ẩm vào bình đựng khí chlorine, mẩu giấy bị nhạt màu dần rồi mất màu do khả năng tẩy màu khi Cl2 tác dụng với H2O
Đáp án B
Chất xúc tác là chất
-
A.
làm tăng tốc độ phản ứng và bị mất đi sau phản ứng
-
B.
làm giảm tốc độ phản ứng và không bị mất đi sau phản ứng
-
C.
làm giảm tốc độ phản ứng và bị mất đi sau phản ứng
-
D.
làm tăng tốc độ phản ứng và không bị mất đi sau phản ứng
Đáp án : D
Dựa vào khái niệm của chất xúc tác
Chất xúc tác làm tăng tốc độ phản ứng và không bị mất đi sau phản ứng
Đáp án D
Nguyên tố nào sau đây không thuộc nhóm halogen?
-
A.
Fluorine
-
B.
Chlorine
-
C.
Chromium
-
D.
Bromine
Đáp án : C
Dựa vào kiến thức về nhóm halogen
Chlromium (Cr) không thuộc nhóm halogen
Đáp án C
Cho phản ứng hóa học sau: Mg(s) + 2HCl(aq) \( \to \) MgCl2(aq) + H2(g).
Sau 40 giây, nồng độ của dung dịch HCl giảm từ 0,6M về còn 0,4M. Tốc độ trung bình của phản ứng theo HCl trong 40 giây là
-
A.
5.10-3(M/s)
-
B.
5.103 (M/s)
-
C.
2,5.10-3(M/S)
-
D.
2,5.103(M/s)
Đáp án : C
Dựa vào công thức tính tốc độ phản ứng
\(v = \frac{1}{2}.\frac{{0,6 - 0,4}}{{40}} = 0,0025M/s\)
Đáp án C
Khi nhiệt độ tăng thêm 10oC, tốc độ phản ứng hóa học tăng lên 2 lần. Để tốc độ phản ứng đó (đang tiến hành ở 20oC) tăng lên 32 lần thì cần thực hiện phản ứng ở nhiệt độ bao nhiêu?
-
A.
40oC
-
B.
50oC
-
C.
60oC
-
D.
70oC
Đáp án : D
Dựa vào hệ số nhiệt độ Van’t Hoff
\(\begin{array}{l}\frac{{{v_T}}}{{{v_{{{20}^o}C}}}} = {\gamma ^{\frac{{(T - 20)}}{{10}}}}\\ \to 32 = {2^{\frac{{(T - 20)}}{{10}}}}\\ \to T = {70^o}C\end{array}\)
Cho phương trình nhiệt hóa học của phản ứng: N2(g) + O2(g) \( \to \)2NO(g) \({\Delta _r}H_{298}^o > 0\)
a) Phản ứng thu nhiệt
b) Phản ứng xảy ra thuận lợi ở điều kiện thường
c) Phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường
d) Nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấp.
a) Phản ứng thu nhiệt
b) Phản ứng xảy ra thuận lợi ở điều kiện thường
c) Phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường
d) Nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấp.
a) đúng, phản ứng trên có \({\Delta _r}H_{298}^o > 0\)
b) sai, phản ứng xảy ra khó khăn ở điều kiện thường
c) đúng
d) đúng
Trong tự nhiên và cuộc sống, có nhiều phản ứng hóa học xảy ra với tốc độ khác nhau phụ thuộc vào nồng độ chất phản ứng
a) Khi cho que đóm còn tàn đỏ vào bình oxygen thì que đóm bùng cháy, để ở ngoài thì không có hiện tượng là do nồng độ oxygen trong bình khí oxygen cao hơn.
b) Đám cháy xăng, dầu sẽ được dập tắt nhanh nếu chúng ta phun nước vào
c) Khi làm sữa chua, nếu cho nhiều sữa chua thì quá trình lên men diễn ra nhanh hơn
d) Khi làm bánh mì, nếu cho nhiều men vào bột thì quá trình lên men diễn ra nhanh hơn.
a) Khi cho que đóm còn tàn đỏ vào bình oxygen thì que đóm bùng cháy, để ở ngoài thì không có hiện tượng là do nồng độ oxygen trong bình khí oxygen cao hơn.
b) Đám cháy xăng, dầu sẽ được dập tắt nhanh nếu chúng ta phun nước vào
c) Khi làm sữa chua, nếu cho nhiều sữa chua thì quá trình lên men diễn ra nhanh hơn
d) Khi làm bánh mì, nếu cho nhiều men vào bột thì quá trình lên men diễn ra nhanh hơn.
a) đúng
b) sai, xăng nhẹ hơn nước, nếu phun nước sẽ làm đám cháy lan rộng hơn
c) đúng
d) đúng
Cho các phát biểu sau:
a) Trong các phản ứng hóa học, fluorine chỉ thể hiện tính oxi hóa
b) Hydrofluoric acid là acid yếu
c) Dung dịch HF được dùng làm hóa chất để khắc thủy tinh
d) Tính khử của các ion halogenua tăng dần theo thứ tự: Cl-, Br-, I-.
a) Trong các phản ứng hóa học, fluorine chỉ thể hiện tính oxi hóa
b) Hydrofluoric acid là acid yếu
c) Dung dịch HF được dùng làm hóa chất để khắc thủy tinh
d) Tính khử của các ion halogenua tăng dần theo thứ tự: Cl-, Br-, I-.
a) Đúng
b) đúng
c) đúng, HF phản ứng với SiO2
d) đúng
Cho phản ứng hóa học có dạng: A + B \( \to \) C. Tốc độ phản ứng thay đổi như thế nào khi
a) Nồng độ A tăng 2 lần, giữ nguyên nồng độ B thì tốc độ phản ứng tăng 2 lần
b) Nồng độ của cả hai chất đều tăng lên 2 lần thì tốc độ phản ứng tăng lên 4 lần
c) Nồng độ của chất này tăng lên 2 lần, nồng độ của chất kia giảm đi 2 lần thì tốc độ phản ứng tăng lên 2 lần
d) Tăng áp suất lên 2 lần đối với hỗn hợp phản ứng, coi đây là phản ứng của các chất khí thì tốc độ phản ứng tăng lên 4 lần.
a) Nồng độ A tăng 2 lần, giữ nguyên nồng độ B thì tốc độ phản ứng tăng 2 lần
b) Nồng độ của cả hai chất đều tăng lên 2 lần thì tốc độ phản ứng tăng lên 4 lần
c) Nồng độ của chất này tăng lên 2 lần, nồng độ của chất kia giảm đi 2 lần thì tốc độ phản ứng tăng lên 2 lần
d) Tăng áp suất lên 2 lần đối với hỗn hợp phản ứng, coi đây là phản ứng của các chất khí thì tốc độ phản ứng tăng lên 4 lần.
Biểu thức tính tốc độ phản ứng trên là: v = k.[A][B]
a) Đúng
b) Đúng
c) sai, tốc độ phản ứng giữ nguyên
d) sai, tốc độ phản ứng tăng 2 lần
Các biện pháp được sử dụng để làm tăng tốc độ phản ứng: dùng chất xúc tác manganese dioxide (MnO2); nung hỗn hợp potassium chlorate và manganese dioxide ở nhiệt độ cao.
\(\begin{array}{l}\bar v = - \frac{{\Delta {C_{B{r_2}}}}}{t} = - \frac{{(0,01 - a)}}{{50}} = {4.10^{ - 5}}\\ \to a = 0,012M\end{array}\)
Số ống nghiệm cho kết tủa với dung dịch AgNO3 là: 2
PTHH: HCl + AgNO3 \( \to \)AgCl\( \downarrow \) + HNO3
NaBr + AgNO3 \( \to \)AgBr \( \downarrow \)+ NaNO3
KIO3 + 5KI + 3H2SO4 → 3K2SO4 + 3I2 + 3H2O
0,1 mol ← 0,3 mol
\({m_{KI{O_{_3}}}} = 0,1.(39 + 127 + 16.3) = 21,4gam\)
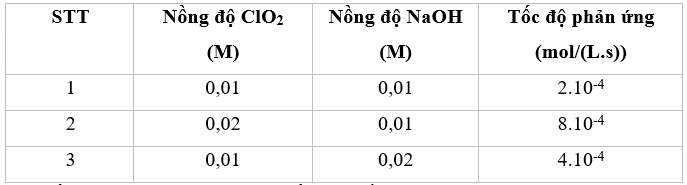
\(\begin{array}{l}{v_1} = k.C_{Cl{O_2}}^x.C_{NaOH}^y = k.0,{01^x}.0,{01^y} = {2.10^{ - 4}}\\{v_2} = k.C_{Cl{O_2}}^x.C_{NaOH}^y = k.0,{02^x}.0,{01^y} = {8.10^{ - 4}}\\ \to \frac{{{v_1}}}{{{v_2}}} = \frac{{k.0,{{01}^x}.0,{{01}^y}}}{{k.0,{{02}^x}.0,{{01}^y}}} = \frac{{{{2.10}^{ - 4}}}}{{{{8.10}^{ - 4}}}}\\ \to x = 2\end{array}\)
\(\begin{array}{l}{v_1} = k.C_{Cl{O_2}}^x.C_{NaOH}^y = k.0,{01^x}.0,{01^y} = {2.10^{ - 4}}\\{v_3} = k.C_{Cl{O_2}}^x.C_{NaOH}^y = k.0,{01^x}.0,{02^y} = {4.10^{ - 4}}\\ \to \frac{{{v_1}}}{{{v_3}}} = \frac{{k.0,{{01}^x}.0,{{01}^y}}}{{k.0,{{01}^x}.0,{{02}^y}}} = \frac{{{{2.10}^{ - 4}}}}{{{{4.10}^{ - 4}}}}\\ \to y = 1\end{array}\)
Tổng x + y = 1 + 2 = 3
HCl đóng vai trò là chất khử khi tăng số oxi hóa
(a); (c) đóng vai trò là chất khử.
Xét phản ứng đốt cháy methane:
Phản ứng nào sau đây có thể tự xảy ra ở điều kiện thường?
Khi tiến hành điều chế và thu khí Cl2 vào bình, để ngăn khí Cl2 thoát ra ngoài gây độc, cần đậy miệng bình thu khí Cl2 bằng bông có tẩm dung dịch
Phát biểu nào sau đây không đúng khi nói về phản ứng của đơn chất nhóm VIIA với dung dịch muối halide?
Cho 44,5 gam hỗn hợp bột Zn và Mg tác dụng với dung dịch HCl dư thấy có 22,4 lít khí H2 bay ra (đktc). Khối lượng muối tạo ra trong dung dịch là
Thuốc tím chứa ion permanganate (MnO4-) có tính oxi hóa mạnh, được dùng để sát trùng, diệt khuẩn trong y học, đời sống và nuôi trồng thủy sản. Số oxi hóa của manganse trong ion permanganate là gì?
Trong phản ứng oxi hóa – khử, chất oxi hóa là chất:
- Khái niệm và xác định được số oxi hóa của nguyên tử các nguyên tố trong hợp chất.
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |










Danh sách bình luận