Bài 26. Ôn tập chương 7 trang 127 Hóa 12 Kết nối tri thức
Khi so sánh kim loại nhóm IA với các kim loại khác trong cùng chu kì, nhận định nào sau đây không đúng?
CH tr 127 Câu 1
Trả lời câu hỏi 1 trang 127 SGK Hóa 12 Kết nối tri thức
Khi so sánh kim loại nhóm IA với các kim loại khác trong cùng chu kì, nhận định nào sau đây không đúng?
A. Có tính khử mạnh nhất. B. Có thế điện cực chuẩn âm nhất.
C. Có bán kính nguyên tử lớn nhất. D. Có nhiều electron hoá trị nhất.
Phương pháp giải:
Dựa vào xu hướng biến đổi tính chất của các nguyên tố trong cùng chu kì của bảng tuần hoàn.
Lời giải chi tiết:
Trong cùng một chu kì, kim loại nhóm IA có tính khử mạnh nhất, giá trị thế điện cực chuẩn âm nhất và bán kinh nguyên tử lớn nhất.
Kim loại nhóm IA chỉ 1 electron hóa trị nên so với các kim loại khác trong cùng chu kì, kim loại nhóm IA có ít electron hóa trị hơn.
→ Chọn D.
CH tr 127 Câu 2
Trả lời câu hỏi 2 trang 127 SGK Hóa 12 Kết nối tri thức
\({\rm{NaCl}} + {\rm{N}}{{\rm{H}}_{\rm{3}}} + {\rm{C}}{{\rm{O}}_{\rm{2}}} + {{\rm{H}}_{\rm{2}}}{\rm{O}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{NaHC}}{{\rm{O}}_{\rm{3}}} + {\rm{N}}{{\rm{H}}_{\rm{4}}}{\rm{Cl}}\)
Khi làm lạnh dung dịch trên, muối bị tách ra khỏi dung dịch là
A. NaHCO3 B. NH4Cl. C. NaCl. D. NH4HCO3.
Phương pháp giải:
Muối ít tan hơn sẽ kết tinh trước.
Lời giải chi tiết:
Do NaHCO3 ít tan hơn các muối khác nên kết tinh trước, bị tách ra khỏi dung dịch.
→ Chọn A.
CH tr 127 Câu 3
Trả lời câu hỏi 3 trang 127 SGK Hóa 12 Kết nối tri thức
Độ tan trong dãy muối sulfate từ MgSO4 đến BaSO4 biến đổi như thế nào?
A. Tăng dần. B. Giảm dần.
C. Không có quy luật. D. Không đổi.
Phương pháp giải:
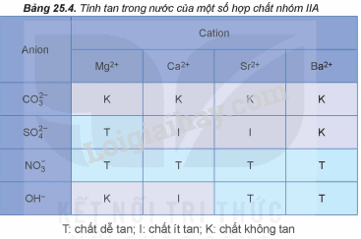
Lời giải chi tiết:
Độ tan trong dãy muối sulfate từ MgSO4 đến BaSO4 giảm dần.
→ Chọn B.
CH tr 127 Câu 4
Trả lời câu hỏi 4 trang 127 SGK Hóa 12 Kết nối tri thức
Độ bền nhiệt trong dãy muối carbonate từ MgCO3 đến BaCO3 biến đổi như thế nào?
A. Tăng dần. B. Giảm dần.
C. Không có quy luật. D. Không đổi.
Phương pháp giải:
Dựa vào biến thiên enthalpy của phản ứng nhiệt phân.
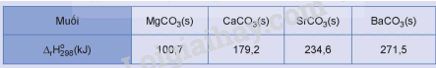
Lời giải chi tiết:
Độ bền nhiệt trong dãy muối carbonate từ MgCO3 đến BaCO3 tăng dần.
→ Chọn A.
CH tr 127 Câu 5
Trả lời câu hỏi 5 trang 127 SGK Hóa 12 Kết nối tri thức
Nguyên tắc làm mềm nước cứng là làm giảm nồng độ của các ion nào sau đây?
A. Ion sulfate vȧ ion chloride. B. Ion nitrate và ion hydrogencarbonate.
C. lon magnesium và ion calcium. D. Ion sodium và ion potassium.
Phương pháp giải:
Nguyên tắc làm mềm nước cứng là làm giảm nồng độ các cation Ca2+ và Mg2+ trong nước cứng.
Lời giải chi tiết:
Nguyên tắc làm mềm nước cứng là làm giảm nồng độ của các ion magnesium và ion calcium.
→ Chọn C.
CH tr 127 Câu 6
Trả lời câu hỏi 6 trang 127 SGK Hóa 12 Kết nối tri thức
Trình bày cách phân biệt dung dịch CaCl2 và dung dịch BaCl2 bằng màu ngọn lửa và bằng phương pháp hoá học.
Phương pháp giải:
Khi đốt nóng các kim loại nhóm IIA hoặc hợp chất của chúng trong ngọn lửa không màu làm ngọn lửa có màu đặc trưng: Ca2+ màu đỏ cam, Sr2+ màu đỏ son, Ba2+ màu lục.
Lời giải chi tiết:
* Cách phân biệt dung dịch CaCl2 và dung dịch BaCl2 bằng màu ngọn lửa
- Trích các dung dịch trên làm mẫu thử và đánh số thứ tự.
- Nhúng đầu dây inox sạch vào một mẫu thử, rồi đưa vào ngọn lửa không màu của đèn khí. Lặp lại tương tự với mẫu thử còn lại:
+ Mẫu thử nào cháy cho ngọn lửa đỏ cam chứa dung dịch CaCl2.
+ Mẫu thử nào cháy cho ngọn lửa màu lục chứa dung dịch BaCl2.
* Cách phân biệt dung dịch CaCl2 và dung dịch BaCl2 bằng phương pháp hóa học
- Trích các dung dịch trên làm mẫu thử và đánh số thứ tự.
- Nhỏ dung dịch Na2CrO4 vào hai mẫu thử
+ Mẫu thử xuất hiện kết tủa trắng chứa dung dịch CaCl2.
+ Mẫu thử xuất hiện kết tủa vàng chứa dung dịch BaCl2.
Phương trình hóa học:
\({\rm{N}}{{\rm{a}}_{\rm{2}}}{\rm{Cr}}{{\rm{O}}_{\rm{4}}} + {\rm{ CaC}}{{\rm{l}}_{\rm{2}}} \to 2{\rm{NaCl}} + {\rm{CaCr}}{{\rm{O}}_{\rm{4}}} \downarrow \)
\({\rm{N}}{{\rm{a}}_{\rm{2}}}{\rm{Cr}}{{\rm{O}}_{\rm{4}}} + {\rm{ BaC}}{{\rm{l}}_{\rm{2}}} \to 2{\rm{NaCl}} + {\rm{BaCr}}{{\rm{O}}_{\rm{4}}} \downarrow \)
CH tr 127 Câu 7
Trả lời câu hỏi 7 trang 127 SGK Hóa 12 Kết nối tri thức
Trong công nghiệp, quá trình nung vôi được thực hiện theo phản ứng:
\({\rm{CaC}}{{\rm{O}}_{\rm{3}}}{\rm{(s)}} \to {\rm{CaO(s)}} + {\rm{C}}{{\rm{O}}_{\rm{2}}}{\rm{(g) }}{\Delta _{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}} = 179,2{\rm{ kJ}}\)
a) Cho biết quá trình nung vôi là quá trình toả nhiệt hay quá trình thu nhiệt.
b) Trình bày một số ứng dụng chính của sản phẩm nung vôi.
c) Nêu một số tác hại của quá trình nung vôi thủ công đối với môi trường.
Phương pháp giải:
a) \({\Delta _{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}}\)< 0: Phản ứng tỏa nhiệt; \({\Delta _{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}}\)> 0: phản ứng thu nhiệt.
b) Vôi sống (calcium oxide) làm vật liệu xây dựng, tẩy uế, sát trùng.
c) Dựa vào sản phẩm để nêu.
Lời giải chi tiết:
a) Quá trình nung vôi có \({\Delta _{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}}\)> 0 nên đây là quá trình thu nhiệt.
b) Sản phẩm chính của quá trình nung vôi là CaO, được sử dụng làm vật liệu xây dựng, tẩy uế, sát trùng.
c) Tác hại của quá trình nung vôi thủ công đối với môi trường
- Phát thải khí CO2, gây hiệu ứng nhà kính và ảnh hưởng đến biến đổi khí hậu.
- Các lò nung vôi thủ công thường không có kế hoạch khai thác nguyên liệu, khiến nguồn nguyên liệu bị cạn kiệt.
Luyện Bài Tập Trắc nghiệm Hóa 12 - Kết nối tri thức - Xem ngay
Các bài khác cùng chuyên mục
- Lý thuyết Một số tính chất và ứng dụng của phức chất - Hóa 12 Kết nối tri thức
- Lý thuyết Sơ lược về phức chất - Hóa 12 Kết nối tri thức
- Lý thuyết Đại cương về kim loại chuyển tiếp dãy thứ nhất - Hóa 12 Kết nối tri thức
- Lý thuyết Nguyên tố nhóm IIA - Hóa 12 Kết nối tri thức
- Lý thuyết Nguyên tố nhóm IA - Hóa 12 Kết nối tri thức
- Lý thuyết Một số tính chất và ứng dụng của phức chất - Hóa 12 Kết nối tri thức
- Lý thuyết Sơ lược về phức chất - Hóa 12 Kết nối tri thức
- Lý thuyết Đại cương về kim loại chuyển tiếp dãy thứ nhất - Hóa 12 Kết nối tri thức
- Lý thuyết Nguyên tố nhóm IIA - Hóa 12 Kết nối tri thức
- Lý thuyết Nguyên tố nhóm IA - Hóa 12 Kết nối tri thức













Danh sách bình luận