Bài 8. Amine trang 35, 36, 37 Hóa 12 Kết nối tri thức
Amine có nhiều ứng dụng trong các lĩnh vực dược phẩm
CH tr 35
Trả lời câu hỏi Mở đầu trang 35 SGK Hóa 12 Kết nối tri thức
Amine có nhiều ứng dụng trong các lĩnh vực dược phẩm, hóa mĩ phẩm và phẩm nhuộm. Vậy, amine là gì? Đặc điểm cấu tạo và tính chất của amine là gì?
Phương pháp giải:
Nêu khái niệm, cấu tạo, tính chất vật lí và hóa học của amine.
Lời giải chi tiết:
- Amine là dẫn xuất của ammonia, trong đó nguyên tử hydrogen trong phân tử ammonia được thay thế bằng gốc hydrocarbon.
- Đặc điểm cấu tạo: Trong phân tử amine, nguyên tử nitrogen có thể liên kết với 1 hoặc 2 hoặc 3 gốc hydrocarbon.
- Tính chất:
+ Tính chất vật lí:
· Amine có nhiệt độ sôi cao hơn hydrocarbon có cùng số nguyên tử carbon hoặc có phân tử khối tương đương.
· Methylamine, ethylamine, dimethylamine và trimethylamine là những chất khí, có mùi tanh của cá hoặc mùi khai tương tự ammonia (tuỳ nồng độ).
· Các amine có số nguyên tử carbon nhỏ thường tan tốt trong nước nhờ tạo được liên kết hydrogen với nước. Khi số nguyên tử carbon trong gốc hydrocarbon tăng thì độ tan của các amine giảm. Ở điều kiện thường, aniline là chất lỏng, ít tan trong nước.
+ Tính chất hóa học:
· Amine có tính base.
· Phản ứng với nitrous acid.
· Phản ứng ở nhân thơm ở aniline.
· Phản ứng tạo phức ở methylamine hoặc ethylamine.
CH tr 36 CH1
Trả lời câu hỏi 1 trang 36 SGK Hóa 12 Kết nối tri thức
Phân loại các amine dưới đây dựa trên bậc của amine và dựa trên đặc điểm cấu tạo của gốc hydrocarbon.
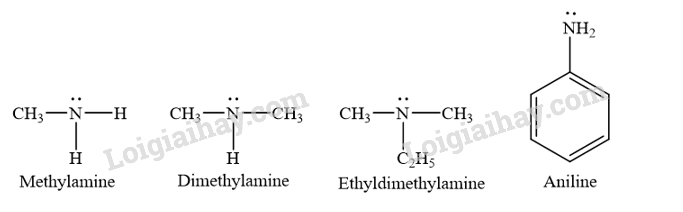
Phương pháp giải:
Amine thường được phân loại theo bậc của amine và bản chất gốc hydrocarbon.
– Bậc của amine được tính bằng số gốc hydrocarbon liên kết trực tiếp với nguyên tử nitrogen. Theo đó, amine được phân loại thành amine bậc một, amine bậc hai và amine bậc ba.
– Dựa trên đặc điểm cấu tạo của gốc hydrocarbon, amine được phân thành nhiều loại, trong đó hai loại điển hình là alkylamine (nhóm amine liên kết với gốc alkyl) và arylamine (nhóm amine liên kết trực tiếp với nguyên tử carbon của vòng benzene).
Lời giải chi tiết:
- Phân loại dựa trên bậc của amine:
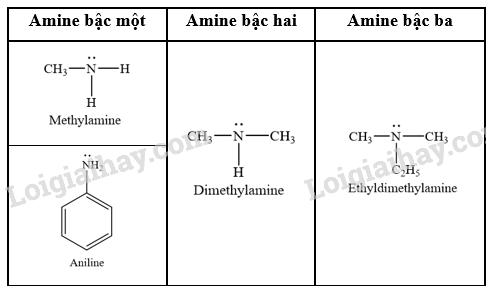
- Phân loại amine dựa trên đặc điểm cấu tạo của gốc hydrocarbon:
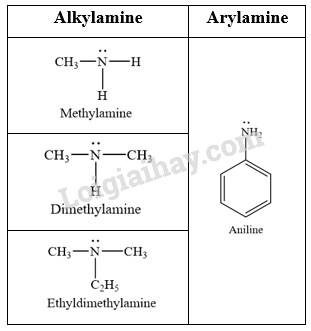
CH tr 36 CH2
Trả lời câu hỏi 2 trang 36 SGK Hóa 12 Kết nối tri thức
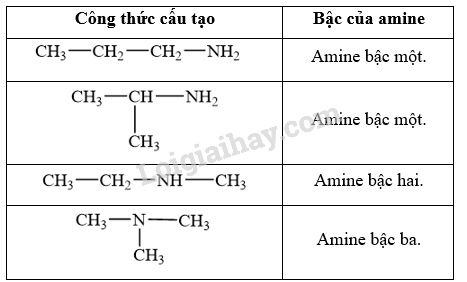
Viết công thức cấu tạo của các amine có công thức phân tử C3H9N và xác định bậc của các amine đó.
Phương pháp giải:
- Amine là dẫn xuất của ammonia, trong đó nguyên tử hydrogen trong phân tử ammonia được thay thế bằng gốc hydrocarbon.
- Bậc của amine được tính bằng số gốc hydrocarbon liên kết trực tiếp với nguyên tử nitrogen. Theo đó, amine được phân loại thành amine bậc một, amine bậc hai và amine bậc ba.
Lời giải chi tiết:
Các công thức cấu tạo của các amine có công thức phân tử C3H9N:
CH tr 37 CH1
Trả lời câu hỏi 1 trang 37 SGK Hóa 12 Kết nối tri thức
Gọi tên theo danh pháp gốc chức và danh pháp thay thế các amine sau: CH3CH2CH2NH2; CH3CH2NHCH3; (CH3)3N.
Phương pháp giải:
Tên của amine được gọi theo danh pháp gốc chức và danh pháp thay thế:
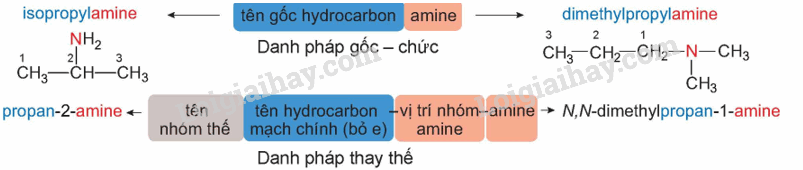
Lời giải chi tiết:
|
|
Danh pháp gốc chức |
Danh pháp thay thế |
|
CH3CH2CH2NH2 |
Propylamine |
Propan-1-amine |
|
CH3CH2NHCH3 |
Ethylmethylamine |
N-methylethanamine |
|
(CH3)3N |
Trimethylamine |
N,N-dimethylmethanamine |
CH tr 37 HĐ
Trả lời câu hỏi Hoạt động trang 37 SGK Hóa 12 Kết nối tri thức
Xác định trạng thái của các amine trong Bảng 8.1 ở nhiệt độ phòng (25 °C).
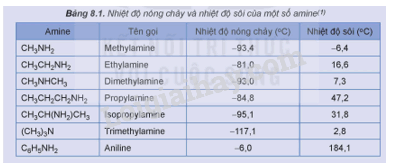
Phương pháp giải:
- Những chất có nhiệt độ sôi thấp hơn nhiệt độ phòng (25 °C) ở trạng khí.
- Những chất có nhiệt độ sôi cao hơn nhiệt độ phòng (25 °C) và nhiệt độ nóng chảy thấp hơn nhiệt độ phòng (25 °C) ở trạng lỏng.
Lời giải chi tiết:
- Các chất có trạng thái thể khí ở nhiệt độ phòng (25 °C): methylamine, ethylamine, dimethylamine, trimethylamine.
- Các chất có trạng thái thể lỏng ở nhiệt độ phòng (25 °C): propylamine, isopropylamine, aniline.
CH tr 38
Trả lời câu hỏi Hoạt động trang 38 SGK Hóa 12 Kết nối tri thức
Thí nghiệm: Phản ứng của nhóm amine
Chuẩn bị:
- Hoá chất: dung dịch methylamine 0,1 M, dung dịch HCl 0,1 M, dung dịch FeCl3 0,1 M dung dịch CuSO4 0,1 M, giấy pH/giấy quỳ tím, phenolphthalein.
- Dụng cụ: ống nghiệm, mặt kính đồng hồ.
Tiến hành:
1. Phản ứng với chất chỉ thị:
Nhỏ một giọt dung dịch methylamine 0,1 M lên mẫu giấy pH hoặc giấy quỳ tím đặt trên mặt kính đồng hồ.
Quan sát và mô tả sự thay đổi màu sắc của giấy pH.
2. Phản ứng với dung dịch acid:
- Cho 2 mL dung dịch methylamine 0,1 M vào ống nghiệm, thêm tiếp 1 giọt phenolphthalein.
- Nhỏ từ từ 2 mL dung dịch HCl 0,1 M vào ống nghiệm.
Quan sát hiện tượng xảy ra trong ống nghiệm, giải thích và viết phương trình hoá học.
3. Phản ứng với dung dịch muối:
- Cho khoảng 1 mL dung dịch FeCl3 0,1 M vào ống nghiệm.
- Thêm tiếp khoảng 3 mL dung dịch methylamine 0,1 M vào ống nghiệm.
Quan sát hiện tượng xảy ra trong ống nghiệm, giải thích và viết phương trình hoá học.
4. Phản ứng với copper(II) hydroxide:
- Cho khoảng 2 mL dung dịch CuSO4 0,1 M vào ống nghiệm.
Thêm từ từ dung dịch methylamine 0,1 M vào ống nghiệm, lắc đều tới khi kết tủa tan hết.
Quan sát hiện tượng xảy ra trong ống nghiệm, giải thích và viết phương trình hoá học.
Phương pháp giải:
- Amine có tính base yếu.
- Phương trình hóa học giữa amine bậc một và hydrochloric acid:
\({\rm{RN}}{{\rm{H}}_{\rm{2}}} + {\rm{HCl}} \to {\rm{RN}}{{\rm{H}}_3}{\rm{Cl}}\)
- Methylamine và ethylamine tạo hợp chất phức với Cu2+.
Lời giải chi tiết:
1. Phản ứng với chất chỉ thị:
Ban đầu giấy pH có màu vàng, sau khi nhỏ methylamine lên giấy pH thì giấy pH chuyển thành màu tím.
2. Phản ứng với dung dịch acid:
- Nhỏ một giọt phenolphthalein vào dung dịch methyl amine, dung dịch hóa hồng.
→ Dung dịch methylamine có môi trường base, làm phenolphthalein hóa hồng.
\({\rm{C}}{{\rm{H}}_3}{\rm{N}}{{\rm{H}}_{\rm{2}}} + {{\rm{H}}_{\rm{2}}}{\rm{O}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{C}}{{\rm{H}}_3}{\rm{NH}}_3^ + + {\rm{O}}{{\rm{H}}^ - }\)
- Thêm dung dịch HCl vào ống nghiệm, dung dịch bị mất màu hồng.
→ Methylamine phản ứng với hydrochloric acid, dung dịch sau phản ứng không có môi trường base nên không còn phenolphthalein hóa hồng.
\({\rm{C}}{{\rm{H}}_3}{\rm{N}}{{\rm{H}}_{\rm{2}}} + {\rm{HCl}} \to {\rm{C}}{{\rm{H}}_3}{\rm{N}}{{\rm{H}}_3}{\rm{Cl}}\)
3. Phản ứng với dung dịch muối:
Nhỏ methylamine vào dung dịch iron (III) chloride, thấy xuất hiện kết tủa màu nâu đỏ.
→ Phản ứng giữa methyl amine và iron (III) chloride sinh ra kết tủa Fe(OH)3 có màu nâu đỏ.
\({\rm{3C}}{{\rm{H}}_3}{\rm{N}}{{\rm{H}}_{\rm{2}}} + 3{{\rm{H}}_2}{\rm{O + FeC}}{{\rm{l}}_3} \to 3{\rm{C}}{{\rm{H}}_3}{\rm{N}}{{\rm{H}}_3}{\rm{Cl + Fe(OH}}{{\rm{)}}_3}\)
4. Phản ứng với copper(II) hydroxide:
- Khi thêm methylamine vào ống nghiệm chứa dung dịch copper (II) sulfate, kết tủa màu xanh lam xuất hiện.
→ Methylamine phản ứng với copper (II) sulfate tạo kết tủa copper (II) hydroxide màu xanh lam.
\({\rm{2C}}{{\rm{H}}_3}{\rm{N}}{{\rm{H}}_{\rm{2}}} + 2{{\rm{H}}_2}{\rm{O + CuS}}{{\rm{O}}_4} \to {({\rm{C}}{{\rm{H}}_3}{\rm{N}}{{\rm{H}}_3}{\rm{)}}_2}{\rm{S}}{{\rm{O}}_4}{\rm{ + Cu(OH}}{{\rm{)}}_2} \downarrow \)
- Sau đó, lắc đều ống nghiệm thì kết tủa tan, tạo thành dung dịch màu xanh lam.
→ Dung dịch methylamine hoà tan được kết tủa Cu(OH)2, tạo thành dung dịch có màu xanh lam là phức chất của methylamine với Cu2+.
\({\rm{4C}}{{\rm{H}}_3}{\rm{N}}{{\rm{H}}_{\rm{2}}} + {\rm{Cu(OH}}{{\rm{)}}_2} \to [{\rm{Cu}}{({\rm{C}}{{\rm{H}}_3}{\rm{N}}{{\rm{H}}_2}{\rm{)}}_4}{\rm{](OH}}{{\rm{)}}_2}{\rm{ }}\)
CH tr 39 CH
Trả lời câu hỏi trang 39 SGK Hóa 12 Kết nối tri thức
Giấm có thể dùng để khử mùi tanh của cá. Giải thích và viết phương trình hoá học.
(Biết mùi tanh của cá thường do trimethylamine gây ra.)
Phương pháp giải:
Amine có tính base, để khử amine ta có thể dùng những hợp chất có tính acid.
Lời giải chi tiết:
Mùi tanh cá gây ra bởi các amine (các chất có tính base) như trimetylamin, ta có thể sử dụng chất có tính acid như giấm hoặc chanh. Giấm và chanh đều chứa acid yếu sẽ tạo muối với amine và bị rửa trôi bằng nước, mà không ảnh hưởng nhiều đến chất lượng cá.
Phương trình hóa học giữa trimetylamin và acetic acid (trong giấm ăn):
\({{\rm{(C}}{{\rm{H}}_{\rm{3}}}{\rm{)}}_{\rm{3}}}{\rm{N}} + {\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COOH}} \to {{\rm{(C}}{{\rm{H}}_{\rm{3}}}{\rm{)}}_{\rm{3}}}{\rm{NHOOCC}}{{\rm{H}}_{\rm{3}}}\)
CH tr 39 HĐ
Trả lời câu hỏi Hoạt động trang 39 SGK Hóa 12 Kết nối tri thức
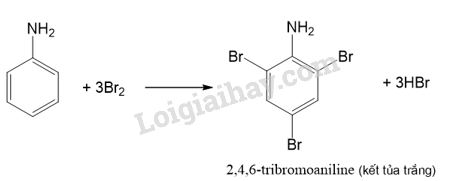
Thí nghiệm: Phản ứng của aniline với nước bromine
Chuẩn bị:
- Hoá chất: dung dịch aniline loãng, nước bromine.
- Dụng cụ: ống nghiệm.
Tiến hành:
- Cho khoảng 1 mL nước bromine vào ống nghiệm.
-Thêm từ từ vài giọt dung dịch aniline loãng vào ống nghiệm.
Quan sát hiện tượng xảy ra trong ống nghiệm, giải thích và viết phương trình hoá học.
Phương pháp giải:
Do ảnh hưởng của nhóm –NH2, aniline dễ tham gia phản ứng thế nguyên tử H của vòng benzene hơn so với benzene, ưu tiên thế vào các vị trí ortho và para so với nhóm NH2.
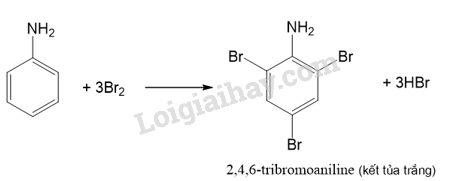
Lời giải chi tiết:
- Hiện tượng: Khi nhỏ vài giọt aniline vào ống nghiệm chứa nước bromine thì kết tủa trắng xuất hiện.
- Giải thích: Phản ứng giữa bromine và aniline sinh ra kết tủa trắng là 2,4,6-tribromoaniline.
Luyện Bài Tập Trắc nghiệm Hóa 12 - Kết nối tri thức - Xem ngay
Các bài khác cùng chuyên mục
- Lý thuyết Một số tính chất và ứng dụng của phức chất - Hóa 12 Kết nối tri thức
- Lý thuyết Sơ lược về phức chất - Hóa 12 Kết nối tri thức
- Lý thuyết Đại cương về kim loại chuyển tiếp dãy thứ nhất - Hóa 12 Kết nối tri thức
- Lý thuyết Nguyên tố nhóm IIA - Hóa 12 Kết nối tri thức
- Lý thuyết Nguyên tố nhóm IA - Hóa 12 Kết nối tri thức
- Lý thuyết Một số tính chất và ứng dụng của phức chất - Hóa 12 Kết nối tri thức
- Lý thuyết Sơ lược về phức chất - Hóa 12 Kết nối tri thức
- Lý thuyết Đại cương về kim loại chuyển tiếp dãy thứ nhất - Hóa 12 Kết nối tri thức
- Lý thuyết Nguyên tố nhóm IIA - Hóa 12 Kết nối tri thức
- Lý thuyết Nguyên tố nhóm IA - Hóa 12 Kết nối tri thức













Danh sách bình luận