Đề tham khảo thi THPT môn Hóa - Đề số 2 (hay, chi tiết)
Phức chất đơn giản thường có một
Đề bài
“Phức chất đơn giản thường có một …(1)… liên kết với các phối tử bao quanh. Liên kết giữa nguyên tử trung tâm và phối tử trong phức chất là liên kết …(2)…”. Nội dung phù hợp trong các ô trống (1), (2) lần lượt là
-
A.
Cation kim loại
-
B.
nguyên tử kim loại, cho – nhận
-
C.
nguyên tử trung tâm, cho – nhận
-
D.
phối tử, ion
Một số hợp chất của nguyên tố nhóm IIA có thể được sử dụng để điều trị chứng khó tiêu do acid hoặc để trung hòa đất chua. Hợp chất nhóm 2 nào sẽ không phù hợp cho cả hai mục đích sử dụng?
-
A.
Ca(OH)2.
-
B.
BaSO4.
-
C.
Mg(OH)2.
-
D.
CaCO3.
Những polymer nào sau đây thuộc loại polymer thiên nhiên?
-
A.
Polycaprolactam, polystyrene, tinh bột và cellulose.
-
B.
Tơ tằm, tinh bột và cellulose.
-
C.
Polycaprolactam, polystyrene.
-
D.
Polycaprolactam, tinh bột, cellulose.
Thực hiện các thí nghiệm sau:
a) Thả dây kẽm vào dung dịch HCl.
b) Thả đinh sắt vào dung dịch Fe2(SO4)3
c) Thả dây kẽm vào dung dịch Cu(NO3)2
d) Đốt dây sắt trong bình chứa đầy khí O2
e) Nối một dây đồng với một dây sắt rồi để trong không khí ẩm
f) Thả đinh sắt vào dung dịch chứa đồng thời CuSO4 và H2SO4 loãng
Số thí nghiệm xảy ra hiện tượng ăn mòn điện hóa là
-
A.
5
-
B.
2
-
C.
3
-
D.
4
Trên bao bì của một loại phân bón hỗn hợp NPK có ghi số 16 - 16 - 8. Trong 50,0 kg phân bón trên có chứa khối lượng của các nguyên tố N, P, K lần lượt là (kết quả làm tròn đến chữ số thập phân thứ 2)
-
A.
8,00 kg; 3,59 kg; 3,32 kg.
-
B.
8,00 kg; 8,00 kg; 4,00 kg.
-
C.
8,00 kg; 3,59 kg; 3,30 kg.
-
D.
8,00 kg; 3,49 kg; 3,32 kg.
Trong một cốc nước chứa 0,01 mol K+; 0,03 mol Ca2+; 0,02 mol Mg2+; 0,04 mol HCO3- và 0,02 mol Cl-. Đun sôi cốc nước hồi lâu, nước thu được là
-
A.
nước cứng tạm thời
-
B.
nước cứng vĩnh cửu
-
C.
nước mềm
-
D.
nước cứng toàn phần
Cầu chì là một phần tử hay thiết bị bảo vệ mạch điện bằng cách làm đứt mạch điện. Cầu chì được sử dụng nhằm phòng tránh các hiện tượng quá tải trên đường dây. Dây cầu chì thường được làm kim loại chì (Pb), thiếc trắng (Sn) hoặc cadmium (Cd).

Hình ảnh một số loại cầu chì dùng trong hệ thống điện dân dụng và công nghiệp
Ứng dụng này dựa trên tính chất nào của các kim loại trên?
-
A.
Có tính dẻo cao.
-
B.
Có độ dẫn điện cao.
-
C.
Có nhiệt độ nóng chảy tương đối thấp.
-
D.
Có độ cứng tương đối thấp.
Nước thải công nghiệp thường chứa các ion kim loại nặng như Hg2+, Pb2+, Fe3+. Để xử lí sơ bộ và làm giảm nồng độ các ion kim loại nặng với chi phí thấp, người ta sử dụng dung dịch chất nào sau đây?
-
A.
NH3
-
B.
NaCl
-
C.
Ca(OH)2
-
D.
H2SO4
Dựa vào phổ IR của hợp chất X có công thức CH3CH(OH)CH3 dưới đây, hãy chỉ ra peak nào giúp dự đoán X có nhóm -OH?
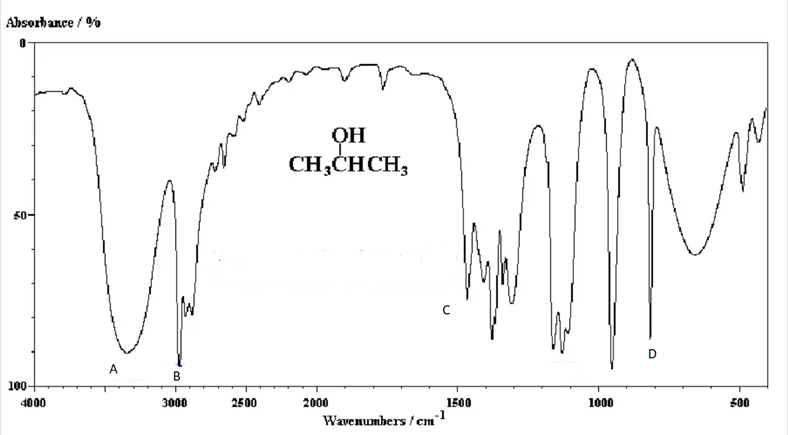
-
A.
A
-
B.
B
-
C.
C
-
D.
D
Methyl acrylate là một chất kích thích mạnh, có thể gây chóng mặt, đau đầu, hoa mắt và khó thở khi tiếp xúc với da hoặc hít phải. Ester này có công thức cấu tạo thu gọn là
-
A.
CH3COOC2H5.
-
B.
CH3COOCH3.
-
C.
C2H5COOCH3.
-
D.
CH2=CHCOOCH3
Cho các amine có công thức cấu tạo dưới đây:
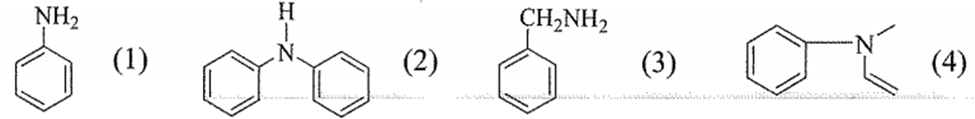
Trong các hợp chất trên, hợp chất nào thuộc loại arylamine bậc I?
-
A.
Chất (1).
-
B.
Chất (3).
-
C.
Chất (2).
-
D.
Chất (4).
Carbohydrate nào sau đây có nhiều trong mật ong?
-
A.
Glucose
-
B.
Fructose
-
C.
Saccharose
-
D.
Maltose
Nhỏ từ từ đến dư dung dịch methylamine vào ống nghiệm đựng dung dịch FeCl3. Khi đó thấy trong ống nghiệm
-
A.
có kết tủa màu nâu đỏ.
-
B.
thu được dung dịch màu xanh tím.
-
C.
thu được dung dịch màu xanh nhạt.
-
D.
ban đầu có kết tủa trắng, sau đó tan hết.
Cho một số nhận xét về carbohydrate như sau:
(1) Saccharose, tinh bột và cellulose đều có thể bị thuỷ phân.
(2) Glucose, fructose, saccharose đều tác dụng được với Cu(OH)2 và có khả năng tham gia phản ứng tráng bạc.
(3) Tinh bột và cellulose là đồng phân cấu tạo của nhau.
(4) Phân tử cellulose được cấu tạo bởi nhiều gốc β-glucose.
(5) Thuỷ phân tinh bột trong môi trường acid sinh ra fructose.
Trong các nhận xét trên, số nhận xét đúng là
-
A.
2
-
B.
4
-
C.
3
-
D.
5
Cho các peptide sau: Gly – Ala – Val – Glu (1); Gly – Gly (2); Lys – Val – Ala (3); Glu – Ala – Val – Lys (4). Những peptide nào có phản ứng tạo màu biuret với Cu(OH)2 trong môi trường kiềm?
-
A.
(1), (2)
-
B.
(2), (3) và (4)
-
C.
(1), (3) và (4)
-
D.
(3) và (4)
Cho biết giá trị thế điện cực chuẩn của các cặp oxi hoá - khử sau:
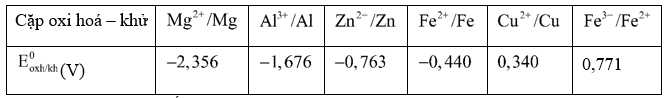
Kim loại nào sau đây khi lấy dư chỉ khử được Fe3+ trong dung dịch Fe(NO3)3 thành Fe2+?
-
A.
Zn.
-
B.
Al.
-
C.
Mg.
-
D.
Cu.
Phản ứng xảy ra khi sạc của một pin Li-ion là:
LiCoO2(s) + C6(s) → CoO2(s) + LiC6(s)
Để có được một pin điện có dung lượng là 4000 mAh thì khối lượng LiCoO2 tối thiểu trước khi sạc là bao nhiêu?
Cho biết: M LiCoO2 = 97,874 g/mol; 1 mol điện lượng là 96485 C và 1 C = 1A.s.
-
A.
16,724 g.
-
B.
15,285 g.
-
C.
14,607 g.
-
D.
13,562 g.
Cho các phát biểu sau:
(1) Dung dịch ethylamine và dung dịch aniline đều làm xanh giấy quỳ tím.
(2) Nhỏ từ từ đến dư dung dịch methylamine vào dung dịch copper(II) sulfate, ban đầu thấy xuất hiện kết tủa màu xanh nhạt, sau đó kết tủa tan tạo thành dung dịch màu xanh lam.
(3) Cho dung dịch methylamine vào ống nghiệm đựng dung dịch iron(III) chloride thấy xuất hiện kết tủa nâu đỏ.
(4) Nhỏ vài giọt dung dịch aniline vào ống nghiệm đựng nước bromine thấy xuất hiện kết tủa trắng.
Số phát biểu đúng là
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Alanine phản ứng với ethyl alcohol khi có mặt HCl khan theo sơ đồ sau:
Ala + C2H5OH + HCl → X + H2O
a) Trong phản ứng trên, nhóm – OH của –COOH (Ala) được thay thế bởi –OC2H5. Phản ứng này là phản ứng riêng của nhóm –COOH.
b) X thu được có công thức là: H2NCH(CH3)COOC2H5.
c) Phần trăm khối lượng nguyên tố nitrogen trong X là 8,16%.
d) 1 mol X tác dụng tối đa được với 2 mol NaOH thu được Ala.
Vào mùa mưa khí hậu ẩm ướt, đặc biệt ở các vùng mưa lũ dễ phát sinh một số bệnh như ghẻ nở. Người bị bệnh khi đó được khuyên nên bôi vào các vị trí ghẻ nở một loại thuốc thông dụng là DEP. Thuốc DEP có thành phần hoá học quan trọng là diethyl phtalate

a) Công thức cấu tạo thu gọn của diethyl phtalate là C6H4(COOC2H5)2
b) Cho 1 mol diethyl phtalate tác dụng vừa đủ với dung dịch NaOH thì dùng hết 2 mol NaOH.
c) Thủy phân hoàn toàn 1 mol diethyl phtalate trong môi trường acid thu được 1 mol acid C6H4(COOH)2 và 1 mol ethyl alcohol.
d) Phần trăm khối lượng nguyên tố carbon trong phân tử diethyl phtalate là 64,86%.
Tại nhà máy giấy Bãi Bằng có xưởng sản xuất xút - chlorine với công suất lớn nhất trong cả nước bằng phương pháp điện phân dung dịch NaCl với anode làm bằng than chì và cathode làm bằng sắt, giữa hai điện cực có màng ngăn xốp để ngăn không cho Cl2 tiếp xúc với OH-. Xút được dùng cho việc nấu bột giấy, chlorine dùng cho việc tẩy trắng bột giấy. Nước muối đi vào thùng điện phân có hàm lượng 316 g/L. Dung dịch thu được sau điện phân có chứa sodium hidroxide với hàm lượng 100 g/L. Giả sử muối ăn là tinh khiết, thể tích dung dịch điện phân không thay đổi.
a) Tại anode xảy ra sự khử Cl-, tại cathode xảy ra sự oxi hóa Na+.
b) Nếu không có màng ngăn giữa hai điện cực thì sản phẩm thu được nước gia-ven.
c) Hàm lượng muối ăn còn lại sau điện phân là 146,25 g/L.
d) Hiệu suất chuyển hoá muối trong thùng điện phân 46,28%.
Trong nước mưa acid thường có pH = 4 đến 5. pH thấp trong nước mưa acid chủ yếu là do có chứa các acid như HNO3, H2SO4. Trong tự nhiên, HNO3 còn được tạo ra từ N2 theo sơ đồ chuyển hóa:
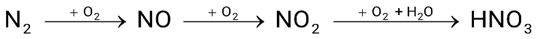
a) Trong thực tế để điều chế methyl formate từ acid và alcohol tương ứng người ta sử dụng HNO3 làm chất xúc tác.
b) HNO3 sinh ra từ quá trình trên sẽ cung cấp một lượng phân đạm cho cây trồng ở dạng NO3-.
c) Một cơn mưa acid, nước mưa có pH = 4 thì nồng độ HNO3 có trong nước mưa đó là 10-4M.
d) Dung dịch HNO3 có pH = 3 cần phải pha loãng 20 lần để thu được dung dịch HNO3 có pH = 5
Trong quá trình sản xuất nhôm bằng phương pháp điện phân nóng chảy aluminium oxide, điện cực dương bằng than chì bị ăn mòn liên tục do phản ứng giữa carbon và oxygen tạo thành hỗn hợp khí O2, CO, CO2. Giả sử các khí trong hỗn hợp trên có tỉ lệ mol bằng nhau, các phản ứng xảy ra hoàn toàn, mỗi kg nhôm sinh ra tương ứng với bao nhiêu kg than chì bị đốt cháy ở cực dương.
Đáp án:
Để xác định hàm lượng Fe2+ trong một lọ muối Mohr (có công thức (NH4)2SO4. FeSO4.6H2O) người ta tiến hành thí nghiệm như sau:
Cân 6,00 gam muối rồi hoà tan vào nước, thêm tiếp 5 mL dung dịch H2SO4 20% rồi cho nước cất vào để được 100 mL dung dịch (kí hiệu là dung dịch X). Lấy 10 mL dung dịch X đem chuẩn độ bằng dung dịch chuẩn KMnO4 0,03 M thì thấy hết 10 mL. Hàm lượng Fe2+ trong mẫu muối Mohr đem phân tích ở trên là bao nhiêu?
Đáp án:
Xà phòng hóa hoàn toàn triglyceride X trong dung dịch NaOH (vừa đủ); thu được sodium oleate và sodium stearate theo tỉ lệ mol tương ứng là 1 : 2. Phân tử khối của X là bao nhiêu?
Đáp án:
Cho phản ứng: CO(g) + Cl2(g) ⇌ COCl2(g) được thực hiện trong bình kín dung tích 1 lít ở nhiệt độ không đổi. Khi phản ứng đạt trạng thái cân bằng, nồng độ của các chất là: [CO] = 0,2M; [Cl2] = 0,1M; [COCl2] = 0,2M. Nếu bơm thêm vào bình 14,2 gam Cl2 thì nồng độ mol/L của CO ở trạng thái cân bằng mới là bao nhiêu? (kết quả làm tròn đến hàng phần trăm)
Đáp án:
Một mẫu cồn X (thành phần chính là ethanol) có lẫn methanol. Khi được đốt cháy hoàn toàn, 1 mol ethanol tỏa ra lượng nhiệt là 1370 kJ và 1 mol methanol tỏa ra lượng nhiệt là 716 kJ. Đốt cháy hoàn toàn 10 gam mẫu cồn X tỏa ra một nhiệt lượng là 291,9 kJ. Xác định thành phần phần trăm về khối lượng của tạp chất methanol trong mẫu cồn X. (kết quả làm tròn đến hàng đơn vị)
Đáp án:
Khi nhiệt độ tăng lên 10o, tốc độ của một phản ứng hóa học tăng lên 3 lần. Hỏi tốc độ của phản ứng đó tăng lên bao nhiêu lần khi nâng nhiệt độ lên từ 40oC đến 60oC?
Đáp án:
Lời giải và đáp án
“Phức chất đơn giản thường có một …(1)… liên kết với các phối tử bao quanh. Liên kết giữa nguyên tử trung tâm và phối tử trong phức chất là liên kết …(2)…”. Nội dung phù hợp trong các ô trống (1), (2) lần lượt là
-
A.
Cation kim loại
-
B.
nguyên tử kim loại, cho – nhận
-
C.
nguyên tử trung tâm, cho – nhận
-
D.
phối tử, ion
Đáp án : C
Dựa vào khái niệm của phức chất.
Phức chất đơn giản thường có một nguyên tử trung tâm liên kết với các phối tử bao quanh. Liên kết giữa nguyên tử trung tâm với phối tử trong phức chất là kiên kết cho – nhận.
Đáp án C
Một số hợp chất của nguyên tố nhóm IIA có thể được sử dụng để điều trị chứng khó tiêu do acid hoặc để trung hòa đất chua. Hợp chất nhóm 2 nào sẽ không phù hợp cho cả hai mục đích sử dụng?
-
A.
Ca(OH)2.
-
B.
BaSO4.
-
C.
Mg(OH)2.
-
D.
CaCO3.
Đáp án : B
Dựa vào ứng dụng của nguyên tố nhóm IIA.
BaSO4 không phù hợp cho cả 2 mục đích trên vì BaSO4 là kết tủa bền không tan trong acid thông thường hoặc dùng trung hòa đất chua.
Đáp án B
Những polymer nào sau đây thuộc loại polymer thiên nhiên?
-
A.
Polycaprolactam, polystyrene, tinh bột và cellulose.
-
B.
Tơ tằm, tinh bột và cellulose.
-
C.
Polycaprolactam, polystyrene.
-
D.
Polycaprolactam, tinh bột, cellulose.
Đáp án : B
Dựa vào nguồn gốc của polymer.
Tơ tằm, tinh bột và cellulose thuộc loại polymer thiên nhiên
Đáp án B
Thực hiện các thí nghiệm sau:
a) Thả dây kẽm vào dung dịch HCl.
b) Thả đinh sắt vào dung dịch Fe2(SO4)3
c) Thả dây kẽm vào dung dịch Cu(NO3)2
d) Đốt dây sắt trong bình chứa đầy khí O2
e) Nối một dây đồng với một dây sắt rồi để trong không khí ẩm
f) Thả đinh sắt vào dung dịch chứa đồng thời CuSO4 và H2SO4 loãng
Số thí nghiệm xảy ra hiện tượng ăn mòn điện hóa là
-
A.
5
-
B.
2
-
C.
3
-
D.
4
Đáp án : B
Ăn mòn điện hóa xảy ra khi có 2 điện cực cùng nhúng vào một dung dịch.
a) xảy ra ăn mòn hóa học vì không đủ 2 điện cực.
b) xảy ra ăn mòn hóa học
c) xảy ra ăn mòn hóa học
d) xảy ra ăn mòn hóa học
e) xảy ra ăn mòn điện hóa
f) xảy ra ăn mòn điện hóa
Đáp án B
Trên bao bì của một loại phân bón hỗn hợp NPK có ghi số 16 - 16 - 8. Trong 50,0 kg phân bón trên có chứa khối lượng của các nguyên tố N, P, K lần lượt là (kết quả làm tròn đến chữ số thập phân thứ 2)
-
A.
8,00 kg; 3,59 kg; 3,32 kg.
-
B.
8,00 kg; 8,00 kg; 4,00 kg.
-
C.
8,00 kg; 3,59 kg; 3,30 kg.
-
D.
8,00 kg; 3,49 kg; 3,32 kg.
Đáp án : D
Dựa vào thành phần % các loại nguyên tố trong phân bón
%N = 16% → mN = 50.16% = 8kg
%P2O5 =16% → m P2O5 = 50.16% = 8kg → m P = \(\frac{8}{{142}}.2.31 = 3,49kg\)
%K2O = 8% → m K2O = 50.8% = 4kg → m K = \(\frac{4}{{94}}.2.39 = 3,32kg\)
Đáp án D
Trong một cốc nước chứa 0,01 mol K+; 0,03 mol Ca2+; 0,02 mol Mg2+; 0,04 mol HCO3- và 0,02 mol Cl-. Đun sôi cốc nước hồi lâu, nước thu được là
-
A.
nước cứng tạm thời
-
B.
nước cứng vĩnh cửu
-
C.
nước mềm
-
D.
nước cứng toàn phần
Đáp án : B
Khi đun sôi ion HCO3- sẽ bị phân hủy, từ đó xác định lại số mol của ion Ca2+ và Mg2+
\(2HCO_3^ - \to CO_3^{2 - } + C{O_2} + {H_2}{\rm{O}}\)
0,04 → 0,02
Ca2+ và Mg2+ tạo kết tủa với CO3-, phản ứng còn dư Ca2+
Vậy sau khi đun cốc nước hồi lâu, nước thu được là nước cững vĩnh cửu do có ion Ca2+, Cl-
Đáp án B
Cầu chì là một phần tử hay thiết bị bảo vệ mạch điện bằng cách làm đứt mạch điện. Cầu chì được sử dụng nhằm phòng tránh các hiện tượng quá tải trên đường dây. Dây cầu chì thường được làm kim loại chì (Pb), thiếc trắng (Sn) hoặc cadmium (Cd).

Hình ảnh một số loại cầu chì dùng trong hệ thống điện dân dụng và công nghiệp
Ứng dụng này dựa trên tính chất nào của các kim loại trên?
-
A.
Có tính dẻo cao.
-
B.
Có độ dẫn điện cao.
-
C.
Có nhiệt độ nóng chảy tương đối thấp.
-
D.
Có độ cứng tương đối thấp.
Đáp án : C
Dựa vào tính chất vật lí của kim loại.
Dây cầu chì cần có nhiệt độ nóng chảy thấp để tránh các hiện tượng quá tải đường dây
Đáp án C
Nước thải công nghiệp thường chứa các ion kim loại nặng như Hg2+, Pb2+, Fe3+. Để xử lí sơ bộ và làm giảm nồng độ các ion kim loại nặng với chi phí thấp, người ta sử dụng dung dịch chất nào sau đây?
-
A.
NH3
-
B.
NaCl
-
C.
Ca(OH)2
-
D.
H2SO4
Đáp án : C
Dựa vào tính chất hóa học của kim loại.
Dùng Ca(OH)2 để giảm nồn gđộ các ion kim loại. Do các ion kim loại tạo kết tủa với ion – OH
Đáp án C
Dựa vào phổ IR của hợp chất X có công thức CH3CH(OH)CH3 dưới đây, hãy chỉ ra peak nào giúp dự đoán X có nhóm -OH?

-
A.
A
-
B.
B
-
C.
C
-
D.
D
Đáp án : A
Dựa vào tín hiệu đặc trưng của nhóm chức – OH
Nhóm chức – OH có tín hiệu đặc trưng ở vùng 3500 – 3200 cm-1
Vậy peak A có thể dự đoán X có nhóm – OH
Đáp án A
Methyl acrylate là một chất kích thích mạnh, có thể gây chóng mặt, đau đầu, hoa mắt và khó thở khi tiếp xúc với da hoặc hít phải. Ester này có công thức cấu tạo thu gọn là
-
A.
CH3COOC2H5.
-
B.
CH3COOCH3.
-
C.
C2H5COOCH3.
-
D.
CH2=CHCOOCH3
Đáp án : D
Dựa vào tên gọi của ester.
Methyl acrylate có công thức cấu tạo thu gọn là: CH2 = CHCOOCH3
Đáp án D
Cho các amine có công thức cấu tạo dưới đây:

Trong các hợp chất trên, hợp chất nào thuộc loại arylamine bậc I?
-
A.
Chất (1).
-
B.
Chất (3).
-
C.
Chất (2).
-
D.
Chất (4).
Đáp án : A
Acryamine là amine có nhóm – NH2 liên kết trực tiếp với vòng benzene.
Chất (1) thuộc loại acrylamine bậc I
Đáp án A
Carbohydrate nào sau đây có nhiều trong mật ong?
-
A.
Glucose
-
B.
Fructose
-
C.
Saccharose
-
D.
Maltose
Đáp án : B
Dựa vào trạng thái tự nhiên của carbohydrate.
Fructose có nhiều trong mật ong, khoảng 40%.
Đáp án B
Nhỏ từ từ đến dư dung dịch methylamine vào ống nghiệm đựng dung dịch FeCl3. Khi đó thấy trong ống nghiệm
-
A.
có kết tủa màu nâu đỏ.
-
B.
thu được dung dịch màu xanh tím.
-
C.
thu được dung dịch màu xanh nhạt.
-
D.
ban đầu có kết tủa trắng, sau đó tan hết.
Đáp án : A
Dựa vào tính chất hóa học của amine
Khi nhỏ từ từ đến dư dung dịch methylamine vào ống nghiệm đựng dung dịch FeCl3 trong ống nghiệm xuất hiện kết tủa nâu đỏ theo phản ứng:
FeCl3 + 3CH3NH2 + H2O → Fe(OH)3 + 3CH3NH3Cl
Đáp án A
Cho một số nhận xét về carbohydrate như sau:
(1) Saccharose, tinh bột và cellulose đều có thể bị thuỷ phân.
(2) Glucose, fructose, saccharose đều tác dụng được với Cu(OH)2 và có khả năng tham gia phản ứng tráng bạc.
(3) Tinh bột và cellulose là đồng phân cấu tạo của nhau.
(4) Phân tử cellulose được cấu tạo bởi nhiều gốc β-glucose.
(5) Thuỷ phân tinh bột trong môi trường acid sinh ra fructose.
Trong các nhận xét trên, số nhận xét đúng là
-
A.
2
-
B.
4
-
C.
3
-
D.
5
Đáp án : A
Dựa vào cấu tạo và tính chất hóa học của carbohydrate.
(1) đúng
(2) sai, saccharose không tham gia phản ứng tráng bạc
(3) sai, tinh bột và cellulose khác nhau về công thức phân tử.
(4) đúng
(5) sai, thủy phân tinh bột trong môi trường acid thu được glucose
Đáp án A
Cho các peptide sau: Gly – Ala – Val – Glu (1); Gly – Gly (2); Lys – Val – Ala (3); Glu – Ala – Val – Lys (4). Những peptide nào có phản ứng tạo màu biuret với Cu(OH)2 trong môi trường kiềm?
-
A.
(1), (2)
-
B.
(2), (3) và (4)
-
C.
(1), (3) và (4)
-
D.
(3) và (4)
Đáp án : C
Từ tripeptide trở lên có phản ứng tạo màu biuret với Cu(OH)2 trong môi trường kiềm.
(1), (3), (4) có phản ứng tạo màu biuret với Cu(OH)2 trong môi trường kiềm.
Đáp án C
Cho biết giá trị thế điện cực chuẩn của các cặp oxi hoá - khử sau:

Kim loại nào sau đây khi lấy dư chỉ khử được Fe3+ trong dung dịch Fe(NO3)3 thành Fe2+?
-
A.
Zn.
-
B.
Al.
-
C.
Mg.
-
D.
Cu.
Đáp án : D
Dựa vào ý nghĩa của thế điện cực của kim loại
Ta thấy cặp Fe2+/Fe và Cu2+/Cu đều khử được Fe3+ thành Fe2+
Đáp án D
Phản ứng xảy ra khi sạc của một pin Li-ion là:
LiCoO2(s) + C6(s) → CoO2(s) + LiC6(s)
Để có được một pin điện có dung lượng là 4000 mAh thì khối lượng LiCoO2 tối thiểu trước khi sạc là bao nhiêu?
Cho biết: M LiCoO2 = 97,874 g/mol; 1 mol điện lượng là 96485 C và 1 C = 1A.s.
-
A.
16,724 g.
-
B.
15,285 g.
-
C.
14,607 g.
-
D.
13,562 g.
Đáp án : C
Dựa vào công thức tính số điện lượng = \(\frac{{m.t}}{C}\)
Số điện lượng là: \(\frac{{{{4000.10}^{ - 3}}.3600}}{{96485}} = 0,149mol\)
Khối lượng LiCoO2 tối thiểu trước khi sạc là: 0,149.97,874 = 14,607g
Đáp án C
Cho các phát biểu sau:
(1) Dung dịch ethylamine và dung dịch aniline đều làm xanh giấy quỳ tím.
(2) Nhỏ từ từ đến dư dung dịch methylamine vào dung dịch copper(II) sulfate, ban đầu thấy xuất hiện kết tủa màu xanh nhạt, sau đó kết tủa tan tạo thành dung dịch màu xanh lam.
(3) Cho dung dịch methylamine vào ống nghiệm đựng dung dịch iron(III) chloride thấy xuất hiện kết tủa nâu đỏ.
(4) Nhỏ vài giọt dung dịch aniline vào ống nghiệm đựng nước bromine thấy xuất hiện kết tủa trắng.
Số phát biểu đúng là
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Đáp án : C
Dựa vào tính chất hóa học của amine
(1) sai, aniline không làm đổi màu quỳ tím
(2) đúng
(3) đúng
(4) đúng
Đáp án C
Alanine phản ứng với ethyl alcohol khi có mặt HCl khan theo sơ đồ sau:
Ala + C2H5OH + HCl → X + H2O
a) Trong phản ứng trên, nhóm – OH của –COOH (Ala) được thay thế bởi –OC2H5. Phản ứng này là phản ứng riêng của nhóm –COOH.
b) X thu được có công thức là: H2NCH(CH3)COOC2H5.
c) Phần trăm khối lượng nguyên tố nitrogen trong X là 8,16%.
d) 1 mol X tác dụng tối đa được với 2 mol NaOH thu được Ala.
a) Trong phản ứng trên, nhóm – OH của –COOH (Ala) được thay thế bởi –OC2H5. Phản ứng này là phản ứng riêng của nhóm –COOH.
b) X thu được có công thức là: H2NCH(CH3)COOC2H5.
c) Phần trăm khối lượng nguyên tố nitrogen trong X là 8,16%.
d) 1 mol X tác dụng tối đa được với 2 mol NaOH thu được Ala.
Dựa vào công thức phân tử của amino acid.
a) đúng
b) sai, X có công thức là: ClH3NCH(CH3)COOC2H5
c) sai, %N trong X là 9,12%
d) sai, 1 mol X phản ứng với 2 mol NaOH thu được muối Ala – Na.
Vào mùa mưa khí hậu ẩm ướt, đặc biệt ở các vùng mưa lũ dễ phát sinh một số bệnh như ghẻ nở. Người bị bệnh khi đó được khuyên nên bôi vào các vị trí ghẻ nở một loại thuốc thông dụng là DEP. Thuốc DEP có thành phần hoá học quan trọng là diethyl phtalate

a) Công thức cấu tạo thu gọn của diethyl phtalate là C6H4(COOC2H5)2
b) Cho 1 mol diethyl phtalate tác dụng vừa đủ với dung dịch NaOH thì dùng hết 2 mol NaOH.
c) Thủy phân hoàn toàn 1 mol diethyl phtalate trong môi trường acid thu được 1 mol acid C6H4(COOH)2 và 1 mol ethyl alcohol.
d) Phần trăm khối lượng nguyên tố carbon trong phân tử diethyl phtalate là 64,86%.
a) Công thức cấu tạo thu gọn của diethyl phtalate là C6H4(COOC2H5)2
b) Cho 1 mol diethyl phtalate tác dụng vừa đủ với dung dịch NaOH thì dùng hết 2 mol NaOH.
c) Thủy phân hoàn toàn 1 mol diethyl phtalate trong môi trường acid thu được 1 mol acid C6H4(COOH)2 và 1 mol ethyl alcohol.
d) Phần trăm khối lượng nguyên tố carbon trong phân tử diethyl phtalate là 64,86%.
Dựa vào công thức cấu tạo của diethyl phtalate
a) đúng
b) đúng
c) sai, thu được 2 mol ethyl alcohol
d) đúng
Tại nhà máy giấy Bãi Bằng có xưởng sản xuất xút - chlorine với công suất lớn nhất trong cả nước bằng phương pháp điện phân dung dịch NaCl với anode làm bằng than chì và cathode làm bằng sắt, giữa hai điện cực có màng ngăn xốp để ngăn không cho Cl2 tiếp xúc với OH-. Xút được dùng cho việc nấu bột giấy, chlorine dùng cho việc tẩy trắng bột giấy. Nước muối đi vào thùng điện phân có hàm lượng 316 g/L. Dung dịch thu được sau điện phân có chứa sodium hidroxide với hàm lượng 100 g/L. Giả sử muối ăn là tinh khiết, thể tích dung dịch điện phân không thay đổi.
a) Tại anode xảy ra sự khử Cl-, tại cathode xảy ra sự oxi hóa Na+.
b) Nếu không có màng ngăn giữa hai điện cực thì sản phẩm thu được nước gia-ven.
c) Hàm lượng muối ăn còn lại sau điện phân là 146,25 g/L.
d) Hiệu suất chuyển hoá muối trong thùng điện phân 46,28%.
a) Tại anode xảy ra sự khử Cl-, tại cathode xảy ra sự oxi hóa Na+.
b) Nếu không có màng ngăn giữa hai điện cực thì sản phẩm thu được nước gia-ven.
c) Hàm lượng muối ăn còn lại sau điện phân là 146,25 g/L.
d) Hiệu suất chuyển hoá muối trong thùng điện phân 46,28%.
Dựa vào ứng dụng của điện phân.
a) Sai. Tại anode xảy ra sự oxi hoá Cl-, tại cathode xảy ra sự khử H2O
b) Đúng. Nếu không có màng ngăn giữa hai điện cực thì sản phẩm thu được nước gia-ven.
2 NaOH + Cl2 → NaCl + NaClO + H2O
c) Sai
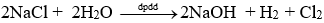
Trong một lít dung dịch chứa
nNaOH = 100 : 40 = 2,5 mol = nNaCl → mNaCl phản ứng = 2,5.58,5 = 146,25 gam
→mNaCl dư = 316 −146,25 = 169,75 gam
Vậy hàm lượng muối ăn còn lại là 169,75 gam/ lít
d) Đúng. HIệu suất phản ứng H % = 146,25 : 316 = 46,28%
Trong nước mưa acid thường có pH = 4 đến 5. pH thấp trong nước mưa acid chủ yếu là do có chứa các acid như HNO3, H2SO4. Trong tự nhiên, HNO3 còn được tạo ra từ N2 theo sơ đồ chuyển hóa:
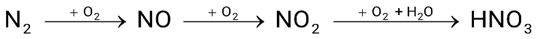
a) Trong thực tế để điều chế methyl formate từ acid và alcohol tương ứng người ta sử dụng HNO3 làm chất xúc tác.
b) HNO3 sinh ra từ quá trình trên sẽ cung cấp một lượng phân đạm cho cây trồng ở dạng NO3-.
c) Một cơn mưa acid, nước mưa có pH = 4 thì nồng độ HNO3 có trong nước mưa đó là 10-4M.
d) Dung dịch HNO3 có pH = 3 cần phải pha loãng 20 lần để thu được dung dịch HNO3 có pH = 5
a) Trong thực tế để điều chế methyl formate từ acid và alcohol tương ứng người ta sử dụng HNO3 làm chất xúc tác.
b) HNO3 sinh ra từ quá trình trên sẽ cung cấp một lượng phân đạm cho cây trồng ở dạng NO3-.
c) Một cơn mưa acid, nước mưa có pH = 4 thì nồng độ HNO3 có trong nước mưa đó là 10-4M.
d) Dung dịch HNO3 có pH = 3 cần phải pha loãng 20 lần để thu được dung dịch HNO3 có pH = 5
Dựa vào sơ đồ điều chế HNO3
a) sai, người ta sử dụng H2SO4 đặc làm chất xúc tác
b) đúng
c) đúng
d) sai
Ta có pH = 3 → [H+] = 10-3 → n H+ = 10-3 .V1
pH = 5 → [H+] = 10-5 → n H+ = 10-3 .V2
→ 10-3.V1 = 10-5.V2 → V2 = 100V1
Vậy cần pha loãng 100 lần.
Trong quá trình sản xuất nhôm bằng phương pháp điện phân nóng chảy aluminium oxide, điện cực dương bằng than chì bị ăn mòn liên tục do phản ứng giữa carbon và oxygen tạo thành hỗn hợp khí O2, CO, CO2. Giả sử các khí trong hỗn hợp trên có tỉ lệ mol bằng nhau, các phản ứng xảy ra hoàn toàn, mỗi kg nhôm sinh ra tương ứng với bao nhiêu kg than chì bị đốt cháy ở cực dương.
Đáp án:
Đáp án:
Dựa vào phương pháp tách kim loại.
Gọi số mol O2 dùng để đốt cháy carbon là x k.mol
Ta có: \({n_{{O_2}}} = {n_{CO}} = {n_{C{O_2}}} = x{\rm{ kmoL}} \Rightarrow {{\rm{n}}_{{O_2}{\rm{ bd}}}} = {n_{{O_2}}} + \frac{1}{2}{n_{CO}} + {n_{C{O_2}}} = 2,5x{\rm{ kmoL}}\)
Phản ứng điện phân Al2O3 là:
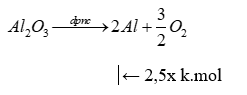
\( \Rightarrow {n_{Al}} = \frac{{10x}}{3}kmoL \Rightarrow \frac{{10x}}{3} = \frac{1}{{27}} \Rightarrow x = \frac{1}{{90}}\)
Khối lượng C= \(12 \times 2x = 12 \times 2.\frac{1}{{90}} = 0,267{\rm{ kg}} \approx 0,27{\rm{ kg}}\)
Để xác định hàm lượng Fe2+ trong một lọ muối Mohr (có công thức (NH4)2SO4. FeSO4.6H2O) người ta tiến hành thí nghiệm như sau:
Cân 6,00 gam muối rồi hoà tan vào nước, thêm tiếp 5 mL dung dịch H2SO4 20% rồi cho nước cất vào để được 100 mL dung dịch (kí hiệu là dung dịch X). Lấy 10 mL dung dịch X đem chuẩn độ bằng dung dịch chuẩn KMnO4 0,03 M thì thấy hết 10 mL. Hàm lượng Fe2+ trong mẫu muối Mohr đem phân tích ở trên là bao nhiêu?
Đáp án:
Đáp án:
Dựa vào quá trình chuẩn độ iron.
Phương trình chuẩn độ :
n KMnO4 = 10.10-3.0,03 = 3.10-4 mol
→\({n_{F{e^{2 + }}{\rm{ trong 10mL}}}} = 5{n_{MnO_4^ - }} = 5 \times 0,01 \times 0,03 = 1,{5.10^{ - 3}}{\rm{moL}}\)\( \Rightarrow {n_{F{e^{2 + }}{\rm{ trong 100 mL}}}} = 1,{5.10^{ - 3}}{\rm{.10 = 0,015 moL}}\)
Hàm lượng Fe2+ trong mẫu muối Mohr đem phân tích = \(\frac{{56 \times 0,015}}{6}.100\% = 14\% \)
Xà phòng hóa hoàn toàn triglyceride X trong dung dịch NaOH (vừa đủ); thu được sodium oleate và sodium stearate theo tỉ lệ mol tương ứng là 1 : 2. Phân tử khối của X là bao nhiêu?
Đáp án:
Đáp án:
Dựa vào tính chất hóa học của chất béo
Công thức phân tử X là: [(17H33COO)(C17H35COO)2]C3H5
Phân tử khối X là: 888 amu
Cho phản ứng: CO(g) + Cl2(g) ⇌ COCl2(g) được thực hiện trong bình kín dung tích 1 lít ở nhiệt độ không đổi. Khi phản ứng đạt trạng thái cân bằng, nồng độ của các chất là: [CO] = 0,2M; [Cl2] = 0,1M; [COCl2] = 0,2M. Nếu bơm thêm vào bình 14,2 gam Cl2 thì nồng độ mol/L của CO ở trạng thái cân bằng mới là bao nhiêu? (kết quả làm tròn đến hàng phần trăm)
Đáp án:
Đáp án:
Dựa vào hằng số cân bằng KC
KC = \(\frac{{{\rm{[}}CoC{l_2}]}}{{{\rm{[}}CO]{\rm{[}}C{l_2}]}} = \frac{{0,2}}{{0,2.0,1}} = 10\)
n Cl2 thêm vào = 14,2 : 71 = 0,2 mol
CO(g) + Cl2(g) ⇌ COCl2(g)
Trước phản ứng: 0,1 0,3 0,2
Phản ứng: x x x
Cân bằng: 0,1 – x 0,3 – x 0,2 + x
KC = \(\frac{{{\rm{[}}CoC{l_2}]}}{{{\rm{[}}CO]{\rm{[}}C{l_2}]}} = \frac{{0,2 + x}}{{(0,1 - x).(0,3 - x)}} = 10 \to x = 0,021\)
[CO] cân bằng = 0,1 – 0,021 = 0,079M ≈ 0,08M
Một mẫu cồn X (thành phần chính là ethanol) có lẫn methanol. Khi được đốt cháy hoàn toàn, 1 mol ethanol tỏa ra lượng nhiệt là 1370 kJ và 1 mol methanol tỏa ra lượng nhiệt là 716 kJ. Đốt cháy hoàn toàn 10 gam mẫu cồn X tỏa ra một nhiệt lượng là 291,9 kJ. Xác định thành phần phần trăm về khối lượng của tạp chất methanol trong mẫu cồn X. (kết quả làm tròn đến hàng đơn vị)
Đáp án:
Đáp án:
Dựa vào tỉ lệ mol của ethanol và methanol
Gọi số mol methanol và ethanol lần lượt là a và b mol
Ta có: m X = m methanol + m ethanol = 32a + 46b = 10 (1)
Nhiệt lượng tỏa ra khi đốt cháy X là: a.716 + b.1370 = 291,9 (2)
Từ (1) và (2) ta có: a =0,025; b = 0,2 mol
%m CH3OH = \(\frac{{32.0,025}}{{10}}.100\% = 8\% \)
Khi nhiệt độ tăng lên 10o, tốc độ của một phản ứng hóa học tăng lên 3 lần. Hỏi tốc độ của phản ứng đó tăng lên bao nhiêu lần khi nâng nhiệt độ lên từ 40oC đến 60oC?
Đáp án:
Đáp án:
Dựa vào hệ số nhiệt độ Van’t Hoff
\(\frac{{{v_2}}}{{{v_1}}} = {\gamma ^{\frac{{T2 - T1}}{{10}}}}\)
Khi nhiệt độ tăng lên 10o, tốc độ của một phản ứng hóa học tăng lên 3 lần → Hệ số nhiệt độ Van’t Hoff = 3
Thay vào công thức ta có: \(\frac{{{v_2}}}{{{v_1}}} = {3^{\frac{{60 - 40}}{{10}}}} = 9\)
Khi thay thế nhóm …(1) ở nhóm …(2) của carboxylic acid bằng nhóm
Hợp chất nào sau đây là ester ?
Trong ăn mòn hóa học, phản ứng hóa học xảy ra là loại phản ứng nào sau đây?
Kim loại cứng nhất, thường được pha vào thép để tăng độ cứng và khả năng chống gỉ cho thép là
Phần I. Trắc nghiệm nhiều đáp án lựa chọn
Ở trạng thái cơ bản, cấu hình electron của nguyên tử Be (Z = 4) là
Quá trình tạo thành ion Ca2+ nào sau đây là đúng?
Kim loại X được sử dụng trong nhiệt kế, áp kế và một số thiết bị khác. Ở điều kiện thường, X là chất lỏng. Kim loại X là
Cho phản ứng oxi hóa – khử:
Các bài khác cùng chuyên mục









Danh sách bình luận