Đề thi thử THPT môn Hóa lần 1 năm 2025 Trường THPT Chuyên Hạ Long (Quảng Ninh)
Tinh bột chứa hỗn hợp chất nào sau đây?
Đề bài
Tinh bột chứa hỗn hợp chất nào sau đây?
-
A.
Glucose và fructose
-
B.
Amylose và amylopectin.
-
C.
Glucose và galactose.
-
D.
Amylose và cellulose.
Dung dịch nào sau đây có pH > 7?
-
A.
NaOH
-
B.
NaCl.
-
C.
CH3COOH.
-
D.
H2SO4.
Có thể dùng tối đa bao nhiêu cách trong các cách sau đây để dập tắt đám cháy xăng dầu?
(a) Dùng chăn thấm ướt; (b) Dùng cát;
(c) Dùng bình carbon dioxide; (d) Dùng nước;
(e) Dùng bình bột khô ABC; (g) Dùng bình chữa cháy dạng bọt;
-
A.
6
-
B.
4
-
C.
5
-
D.
3
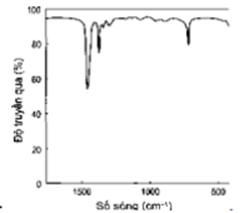
Phổ hồng ngoại cho biết các tín hiệu ở các số sóng khác nhau. Cho biết tín hiệu nào đặc trưng của nhóm chứa alcohol?
-
A.

-
B.

-
C.
-
D.
Pin điện hóa Zn – C đã được sử dụng từ lâu. Pin Zn – C có giá rẻ phù hợp cho các thiết bị tiêu thụ ít điện năng như điều khiển tivi, đồng hồ treo tưởng, đèn pin, đồ chơi,…Tuy nhiên, điện trở trong của loại pin này lớn, không phù hợp cho các thiết bị như máy ảnh. Phát biểu nào sau đây là đúng?
-
A.
Khi pin này hoạt động thì không phát sinh dòng điện.
-
B.
Khi pin này hoạt động thì dòng electron chuyển từ cực dương sang cực âm.
-
C.
Khi pin này hoạt động thì Zn đóng vai trò cực âm, C đóng vai trò cực dương.
-
D.
Khi pin này hoạt động thì ở điện cực âm, anode xảy ra quá trình khử Zn.
Hợp chất nào dưới đây thuộc loại ester?
-
A.
HOCH2COCH3.
-
B.
CH3CH2COOCH3.
-
C.
CH3CH2CH2COOH.
-
D.
HOCH2CH2CHO.
Cho polymer có cấu tạo như sau: ( - HN – [CH2]6 – NHCO – [CH2]3 – CO - )n. Polymer trên được dùng sản xuất vật liệu polymer nào sau đây?
-
A.
Tơ.
-
B.
Cao su.
-
C.
Chất dẻo.
-
D.
Keo dán.
Một mẩu nước được thử nghiệm định tính để xác định sự có mặt của một số ion. Mẫu nước được cho vào 4 ống nghiệm, sau đó nhỏ mỗi loại thuốc thử vào mỗi ống nghiệm và ghi nhận hiện tượng như bảng dưới đây.

Mẫu nước trên có thể chứa những ion nào trong số các ion sau đây: (1) H+; (2) Ca2+; (3) Cl-; (4) HCO3-; (5) CO32-;?
-
A.
(1), (2), (3)
-
B.
(3), (4), (5)
-
C.
(2), (3), (5).
-
D.
(2), (3), (4).
Hằng ngày, cơ thể chúng ta cần cung cấp nhiều thực phẩm có nguồn gốc là carbohydrate như tinh bột, saccharose, glucose, fructose, cellulose (chất xơ),…Cho các phát biểu về các carbohydrate như sau:
a) Gluocse phản ứng với methanol khi có mặt HCl khan tạo thành methyl gluconate.
b) Cellulose và tinh bột đều là các polysaccharide có phân tử khối rất lớn, nhưng phân tử khối của cellulose lớn hơn nhiều so với tinh bột.
c) Amylopectin được cấu tạo từ nhiều đơn vị α – glucose liên kết với nhau qua liên kết α – 1,4 – glycoside và α – 1,6 – glycoside hình thành cấu trúc mạch phân nhánh.
d) Phân tử maltose có thể mở vòng trong dung dịch nước để tạo nhóm aldehyde trong khi saccharose không thể mở vòng được do không có nhóm – OH hemiacetal.
Số phát biểu đúng là
-
A.
2
-
B.
3
-
C.
4
-
D.
1
Sức điện động chuẩn của pin điện gồm hai điện cực M2+/M và Ag+/Ag bằng 0,936V, theo bảng sau:

Kim loại M là
-
A.
Cu.
-
B.
Fe.
-
C.
Ni.
-
D.
Sn.
Bradykinin là một peptide được sản sinh từ huyết thanh trong máu, là chất làm giãn mạch mạnh và gây co cơ trơn, chất trung gian gây ra tình trạng viêm. Công thức cấu tạo của bradykinin như hình dưới:
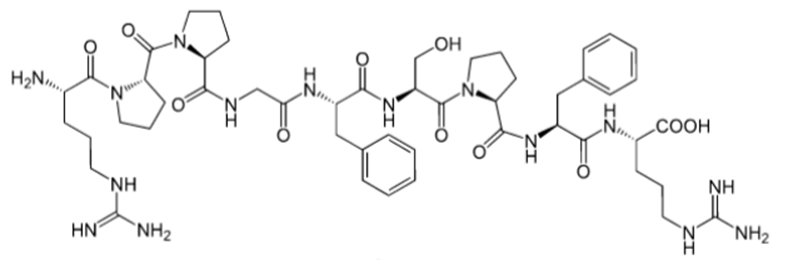
Thủy phân hoàn toàn 1 mol bradykinin thu được mấy loại amino acid khác nhau?
-
A.
4
-
B.
6
-
C.
5
-
D.
3
Phát biểu nào sau đây sai khi nói về enzyme?
-
A.
Phần lớn enzyme là những protein xúc tác cho các phản ứng hóa học và sinh hóa.
-
B.
Tốc độ phản ứng có xúc tác enzyme thường nhanh hơn nhiều lần so với xúc tác hóa học.
-
C.
Tốc độ phản ứng có xúc tác enzyme thường chậm hơn nhiều lần so với xúc tác hóa học.
-
D.
Enzyme có tính chọn lọc cao, mỗi enzyme chỉ xúc tác cho một hoặc một số phản ứng nhất định.
Ở điều kiện thường, trạng thái tồn tại của amino acid là:
-
A.
thể rắn.
-
B.
thể lỏng.
-
C.
thể rắn và lỏng.
-
D.
thể khí.
Cấu hình electron ở phân lớp ngoài cùng của ion R+ là 2p6. Nguyên tử R là:
-
A.
19K
-
B.
20Ca
-
C.
10Ne
-
D.
11Na.
-
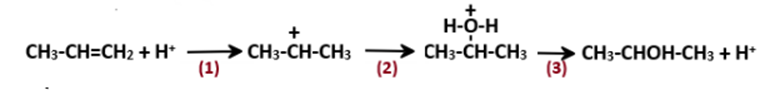
A.
Ở bước 1, quá trình proton hóa liên kết đôi C=C của propene tạo thành carbocation.
-
B.
Nếu thay H2O bằng HBr thì cơ chế phản ứng xảy ra tương tự.
-
C.
Ở bước 2, quá trình tách proton để tạo thành alcohol.
-
D.
Sản phẩm của phản ứng là sản phẩm chính theo quy tắc Markovnikov.
Cho phản ứng hóa học: Fe + CuSO4 → FeSO4 + Cu. Trong phản ứng trên xảy ra:
-
A.
sự oxi hóa Fe và sự khử Cu2+
-
B.
sự khử Fe2+ và sự khử Cu2+
-
C.
sự oxi hóa Fe và sự oxi hóa Cu.
-
D.
sự khử Fe2+ và sự oxi hóa Cu.
Nguyên tử nguyên tố R có số electron là 25, vị trí của R trong bảng tuần hoàn là:
-
A.
chu kì 4, phân nhóm VIIA.
-
B.
Chu kì 4, phân nhóm VIIB.
-
C.
chu kì 4, phân nhóm VB.
-
D.
chu kì 4, phân nhóm IIA.
Dung dịch nào sau đây xảy ra phản ứng với ethyl acetate?
-
A.
NaOH (to)
-
B.
C2H5OH
-
C.
[Ag(NH3)2]OH
-
D.
NaCl.
Một nhóm học sinh đã thực hiện phản ứng điều chế ethyl acetate từ nguyên liệu ban đầu là acetic acid và ethanol trong phòng thí nghiệm. Khi phản ứng kết thúc, nhóm đã thu được hỗn hợp sản phẩm gồm ethyl acetate và acetic acid, ethanol còn dư theo phương trình hóa học:
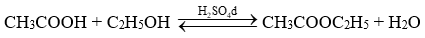
a) Phản ứng trên được gọi là phản ứng xà phòng hóa.
b) Vì ethyl acetate không phân cực, còn acetic acid và ethanol đều phân cực nên nhóm có thể dùng dung môi hữu cơ không phân cực diethyl ether (C2H5OC2H5) để chiết ethyl acetate ra khỏi hỗn hợp sau phản ứng.
c) Có thể thay dung dịch sulfuric acid đặc bằng dung dịch hydrochloric acid đặc.
d) Do diethyl ether có nhiệt độ sôi thấp hơn nhiều so với ethyl acetate (34,6oC so với 77,1oC) nên để thu được ethyl acetate có thể dùng nước nóng liên tục tưới lên bình cầu trong phương pháp chưng cất đơn giản để tách ethyl acetate ra khỏi dung môi diethyl ether sau khi chiết.
Trong công nghiệp sản xuất bia có các bước chính sau:
Hạt đại mạch → Dịch nấu (maltose, glucose) → Ethanol
a) Thành phần trong hạt đại mạch bị thủy phân tạo ra maltose, glucose là tinh bột.
b) Để biết được thời điểm kết thúc quá trình thủy phân tinh bột ta có thể kiểm tra bằng thuốc thử là dung dịch I2 trong KI.
c) Maltose và glucose thuộc nhóm monosaccharide, khi lên men thu được ethanol.
d) Sản phẩm thủy phân của tinh bột (hạt đại mạch), ngoài maltose và glucose còn thu được sản phẩm phụ là fructose.
Trong công nghiệp, xút (sodium hydroxide) được sản xuất bằng phương pháp điện phân dung dịch sodium chloride có màng ngăn xốp. Bằng phương pháp này, người ta cũng thu được khí chlorine. Chất khí này được làm khô (loại bỏ hơi nước) rồi hóa lỏng để làm nguyên liệu quan trọng cho nhiều ngành công nghiệp chế biến và sản xuất hóa chất.
Từ quá trình điện phân nêu trên, một lượng chlorine và hydrogen sinh ra được tận dụng để sản xuất hydrochloric acid đặc thương phẩm (37%, D = 1,19 g/ml ở 20oC)
Một nhà máy với quy mô sản xuất 200 tấn xút mỗi ngày thì đồng thời sản xuất được V m3 acid thương phẩm (ở 20oC). Biết rằng, tại nhà máy này, 60% khối lượng chlorine sinh ra được dùng tổng hợp hydrochloric acid và hiệu suất của toàn bộ quá trình từ chlorine đến acid thương phẩm là 80%
a) Có thể dùng sulfuric acid làm khô khí chlorine thoát ra.
b) Trong thí nghiệm điện phân Cl2 sẽ thoát ra ở cực cathode.
c) Nếu không sử dụng màng ngăn xốp thì phương trình điện phân dung dịch NaCl là: 2NaCl + 2H2O → 2NaOH + H2 + Cl2
d) Giá trị của V là 237 (làm tròn đến phần mười).
Trong bình kín có hệ cân bằng hóa học sau: CO2(g) + H2(g) ⥦CO(g) + H2O(g); \({\Delta _r}H_{298}^o > 0\)
Cho các phát biểu về sự tác động đến hệ cân bằng dưới đây, hãy xét tính đúng sai của các phát biểu đó.
a) Tăng nhiệt độ của hệ thì cân bằng chuyển dịch theo chiều thuận.
b) Thêm chất xúc tác thì cân bằng chuyển dịch theo chiều thuận.
c) Giảm áp suất chung của hệ thì cân bằng chuyển dịch theo chiều nghịch.
d) Nếu nồng độ ban đầu CO2 và H2 đều là 0,03M; tại cân bằng [CO] = 0,018M thì giá trị Kc là 1,5.
KMnO4 là chất oxi hóa thường dùng trong xác định nồng độ các chất khử trong phòng thí nghiệm nhưng KMnO4 thường chứa tạp chất nên có thể ảnh hưởng đến kết quả thí nghiệm. Để xác định nồng độ chuẩn của dung dịch KMnO4 có nồng độ x.10-2 (M) dùng dung dịch oxalic acid gốc theo các bước sau:
- Hòa tan hoàn toàn 0,505 gam oxalic acid ngậm nước H2C2O4.2H2O (M = 126,07) trong nước rồi pha thành 100ml dung dịch X.
- Chuẩn độ 10,00ml dung dịch X (trong môi trường sulfuric acid loãng, dư) bằng dung dịch KMnO4 trên đến khi xuất hiện màu hồng nhạt thì dừng. Cho biết oxalic acid bị KMnO4 oxi hóa thành CO2 và H2O trong môi trường acid.
- Lặp lại thí nghiệm chuẩn độ trên thêm 2 lần nước. Thể tích trung bình của dung dịch KMnO4 sau 3 lần chuẩn độ là 12,75ml.
Tính giá trị của x (làm tròn đáp án đến hàng phần mười).
Phương pháp
Đáp án:
Ở điều kiện chuẩn, cần phải đốt cháy hoàn toàn bao nhiêu gam methane CH₄(g) (làm tròn đến hàng phần trăm) để cung cấp nhiệt cho phản ứng tạo 1,5 mol CaO bằng cách nung CaCO₃. Giả thiết hiệu suất của quá trình đều là 100%. Phương trình nhiệt của phản ứng nung vôi và đốt cháy methane như sau:
(1) CaCO₃(s) → CaO(s) + CO₂(g)
(2) CH₄(g) + 2O₂(g) → CO₂(g) + 2H₂O(g)
Biết nhiệt tạo thành (\({\Delta _f}H_{298}^o\)) của các chất ở điều kiện chuẩn được cho trong bảng sau:

Đáp án:
Xà phòng hóa hoàn toàn 17,24 gam chất béo cần vừa đủ 0,06 mol NaOH. Cô cạn dung dịch sau phản ứng thu được khối lượng xà phòng là bao nhiêu gam? (làm tròn đáp án đến hàng đơn vị).
Đáp án:
Hòa tan m gam tinh thể CuSO₄.5H₂O vào nước thu được dung dịch X. Điện phân dung dịch X với điện cực trơ và cường độ dòng điện không đổi. Nếu thời gian điện phân là t (s) thì thu được kim loại Cu ở cathode và 208,236 mL khí tại anode. Nếu thời gian điện phân là 2t (s) thì thu được 713,952 mL khí. Biết thể tích các khí đo ở đkc. Tính giá trị của m (làm tròn đến hàng đơn vị).
Đáp án:
Fructose có công thức phân tử C₆H₁₂O₆. Tương tự glucose, fructose tồn tại đồng thời dạng mạch hở và mạch vòng (α và β). Ở dạng mạch vòng α-fructose, tổng số nhóm –OH hemicetal và –OH hemiketal trong phân tử fructose là bao nhiêu?
Đáp án:
Ứng với công thức phân tử C₆H₁₂O₂N có bao nhiêu chất vừa phản ứng được với dung dịch NaOH, vừa phản ứng được với dung dịch HCl?
Đáp án:
Lời giải và đáp án
Tinh bột chứa hỗn hợp chất nào sau đây?
-
A.
Glucose và fructose
-
B.
Amylose và amylopectin.
-
C.
Glucose và galactose.
-
D.
Amylose và cellulose.
Đáp án : B
Dựa vào cấu tạo của tinh bột.
Tinh bột chứa hỗn hợp amylose và amylopectin.
Đáp án B
Dung dịch nào sau đây có pH > 7?
-
A.
NaOH
-
B.
NaCl.
-
C.
CH3COOH.
-
D.
H2SO4.
Đáp án : B
Các dung dịch có môi trường base thì pH >7.
NaOH là dung dịch base nên có pH > 7.
Đáp án A
Có thể dùng tối đa bao nhiêu cách trong các cách sau đây để dập tắt đám cháy xăng dầu?
(a) Dùng chăn thấm ướt; (b) Dùng cát;
(c) Dùng bình carbon dioxide; (d) Dùng nước;
(e) Dùng bình bột khô ABC; (g) Dùng bình chữa cháy dạng bọt;
-
A.
6
-
B.
4
-
C.
5
-
D.
3
Đáp án : C
Dựa vào các biện pháp an toàn chống cháy nổ.
Xăng nhẹ hơn nước nên không thể dùng nước để dập tắt đám cháy. Các biện pháp còn lại đều sử dụng được.
Đáp án C
Phổ hồng ngoại cho biết các tín hiệu ở các số sóng khác nhau. Cho biết tín hiệu nào đặc trưng của nhóm chứa alcohol?
-
A.

-
B.

-
C.
-
D.

Đáp án : B
Nhóm – OH có số sóng đặc trưng ở vùng 3500 – 3200 cm-1 và có peak thoải.
Hình B có chứa nhóm – OH alcohol.
Đáp án B
Pin điện hóa Zn – C đã được sử dụng từ lâu. Pin Zn – C có giá rẻ phù hợp cho các thiết bị tiêu thụ ít điện năng như điều khiển tivi, đồng hồ treo tưởng, đèn pin, đồ chơi,…Tuy nhiên, điện trở trong của loại pin này lớn, không phù hợp cho các thiết bị như máy ảnh. Phát biểu nào sau đây là đúng?
-
A.
Khi pin này hoạt động thì không phát sinh dòng điện.
-
B.
Khi pin này hoạt động thì dòng electron chuyển từ cực dương sang cực âm.
-
C.
Khi pin này hoạt động thì Zn đóng vai trò cực âm, C đóng vai trò cực dương.
-
D.
Khi pin này hoạt động thì ở điện cực âm, anode xảy ra quá trình khử Zn.
Đáp án : C
Dựa vào nguyên tắc hoạt động của pin Galvani.
A. sai, khi hoạt động pin có phát sinh dòng điện.
B. sai, khi pin này hoạt động thì dòng electron chuyển từ cực âm sang cực dương.
C. đúng
D. sai, anode xảy ra quá trình oxi hóa Zn.
Đáp án C
Hợp chất nào dưới đây thuộc loại ester?
-
A.
HOCH2COCH3.
-
B.
CH3CH2COOCH3.
-
C.
CH3CH2CH2COOH.
-
D.
HOCH2CH2CHO.
Đáp án : B
Hợp chất ester có chứa nhóm chức – COO –.
CH3CH2COOCH3 thuộc hợp chất ester.
Đáp án B
Cho polymer có cấu tạo như sau: ( - HN – [CH2]6 – NHCO – [CH2]3 – CO - )n. Polymer trên được dùng sản xuất vật liệu polymer nào sau đây?
-
A.
Tơ.
-
B.
Cao su.
-
C.
Chất dẻo.
-
D.
Keo dán.
Đáp án : A
Dựa vào monomer của polymer.
( - HN – [CH2]6 – NHCO – [CH2]3 – CO - )n, monomer trên có chứa liên kết CONH – nên thường được sản xuất làm tơ.
Đáp án A
Một mẩu nước được thử nghiệm định tính để xác định sự có mặt của một số ion. Mẫu nước được cho vào 4 ống nghiệm, sau đó nhỏ mỗi loại thuốc thử vào mỗi ống nghiệm và ghi nhận hiện tượng như bảng dưới đây.

Mẫu nước trên có thể chứa những ion nào trong số các ion sau đây: (1) H+; (2) Ca2+; (3) Cl-; (4) HCO3-; (5) CO32-;?
-
A.
(1), (2), (3)
-
B.
(3), (4), (5)
-
C.
(2), (3), (5).
-
D.
(2), (3), (4).
Đáp án : D
Dựa vào độ tan của hợp chất muối.
ống (1) chứa Ca2+ do Ca2+ tạo kết tủa với ion CO32- trong muối Na2CO3.
ống (2) chứa ion Cl- do Cl- tạo kết tủa với ion Ag+
ống (4) chứa ion HCO3- do HCO3- khi phản ứng với H+ trong HNO3 tạo khí CO2.
Nên mẫu nước trên có thể chứa ion (2), (3), (4).
Đáp án D
Hằng ngày, cơ thể chúng ta cần cung cấp nhiều thực phẩm có nguồn gốc là carbohydrate như tinh bột, saccharose, glucose, fructose, cellulose (chất xơ),…Cho các phát biểu về các carbohydrate như sau:
a) Gluocse phản ứng với methanol khi có mặt HCl khan tạo thành methyl gluconate.
b) Cellulose và tinh bột đều là các polysaccharide có phân tử khối rất lớn, nhưng phân tử khối của cellulose lớn hơn nhiều so với tinh bột.
c) Amylopectin được cấu tạo từ nhiều đơn vị α – glucose liên kết với nhau qua liên kết α – 1,4 – glycoside và α – 1,6 – glycoside hình thành cấu trúc mạch phân nhánh.
d) Phân tử maltose có thể mở vòng trong dung dịch nước để tạo nhóm aldehyde trong khi saccharose không thể mở vòng được do không có nhóm – OH hemiacetal.
Số phát biểu đúng là
-
A.
2
-
B.
3
-
C.
4
-
D.
1
Đáp án : A
Dựa vào tính chất hóa học của carbohydrate.
a) sai, sản phẩm tạo thành là methyl glycoside.
b) sai, phân tử khối của tinh bột lớn hơn nhiều cellulose.
c) đúng
d) đúng
đáp án A
Sức điện động chuẩn của pin điện gồm hai điện cực M2+/M và Ag+/Ag bằng 0,936V, theo bảng sau:

Kim loại M là
-
A.
Cu.
-
B.
Fe.
-
C.
Ni.
-
D.
Sn.
Đáp án : D
Dựa vào công thức tính: \(E_{pin}^o = E_{( - )}^o - E_{( + )}^o\)
\(E_{pin}^o = E_{Ag + /Ag}^o - E_{M2 + /M}^o = 0,936 \to E_{M2 + /M}^o = 0,799 - 0,936 = - 0,137V\). Vậy kim loại M là Sn.
Đáp án D
Bradykinin là một peptide được sản sinh từ huyết thanh trong máu, là chất làm giãn mạch mạnh và gây co cơ trơn, chất trung gian gây ra tình trạng viêm. Công thức cấu tạo của bradykinin như hình dưới:

Thủy phân hoàn toàn 1 mol bradykinin thu được mấy loại amino acid khác nhau?
-
A.
4
-
B.
6
-
C.
5
-
D.
3
Đáp án : C
Dựa vào cấu tạo của bradykinin.
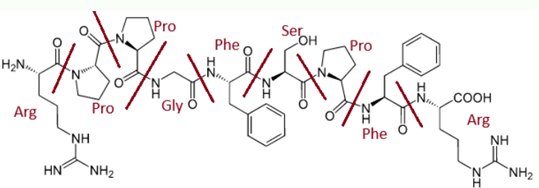
Bradykinin là một nonapeptide: Agr – Pro – Pro – Gly – Phe – Ser – Pro – Phe – Arg nên khi thủy phân hoàn toàn 1 mol bradykinin thu được 5 loại amino acid khác nhau.
Đáp án C
Phát biểu nào sau đây sai khi nói về enzyme?
-
A.
Phần lớn enzyme là những protein xúc tác cho các phản ứng hóa học và sinh hóa.
-
B.
Tốc độ phản ứng có xúc tác enzyme thường nhanh hơn nhiều lần so với xúc tác hóa học.
-
C.
Tốc độ phản ứng có xúc tác enzyme thường chậm hơn nhiều lần so với xúc tác hóa học.
-
D.
Enzyme có tính chọn lọc cao, mỗi enzyme chỉ xúc tác cho một hoặc một số phản ứng nhất định.
Đáp án : C
Dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng.
A. đúng
B. đúng
C. sai, tốc độ phản ứng có xúc tác enzyme thường nhanh hơn nhiều lần so với xúc tác hóa học.
D. đúng
Đáp án C
Ở điều kiện thường, trạng thái tồn tại của amino acid là:
-
A.
thể rắn.
-
B.
thể lỏng.
-
C.
thể rắn và lỏng.
-
D.
thể khí.
Đáp án : A
Dựa vào tính chất vật lí của amino acid.
ở điều kiện thường, amino acid tồn tại ở thể rắn.
đáp án A
Cấu hình electron ở phân lớp ngoài cùng của ion R+ là 2p6. Nguyên tử R là:
-
A.
19K
-
B.
20Ca
-
C.
10Ne
-
D.
11Na.
Đáp án : D
Ion R+ đã nhường 1 electron để có cấu hình là 2p6
Cấu hình e lớp ngoài cùng của R là: 3s1
Vậy R là 11Na
Đáp án D
-
A.
Ở bước 1, quá trình proton hóa liên kết đôi C=C của propene tạo thành carbocation.
-
B.
Nếu thay H2O bằng HBr thì cơ chế phản ứng xảy ra tương tự.
-
C.
Ở bước 2, quá trình tách proton để tạo thành alcohol.
-
D.
Sản phẩm của phản ứng là sản phẩm chính theo quy tắc Markovnikov.
Đáp án : C
Dựa vào sơ đồ cơ chế phản ứng của propene.
C sai, vì ở bước 2, quá trình cộng với tác nhân H – OH vào carbocation.
Đáp án C
Cho phản ứng hóa học: Fe + CuSO4 → FeSO4 + Cu. Trong phản ứng trên xảy ra:
-
A.
sự oxi hóa Fe và sự khử Cu2+
-
B.
sự khử Fe2+ và sự khử Cu2+
-
C.
sự oxi hóa Fe và sự oxi hóa Cu.
-
D.
sự khử Fe2+ và sự oxi hóa Cu.
Đáp án : A
Dựa vào ý nghĩa của thế điện cực chuẩn của kim loại.
Trong phản ứng trên xảy ra sự oxi hóa Fe và sự khử Cu2+.
Đáp án A
Nguyên tử nguyên tố R có số electron là 25, vị trí của R trong bảng tuần hoàn là:
-
A.
chu kì 4, phân nhóm VIIA.
-
B.
Chu kì 4, phân nhóm VIIB.
-
C.
chu kì 4, phân nhóm VB.
-
D.
chu kì 4, phân nhóm IIA.
Đáp án : B
Dựa vào vị trí nguyên tố trong bảng tuần hoàn.
Cấu hình của nguyên tử nguyên tố R là [Ar]4s23d5. Vậy R thuộc chu kì 4, phân nhóm VIIB.
Đáp án B
Dung dịch nào sau đây xảy ra phản ứng với ethyl acetate?
-
A.
NaOH (to)
-
B.
C2H5OH
-
C.
[Ag(NH3)2]OH
-
D.
NaCl.
Đáp án : A
Dựa vào tính chất hóa học của ester.
Ethyl acetate có phản ứng thủy phân trong môi trường NaOH.
Đáp án A
Một nhóm học sinh đã thực hiện phản ứng điều chế ethyl acetate từ nguyên liệu ban đầu là acetic acid và ethanol trong phòng thí nghiệm. Khi phản ứng kết thúc, nhóm đã thu được hỗn hợp sản phẩm gồm ethyl acetate và acetic acid, ethanol còn dư theo phương trình hóa học:
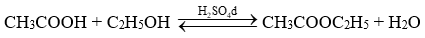
a) Phản ứng trên được gọi là phản ứng xà phòng hóa.
b) Vì ethyl acetate không phân cực, còn acetic acid và ethanol đều phân cực nên nhóm có thể dùng dung môi hữu cơ không phân cực diethyl ether (C2H5OC2H5) để chiết ethyl acetate ra khỏi hỗn hợp sau phản ứng.
c) Có thể thay dung dịch sulfuric acid đặc bằng dung dịch hydrochloric acid đặc.
d) Do diethyl ether có nhiệt độ sôi thấp hơn nhiều so với ethyl acetate (34,6oC so với 77,1oC) nên để thu được ethyl acetate có thể dùng nước nóng liên tục tưới lên bình cầu trong phương pháp chưng cất đơn giản để tách ethyl acetate ra khỏi dung môi diethyl ether sau khi chiết.
a) Phản ứng trên được gọi là phản ứng xà phòng hóa.
b) Vì ethyl acetate không phân cực, còn acetic acid và ethanol đều phân cực nên nhóm có thể dùng dung môi hữu cơ không phân cực diethyl ether (C2H5OC2H5) để chiết ethyl acetate ra khỏi hỗn hợp sau phản ứng.
c) Có thể thay dung dịch sulfuric acid đặc bằng dung dịch hydrochloric acid đặc.
d) Do diethyl ether có nhiệt độ sôi thấp hơn nhiều so với ethyl acetate (34,6oC so với 77,1oC) nên để thu được ethyl acetate có thể dùng nước nóng liên tục tưới lên bình cầu trong phương pháp chưng cất đơn giản để tách ethyl acetate ra khỏi dung môi diethyl ether sau khi chiết.
Dựa vào phương pháp điều chế ester.
a) sai, phản ứng trên gọi là phản ứng ester hóa.
b) đúng, vì ethyl acetate tan tốt trong diethyl ether nhưng không hòa tan được acetic acid va ethanol.
c) sai, hydrochloric acid đặc không có tính hút nước mạnh như sulfuric acid đặc, ngoài ra hydrochloric acid đặc chứa nhiều nước hơn nên sẽ làm cân bằng chuyển dịch sang chiều nghịch làm giảm hiệu suất của phản ứng.
d) đúng.
Trong công nghiệp sản xuất bia có các bước chính sau:
Hạt đại mạch → Dịch nấu (maltose, glucose) → Ethanol
a) Thành phần trong hạt đại mạch bị thủy phân tạo ra maltose, glucose là tinh bột.
b) Để biết được thời điểm kết thúc quá trình thủy phân tinh bột ta có thể kiểm tra bằng thuốc thử là dung dịch I2 trong KI.
c) Maltose và glucose thuộc nhóm monosaccharide, khi lên men thu được ethanol.
d) Sản phẩm thủy phân của tinh bột (hạt đại mạch), ngoài maltose và glucose còn thu được sản phẩm phụ là fructose.
a) Thành phần trong hạt đại mạch bị thủy phân tạo ra maltose, glucose là tinh bột.
b) Để biết được thời điểm kết thúc quá trình thủy phân tinh bột ta có thể kiểm tra bằng thuốc thử là dung dịch I2 trong KI.
c) Maltose và glucose thuộc nhóm monosaccharide, khi lên men thu được ethanol.
d) Sản phẩm thủy phân của tinh bột (hạt đại mạch), ngoài maltose và glucose còn thu được sản phẩm phụ là fructose.
Dựa vào tính chất hóa học của tinh bột và maltose.
a) đúng
b) đúng
c) sai, maltose thuộc nhóm disaccharide.
d) sai, tinh bột và maltose đều có cấu tạo từ glucose.
Trong công nghiệp, xút (sodium hydroxide) được sản xuất bằng phương pháp điện phân dung dịch sodium chloride có màng ngăn xốp. Bằng phương pháp này, người ta cũng thu được khí chlorine. Chất khí này được làm khô (loại bỏ hơi nước) rồi hóa lỏng để làm nguyên liệu quan trọng cho nhiều ngành công nghiệp chế biến và sản xuất hóa chất.
Từ quá trình điện phân nêu trên, một lượng chlorine và hydrogen sinh ra được tận dụng để sản xuất hydrochloric acid đặc thương phẩm (37%, D = 1,19 g/ml ở 20oC)
Một nhà máy với quy mô sản xuất 200 tấn xút mỗi ngày thì đồng thời sản xuất được V m3 acid thương phẩm (ở 20oC). Biết rằng, tại nhà máy này, 60% khối lượng chlorine sinh ra được dùng tổng hợp hydrochloric acid và hiệu suất của toàn bộ quá trình từ chlorine đến acid thương phẩm là 80%
a) Có thể dùng sulfuric acid làm khô khí chlorine thoát ra.
b) Trong thí nghiệm điện phân Cl2 sẽ thoát ra ở cực cathode.
c) Nếu không sử dụng màng ngăn xốp thì phương trình điện phân dung dịch NaCl là: 2NaCl + 2H2O → 2NaOH + H2 + Cl2
d) Giá trị của V là 237 (làm tròn đến phần mười).
a) Có thể dùng sulfuric acid làm khô khí chlorine thoát ra.
b) Trong thí nghiệm điện phân Cl2 sẽ thoát ra ở cực cathode.
c) Nếu không sử dụng màng ngăn xốp thì phương trình điện phân dung dịch NaCl là: 2NaCl + 2H2O → 2NaOH + H2 + Cl2
d) Giá trị của V là 237 (làm tròn đến phần mười).
a) đúng
b) sai, trong thí nghiệm điện phân Cl2 sẽ thoát ra ở cực anode.
c) sai, nếu không sử dụng màng ngăn xốp thì phương trình điện phân dung dịch NaCl là: NaCl + H2O → NaClO + 2H2
d) sai, m Cl2 tổng = \(\frac{{200.71}}{{2.40}} = 177,5\tan \)
m HCl = \(\frac{{177,5.60\% .80\% .2.36,5}}{{71}} = 87,6\tan \)
V dung dịch HCl = \(\frac{{87,6}}{{37\% .1,19}} = 199,0{m^3}\)
Trong bình kín có hệ cân bằng hóa học sau: CO2(g) + H2(g) ⥦CO(g) + H2O(g); \({\Delta _r}H_{298}^o > 0\)
Cho các phát biểu về sự tác động đến hệ cân bằng dưới đây, hãy xét tính đúng sai của các phát biểu đó.
a) Tăng nhiệt độ của hệ thì cân bằng chuyển dịch theo chiều thuận.
b) Thêm chất xúc tác thì cân bằng chuyển dịch theo chiều thuận.
c) Giảm áp suất chung của hệ thì cân bằng chuyển dịch theo chiều nghịch.
d) Nếu nồng độ ban đầu CO2 và H2 đều là 0,03M; tại cân bằng [CO] = 0,018M thì giá trị Kc là 1,5.
a) Tăng nhiệt độ của hệ thì cân bằng chuyển dịch theo chiều thuận.
b) Thêm chất xúc tác thì cân bằng chuyển dịch theo chiều thuận.
c) Giảm áp suất chung của hệ thì cân bằng chuyển dịch theo chiều nghịch.
d) Nếu nồng độ ban đầu CO2 và H2 đều là 0,03M; tại cân bằng [CO] = 0,018M thì giá trị Kc là 1,5.
Dựa vào nguyên lí chuyển dịch cân bằng Le Chaterlier.
Lời giải
a) sai, chiều thuận là chiều tỏa nhiệt nên khi tăng nhiệt độ cân bằng chuyển dịch theo chiều nghịch.
b) sai, xúc tác không ảnh hưởng đến chuyển dịch cân bằng.
c) sai, giảm áp suất cân bằng không thay đổi.
d) sai vì,
Kc = \(\frac{{{\rm{[}}CO].{\rm{[}}{H_2}{\rm{O}}]}}{{{\rm{[}}C{O_2}].{\rm{[}}{H_2}]}} = \frac{{0,018.0,018}}{{(0,03 - 0,018).(0,03 - 0,018)}} = 2,25\)
KMnO4 là chất oxi hóa thường dùng trong xác định nồng độ các chất khử trong phòng thí nghiệm nhưng KMnO4 thường chứa tạp chất nên có thể ảnh hưởng đến kết quả thí nghiệm. Để xác định nồng độ chuẩn của dung dịch KMnO4 có nồng độ x.10-2 (M) dùng dung dịch oxalic acid gốc theo các bước sau:
- Hòa tan hoàn toàn 0,505 gam oxalic acid ngậm nước H2C2O4.2H2O (M = 126,07) trong nước rồi pha thành 100ml dung dịch X.
- Chuẩn độ 10,00ml dung dịch X (trong môi trường sulfuric acid loãng, dư) bằng dung dịch KMnO4 trên đến khi xuất hiện màu hồng nhạt thì dừng. Cho biết oxalic acid bị KMnO4 oxi hóa thành CO2 và H2O trong môi trường acid.
- Lặp lại thí nghiệm chuẩn độ trên thêm 2 lần nước. Thể tích trung bình của dung dịch KMnO4 sau 3 lần chuẩn độ là 12,75ml.
Tính giá trị của x (làm tròn đáp án đến hàng phần mười).
Phương pháp
Đáp án:
Đáp án:
- Tính số mol oxalic acid ngậm nước.
- Viết phương trình phản ứng chuẩn độ, cân bằng phương trình theo phương pháp thăng bằng electron.
- Từ phương trình phản ứng, tính số mol của KMnO4 từ đó tính được x.
n H2C2O4.2H2O = 0,505 : 126,07 = 0,004 mol
CM H2C2O4 = 0,004 : 0,1 = 0,04M
n H2C2O4 trong 10 ml là: 0,0004 mol
2KMnO4 + 5H2C2O4 + 3H2SO4 → 10CO2 + 8H2O + K2SO4 + MnSO4
16.10-5 ← 0,0004
CM KMnO4 = \(\frac{{{{16.10}^{ - 5}}}}{{12,{{75.10}^{ - 3}}}} \approx 0,013M\)= 1,3.10-2 M.
Vậy x = 1,3
Ở điều kiện chuẩn, cần phải đốt cháy hoàn toàn bao nhiêu gam methane CH₄(g) (làm tròn đến hàng phần trăm) để cung cấp nhiệt cho phản ứng tạo 1,5 mol CaO bằng cách nung CaCO₃. Giả thiết hiệu suất của quá trình đều là 100%. Phương trình nhiệt của phản ứng nung vôi và đốt cháy methane như sau:
(1) CaCO₃(s) → CaO(s) + CO₂(g)
(2) CH₄(g) + 2O₂(g) → CO₂(g) + 2H₂O(g)
Biết nhiệt tạo thành (\({\Delta _f}H_{298}^o\)) của các chất ở điều kiện chuẩn được cho trong bảng sau:

Đáp án:
Đáp án:
Dựa vào công thức tính biến thiên enthalpy của phản ứng.
\({\Delta _r}H_{298}^o(1) = {\Delta _f}H_{298}^o(CaO) + {\Delta _f}H_{298}^o(C{O_2}) - {\Delta _f}H_{298}^o(CaC{O_3}) = - 635 + ( - 393,5) - ( - 1207) = 178,5kJ\)
Nhiệt lượng để cung cấp cho phản ứng tạo 1,5 mol CaO là: 178,5.1,5 = 267,75 kJ.
\({\Delta _r}H_{298}^o(2) = {\Delta _f}H_{298}^o(C{O_2}) + 2.{\Delta _f}H_{298}^o({H_2}O) - {\Delta _f}H_{298}^o(C{H_4}) = ( - 393,5) + 2.( - 241,8) - ( - 74,6) = - 802,5kJ\)
Cần số gam CH4 đốt cháy để cung cấp đủ nhiệt lượng cho phản ứng (1) là: mCH4 = \(\frac{{267,75}}{{802,5}}.16 = 5,34g\)
Xà phòng hóa hoàn toàn 17,24 gam chất béo cần vừa đủ 0,06 mol NaOH. Cô cạn dung dịch sau phản ứng thu được khối lượng xà phòng là bao nhiêu gam? (làm tròn đáp án đến hàng đơn vị).
Đáp án:
Đáp án:
- Dựa vào phương trình, tính mol glycerol.
- Áp dung định luật bảo toàn khối lượng.
n glycerol = 0,06 : 3 = 0,02 mol
Áp dụng ĐLBTKL ta có: m chất béo + m NaOH = m xà phòng + m glycerol
→ m xà phòng = 17,24 + 0,06.40 – 0,02.92 = 17,8g ≈ 18g
Hòa tan m gam tinh thể CuSO₄.5H₂O vào nước thu được dung dịch X. Điện phân dung dịch X với điện cực trơ và cường độ dòng điện không đổi. Nếu thời gian điện phân là t (s) thì thu được kim loại Cu ở cathode và 208,236 mL khí tại anode. Nếu thời gian điện phân là 2t (s) thì thu được 713,952 mL khí. Biết thể tích các khí đo ở đkc. Tính giá trị của m (làm tròn đến hàng đơn vị).
Đáp án:
Đáp án:
Dựa vào nguyên tắc điện phân dung dịch.
Tại thời điểm t(s):
Khí thoát ra ở anode là khí O2, n O2 = 208,236 : 24,79 = 8,4 mmol
|
Tại cathode (-) |
Tại anode (+) |
|
Cu2+ + 2e → Cu 33,6 →16,8 mol |
2H2O → O2 + 4H+ + 4e 8,4 → 33,6 |
Tại thời điểm 2t(s): n khí = 713,952 : 24,79 = 28,8 mmol
n O2 = 8,4.2 = 16,8 mol => n e trao đổi = 16,8.4 = 67,2 mmol
=> n H2 = 28,8 – 16,8 = 12 mmol
|
Tại cathode (-) |
Tại anode (+) |
|
Cu2+ + 2e → Cu (67,2-24) → 21,6 mmol 2H2O + 2e → 2OH- + H2 24 ← 12 |
2H2O → O2 + 4H+ + 4e 16,8 → 67,2 |
n CuSO4 = 21,6 mmol => m CuSO4.5H2O = 21,6.250 = 5400 mg = 5,4g
Fructose có công thức phân tử C₆H₁₂O₆. Tương tự glucose, fructose tồn tại đồng thời dạng mạch hở và mạch vòng (α và β). Ở dạng mạch vòng α-fructose, tổng số nhóm –OH hemicetal và –OH hemiketal trong phân tử fructose là bao nhiêu?
Đáp án:
Đáp án:
Dựa vào cấu tạo của fructose.
Ở dạng hở và dạng vòng, frucotse có 1 nhóm – OH hemiketal và không có nhóm – OH hemicetal.
Đáp án 2.
Ứng với công thức phân tử C₆H₁₂O₂N có bao nhiêu chất vừa phản ứng được với dung dịch NaOH, vừa phản ứng được với dung dịch HCl?
Đáp án:
Đáp án:
Viết công thức cấu tạo của phân tử phù hợp với tính chất lưỡng tính.
Có 2 chất thỏa mãn: CH3COONH; HCOONH3CH3
CH3COONH4 + HCl → CH3COOH + NH4Cl
HCOONH3CH3 + HCl → HCOOH + CH3NH3Cl
CH3COONH4 + NaOH → CH3COONa + NH3 + H2O
HCOONH3CH3 + NaOH → HCOONa + CH3NH2 + H2O
Cho biết nguyên tử khối: H = 1; C = 12; N = 14; O = 16; Na = 23; Al = 27; S = 32; Fe = 56
Cho khối lượng riêng của các chất như bảng sau:
Tro thực vật được sử dụng như một loại phân bón
Insulin là hoocmon của cơ thể có tác dụng điều tiết lượng đường trong máu
Chất nào sau đây thuộc loại disaccharide?
Cho biết giá trị thế điện cực chuẩn của các cặp oxi hoá - khử sau
Chuẩn độ dung dịch NaOH chưa biết chính xác nồng độ
Điện phân dung dịch CuSO4 với anode
Cho biết số hiệu nguyên tử của sodium là 11. Vị trí của sodium trong bảng tuần hoàn là
Thức uống chứa cồn như rượu, bia, nước trái cây lên men
Cho ba dung dịch có cùng nồng độ mol sau:
Để chuyển hóa dầu mỡ động thực vật thành xà phòng người ta thực hiện quá trình
Vào mùa hè, trong một số khách sạn hay nhà hàng
I. Trắc nghiệm
Cho dung dịch glucose vào ống ng̣hiệm chứa copper
Đề thi thử THPT môn Hóa lần 1 năm 2025 Trường THPT Chuyên KHTN Hà Nội
Cấu trúc mạch vòng của carbohydrate nào sau đây không có nhóm -OH hemiacetal hoặc hemiketal?
Trong nước, thế điện cực chuẩn của kim loại Mn+/M
Chất X có công thức cấu tạo là CH3CH2COOCH3. Tên gọi của X là
Các bài khác cùng chuyên mục









Danh sách bình luận