Lý thuyết Thế điện cực chuẩn của kim loại - Hóa 12 Cánh diều
- Xét một quá trình có ion kim loại Mn+ đóng vai trò là chất oxi hóa và một quá trình kim loại M đóng vai trò là chất khử như sau:
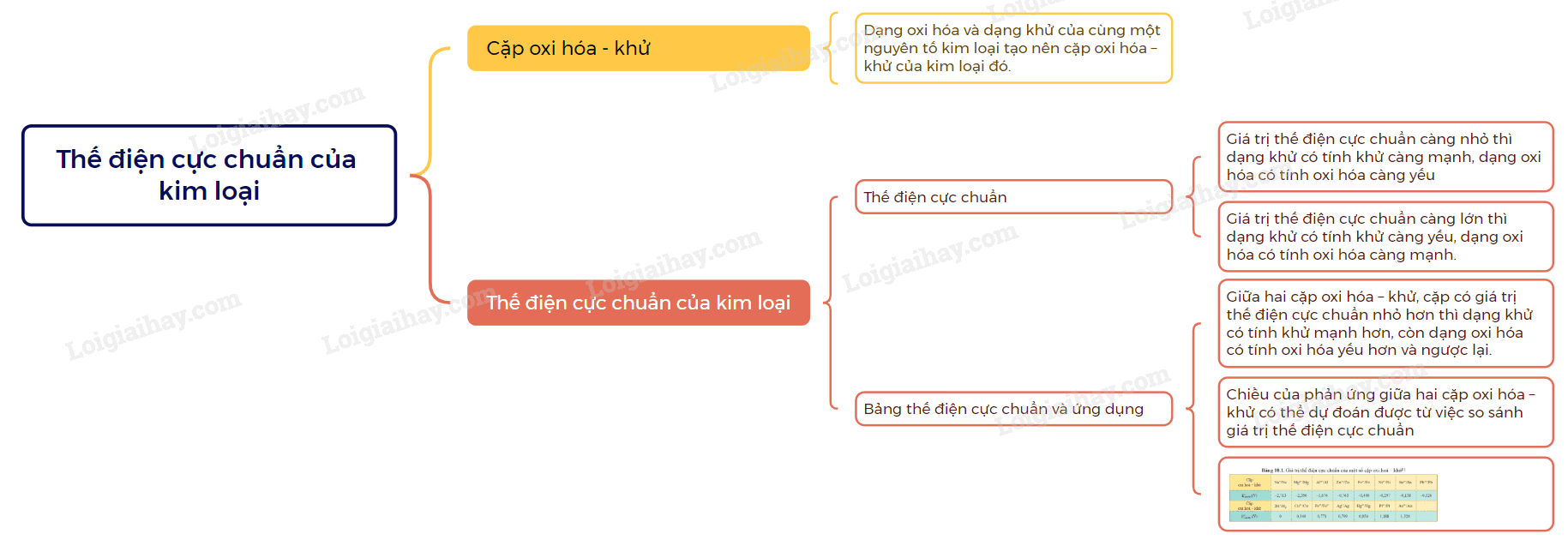
I. Cặp oxi hóa – khử của kim loại
- Xét một quá trình có ion kim loại Mn+ đóng vai trò là chất oxi hóa và một quá trình kim loại M đóng vai trò là chất khử như sau:
Mn+ + ne \( \to \) M
M \( \to \)Mn+ + ne
- Trong trường hợp trên, chất oxi hóa (dạng oxi hóa) Mn+ và chất khử (dạng khử). M thuộc cùng một nguyên tố kim loại. Quá trình trên được viết gọn như sau:
Mn+ + ne \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) M
Dạng oxi hóa Dạng khử
- Dạng oxi hóa và dạng khử của cùng một nguyên tố kim loại tạo nên cặp oxi hóa – khử của kim loại đó.
II. Thế điện cực chuẩn của kim loại
1. Thế điện cực chuẩn
- Thế điện cực của cặp oxi hóa – khử của kim loại trong điều kiện chuẩn (nồng độ ion kim loại trong dung dịch là 1M, nhiệt độ 25oC) được gọi là thế điện cực chuẩn của kim loại, kí hiệu là \(E_{oxh/kh}^o\)
- Đơn vị thường sử dụng của thế điện cực là volt (V)
- Thế điện cực chuẩn của cặp oxi hóa – khử càng lớn thì tính khử của dạng khử càng yếu, tính oxi hóa của dạng oxi hóa càng mạnh và ngược lại.
2. Bảng thế điện cực chuẩn của kim loại và ứng dụng
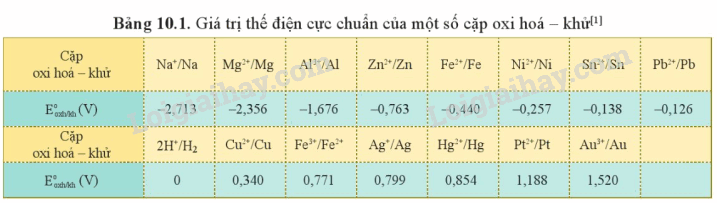
Nếu \(E_{{M^{n + }}/M}^o\)càng lớn thì
+ Tính oxi hóa của Mn+ càng mạnh.
+ Tính khử của M càng yếu

Dự đoán chiều phản ứng oxi hóa – khử
Nguyên tắc chung của phản ứng oxi hóa – khử xảy ra như sau:
- Chất oxi hóa mạnh hơn + Chất khử mạnh hơn \( \to \) Chất khử yếu hơn + Chất oxi hóa yếu hơn
SƠ ĐỒ TƯ DUY
Các bài khác cùng chuyên mục
- Lý thuyết Sơ lược về sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch - Hóa 12 Cánh diều
- Lý thuyết Sơ lược về phức chất - Hóa 12 Cánh diều
- Lý thuyết Sơ lược về kim loại chuyển tiếp dãy thứ nhất - Hóa 12 Cánh diều
- Lý thuyết Nước cứng và làm mềm nước cứng - Hóa 12 Cánh diều
- Lý thuyết Nguyên tố nhóm IIA - Hóa 12 Cánh diều
- Lý thuyết Sơ lược về sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch - Hóa 12 Cánh diều
- Lý thuyết Sơ lược về phức chất - Hóa 12 Cánh diều
- Lý thuyết Sơ lược về kim loại chuyển tiếp dãy thứ nhất - Hóa 12 Cánh diều
- Lý thuyết Nước cứng và làm mềm nước cứng - Hóa 12 Cánh diều
- Lý thuyết Nguyên tố nhóm IIA - Hóa 12 Cánh diều












Danh sách bình luận