 SBT Hóa 12 - giải SBT Hóa học 12 - Chân trời sáng tạo
SBT Hóa 12 - giải SBT Hóa học 12 - Chân trời sáng tạo
 Chương 8. Sơ lược về dãy kim loại chuyển tiếp thứ nhất ..
Chương 8. Sơ lược về dãy kim loại chuyển tiếp thứ nhất .. Bài 20. Sơ lược về phức chất và sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch trang 132, 133, 134 SBT Hóa 12 Chân trời sáng tạo
Nhận xét nào sau đây là không đúng?
20.1
Nhận xét nào sau đây là không đúng?
A. Nguyên tử trung tâm chỉ có thể là cation kim loại.
B. Thành phần của phức chất có nguyên tử trung tâm và phối tử.
C. Phối tử còn cặp electron chưa liên kết, có khả năng cho nguyên tử trung tâm.
D. Liên kết giữa phối tử và nguyên tử trung tâm là liên kết cho – nhận.
Phương pháp giải:
Dựa vào thành phần của phức chất.
Lời giải chi tiết:
A sai, Nguyên tử trung tâm trong phức chất là cation kim loại hoặc nguyên tử kim loại đã nhận cặp electron hoá trị riêng của phân tử hoặc anion.
Đáp án A
20.2
Nhận định nào sau đây là đúng?
A. Phức chất chỉ có dạng hình học là bát diện.
B. Phức chất luôn chứa cầu ngoại.
C. Phức chất có các dạng hình học khác nhau.
D. Một phức chất có thê tồn tại ở các dạng hình học khác nhau.
Phương pháp giải:
Dựa vào thành phần và hình dạng của phức chất.
Lời giải chi tiết:
Phức chất có các dạng hình học khác nhau như hình bát diện, hình vuông phẳng.
Đáp án C
20.3
Cho các nhận định sau:
(1) Kiểu lai hoá của nguyên tử trung tâm sẽ quyết định dạng hình học của phức chất.
(2) Cation Ni2+ chỉ có thể tạo phức chất bát diện.
(3) Cầu nội của phức chất có thể mang điện tích dương, âm hoặc không.
(4) Phối tử chỉ có thể là anion hoặc phân tử trung hoà.
(5) Cầu ngoại của phức chất thường mang điện tích âm.
(6) Nguyên tử trung tâm là các nguyên tố nhóm B.
(7) Phức chất có các dạng hình học phổ biến là tứ diện, vuông phẳng và bát diện.
(8) Nguyên tử trung tâm không thể là các nguyên tố phi kim.
Số nhận định đúng là
A.2. B. 3. C. 4. D.5.
Phương pháp giải:
Dựa vào thành phần của phức chất.
Lời giải chi tiết:
(1) đúng
(2) sai, cation Ni2+ có thể tạo phức chất tứ diện.
(3) đúng
(4) sai, phối tử có thể gồm cả anion, phân tử trung hòa hoặc kim loại như Co.
(5) sai, cầu ngoại của phức chất có thể không mang điện tích.
(6) sai, nguyên tử trung tâm là các kim loại chuyển tiếp.
(7) đúng
(8) sai, nguyên tử trung tâm có thể là kim loại như [SiF6]2-
Đáp án B
20.4
Với phối tử Cl‑, tất cả các ion nào sau đây sẽ là nguyên tử trung tâm trong phức chất tứ diện?
A. Cu2+, Ni2+, Mn2+. B. Fe3+, Cr3+, Co3+.
C. Cr3+, Co3+, Sc3+. D. Ni2+, Cu2+, Zn2+.
Phương pháp giải:
Dựa vào cấu tạo của phức chất.
Lời giải chi tiết:
Với phối tử Cl‑, tất cả các ion Ni2+, Cu2+, Zn2+. sẽ là nguyên tử trung tâm trong phức chất tứ diện.
Đáp án D
20.5
Dung dịch phức chất aqua không thể có màu xanh là
A. [Cr(H₂O)6]3+. B. [Zn(H₂O)6]2+.
C. [Ni(H₂O)6]2+. D. [Cu(H₂O)6]2+.
Phương pháp giải:
Dựa vào màu sắc của một số phức chất.
Lời giải chi tiết:
[Zn(H₂O)6]2+ không thể có màu xanh
Đáp án B
20.6
Phức chất nào sau đây có dạng hình học không phải là tứ diện?
A. [CuCl4]2-. B. [CoCl4]2-. C. [PdCl4]2-. D. [FeCl4]-.
Phương pháp giải:
Dựa vào dạng hình học của phức.
Lời giải chi tiết:
[PdCl4]2- là phức vuông phẳng.
Dáp án C
20.7
Nhỏ từng giọt dung dịch sodium hydroxide cho đến dư vào dung dịch aluminium chloride, dấu hiệu chứng tỏ đã tạo ra phức chất chứa phối từ OH- là
A. kết tủa bị hoà tan.
B. dung dịch bị chuyên từ không màu sang có màu.
C. kết tủa keo trắng tạo thành.
D. dung dịch bị mất màu.
Phương pháp giải:
Dựa vào tính chất hóa học của phức chất.
Lời giải chi tiết:
Kết tủa bị hòa tan là dấu hiệu chứng tỏ đã tạo ra phức chất chứa phối tử OH-
Đáp án A
20.8
Phức chất có dạng hình học không phải tứ diện là
A. [CoBr4]2-. B. [PtBr4]2-. C. [AI(OH)4]-. D. [FeCl4]-.
Phương pháp giải:
Dựa vào hình dạng của phức chất.
Lời giải chi tiết:
[PtBr4]2- là phức chất vuông phẳng.
Đáp án B
20.9
Cho cân bằng sau:
[CoCl4]²-(aq) + 6H₂O(1) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)[Co(H₂O)6]2+(aq) +4Cl-(aq) \({\Delta _r}H_{298}^0 < 0\)
(màu xanh chàm)(màu đỏ hồng)
a) Màu của dung dịch sẽ thay đối như thể nào khi đun nóng?
b) Khi thêm dung dịch HCI, dung dịch sẽ có màu gì?
c) Hãy cho biết dạng hình học của các phức chất trong cân bằng trên.
Phương pháp giải:
Dựa vào tính chất của phức chất.
Lời giải chi tiết:
a) Phản ứng theo chiều thuận là toả nhiệt, nên khi làm lạnh cân bằng sẽ chuyển dịch theo chiều thuận, màu dung dịch sẽ chuyển sang đỏ hồng.
b) Khi thêm HCI sẽ làm tăng nồng độ ion Cl-, nên cân bằng chuyển dịch sang chiều nghịch, màu dung dung dịch sẽ chuyển sàng xanh chàm.
c) Phối tử Cl- và H2O trong các phức chất đã nêu đều có dung lượng phối trí bằng 1, nên phức chất [CoCl4]2- có dạng hình học tứ diện, phức chất [Co(H2O)6 ]2+ có dạng hình học bát diện. Dạng hình học của chúng được biểu diễn như sau:
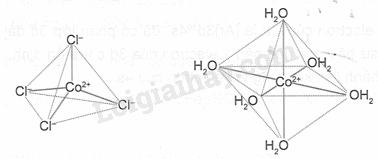
20.10
Dự đoán hiện tượng xảy ra, mô tả sự thay thế phối tử khi cho từ từ đến dư dung dịch ammonia vào dung dịch muối nickel(II) chloride. Viết phương trình hoá học của các phản ứng.
Phương pháp giải:
Dựa vào tính chất của phức chất.
Lời giải chi tiết:
Hiện tượng: Dung dịch NiCl2, có màu lục, khi nhỏ thêm NH3, sẽ xuất hiện kết tủa màu lục, tiếp tục nhỏ đến dư NH3, kết tủa sẽ tan và tạo thành dung dịch có màu tím.
Kết tủa bị hoà tan là do đã tạo thành phức chất [Ni(NH3)6]2+. Trong dung dịch NiCl2 tồn tại phức aqua [Ni(H2O)6]2+, khi nhỏ đến dư NH3, sẽ có sự thay thế phối tử H2O bằng phối tử NH3.
Phương trình hoá học của các phản ứng:
[Ni(H₂O)6]²+(aq) + 2NH3(aq) → [Ni(H2O)4(OH)2]\( \downarrow \) (s) + 2NH4+ (aq)
[Ni(H₂O)4(OH)₂](s) + 6NH3(aq) → [Ni(NH3)6]²+(aq) + 2OH-(aq) + 4H2O(1)
20.11
Giả sử có sơ đồ biểu thị tiến trình thí nghiệm như sau:
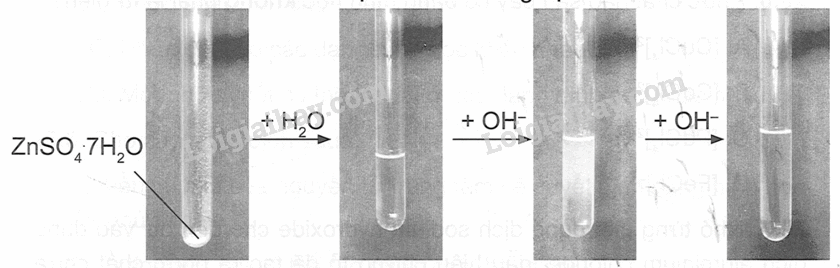
Hãy mô tả hiện tượng, mô tả sự thay thế phối tử trong phức chất. Viết phương trình hoá học của các phản ứng.
Phương pháp giải:
Dựa vào tính chất của phức chất.
Lời giải chi tiết:
Hiện tượng: Chất rắn màu trắng sẽ tan tạo thành dung dịch trong suốt không màu, nhỏ từng giọt dung dịch kiềm sẽ tạo thành kết tủa keo trắng. Khi cho kiềm đến dư, kết tủa sẽ tan tạo thành dung dịch trong suốt không màu.
Phối tử H2O trong phức chất aqua đã bị thay thể bởi phối tử OH- để tạo ra phức chất [Zn(OH)4]2-
Phương trình điện li trong dung dịch:
ZnSO4.7H₂O + aq→ [Zn(H2O)6]²+(aq) + H₂O(l) + SO42- (aq)
Phương trình hoá học dạng ion của phản ứng:
[Zn(H₂O)]²+(aq) + 2OH-(aq)→ [Zn(H2O)4(OH)2](s) + 2H2O(l)
Phương trình hoá học dạng ion của phản ứng khi cho dư ion OH- :
[Zn(H₂O)4(OH)2](s) + 2OH-(aq) → [Zn(OH)4]²-(aq) + 4H₂O(l)
20.12
Một thí nghiệm được tiến hành như sau: Nhỏ vài giọt dung dịch silver nitrate vào ống nghiệm có chứa dung dịch sodium chloride, thêm tiếp vào ống nghiệm từng giọt dung dịch ammonia và lắc mạnh. Hãy dự đoán hiện tượng quan sát được. Giải thích. Viết các phương trình hoá học của phản ứng. Cho biết dạng hình học của phức chất tạo thành.
Phương pháp giải:
Dựa vào hình dạng của phức chất tạo thành.
Lời giải chi tiết:
Trong dung dịch sodium chloride tồn tại các ion Na+(aq) và Cl-(aq), trong dung dịch silver nitrate tồn tại các ion Ag+(aq) và NO3- (aq). Khi nhỏ từ từ dung dịch AgNO3, vào dung dịch NaCl sẽ có kết tủa trắng AgCl tạo thành. Khi thêm tiếp dung dịch NH3, lắc mạnh, kết tủa trắng sẽ tan do có phản ứng tạo ra phức chất [Ag(NH3)2]+(aq).
Phương trình hoá học của các phán ứng:
Ag+(aq) + CI-(aq) \( \to \)AgCl(s) + aq
AgCI(s) + 2NH3(aq) \( \to \) [Ag(NH3)2]+(aq) + Cl-(aq)
Phức chất [Ag(NH3)2]+ có dạng hình học là đường thắng, công thức cấu tạo như sau:
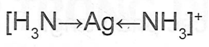
20.13
Từ platinum(II) chloride và phối tử triethylphosphine (PEt3), nhà hoá học vô cơ người Thụy Sĩ gốc Đức, Alfred Werner đã tổng hợp được hai phức chất vuông phẳng là đồng phân hình học của nhau. Hai phức chất này có cùng thành phần là 38,8% Pt, 14,1% Cl, 28,7% C, 12,4% P và 6,0% H. Hãy xác định công thức, về cấu tạo và gọi tên hai đồng phân của phức chất này.
Phương pháp giải:
Dựa vào phần trăm các nguyên tố
Lời giải chi tiết:
Tỉ lệ : Pt : Cl : C : P : H = \(\frac{{38,8}}{{207}}:\frac{{14,1}}{{35,5}}:\frac{{28,7}}{{12}}:\frac{{12,4}}{{31}}:\frac{6}{1} = 1:2:2:4:30\)
Công thức phân tử của phức chất là : [PtCl2(P(C2H5)3)2]. Từ đó vẽ được dạng hình học của hai đồng phân cis và trans.
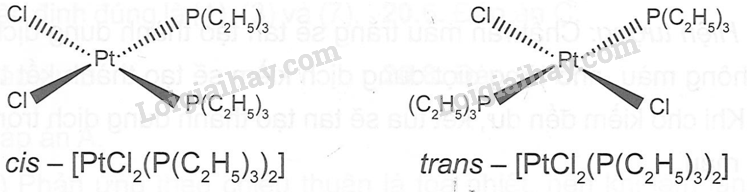
20.14
Trong kĩ thuật tráng phim đen trắng, người ta dùng dung dịch Na2S2O3 (sodium thiosulfate) để loại bỏ AgBr còn dư trên phim. Tính độ tan (mol/L) của AgBr trong nước và trong dung dịch Na2S2O3 0,1 M để chứng minh kĩ thuật đó là có cơ sở khoa học.
Cho biết: AgBr(s) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)Ag+(aq) + Br-(aq) K1 = 5x10-13
Ag+(aq) + 2S2O32-(aq) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) [Ag(S2O3)2]3-(aq) K2 = 4x1013
Phương pháp giải:
Dựa vào tính chất của phức chất.
Lời giải chi tiết:
Độ tan S1 (mol/L) của AgBr(s) trong nước được xác định từ cân bằng:
AgBr(s) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)Ag+(aq) + Br-(aq) K1 = 5x10-13
(mol/L) S1 \( \to \) S1 \( \to \)S1
Ta có:
K1 = [Ag+]x[Br-] = S12\( \Rightarrow \)S1 = 7,1 x 10-7 (mol/L).
Độ tan S2 của AgBr(s) trong dung dịch Na2S2O3 được xác định từ các cân bằng
AgBr(s) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)Ag+(aq) + Br-(aq) K1 = 5x10-13
Ag+(aq) + 2S2O32-(aq) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) [Ag(S2O3)2]3-(aq) K2 = 4x1013
Cân bằng trên chuyển dịch mạnh theo chiều thuận do Ag+ chuyển thành phức chất:
AgBr(s) + 2S₂O32-(aq) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) [Ag(S₂O3)2]3-(aq) + Br-(aq) K1x K2
Ban đầu: 0,1
Phản ứng: S2 2 S2 S2 S2
Cân băng: (0,1-2S2) S2 S2
Vì vậy: \(\frac{{S_2^2}}{{{{(0,1 - 2{S_2})}^2}}} = {K_1}.{K_2}\)
\( \Rightarrow \)S₂ = 0,045 (mol/L).
Nhận xét: Độ tan của AgBr(s) trong dung dịch Na2S2O3 0,1 M tăng 63400 (lần)
Như vậy, khi dùng dung dịch Na2S2O3 0,1 M có thể loại bỏ hết phần AgBr(s) còn lại chưa bị phân huỷ ở trên bề mặt của phim.
20.15
Chì (lead) trong mĩ phẩm có tác dụng làm tăng độ bám của sản phẩm lên da. Việc lạm dụng các mĩ phẩm này có thể dẫn đến ngộ độc - chì. Ngộ độc chì là một trong những tình trạng nhiễm kim loại nặng gây nguy hiểm cho sức khoẻ, có thể dẫn đến tử vong nếu không được phát hiện, xử lí kịp thời. Với trường hợp nhiễm độc chì nặng cần sử dụng – thuốc giải độc. Một trong các loại thuốc được bác sĩ chỉ định là Edetates (calcium disodium edetate), có tác dụng loại bỏ ion Pb²+ theo phương trình hoá học của phản ứng:
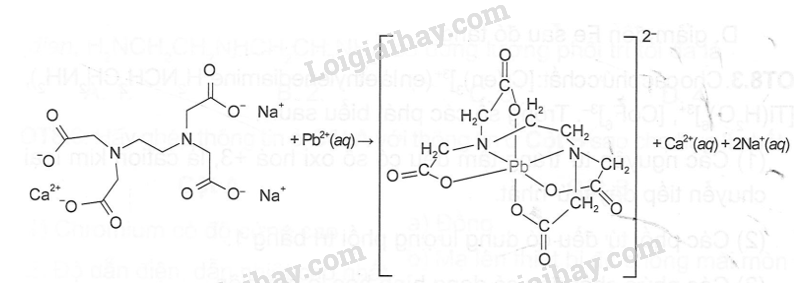
Vì sao phản ứng trên xảy ra? Hãy cho biết dạng hình học của phức chất tạo thành.
Phương pháp giải:
Dựa vào phản ứng tạo phức chất.
Lời giải chi tiết:
Phản ứng xảy ra do có sự thay thể phối tử aqua của nguyên tử trung tâm Pb2+ bằng phối từ (EDTA)4- để tạo ra phức chất bền hơn. Phức chất tạo thành có dạng hình học bát diện.
Luyện Bài Tập Trắc nghiệm Hóa 12 - Chân trời sáng tạo - Xem ngay
Các bài khác cùng chuyên mục
- Bài Ôn tập chương 8. Sơ lược về dãy kim loại chuyển tiếp thứ nhất và phức chất trang 136, 137 SBT Hóa 12 Chân trời sáng tạo
- Bài 20. Sơ lược về phức chất và sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch trang 132, 133, 134 SBT Hóa 12 Chân trời sáng tạo
- Bài 19. Đại cương về kim loại chuyển tiếp thứ nhất trang 128, 129, 130 SBT Hóa 12 Chấn trời sáng tạo
- Bài Ôn tập chương 7. Nguyên tố nhóm IA và IIA trang 121, 122 SBT Hóa 12 Chân trời sáng tạo
- Bài 18. Nguyên tố nhóm IIA trang 114, 115, 116 SBT Hóa 12 Chân trời sáng tạo
- Bài Ôn tập chương 8. Sơ lược về dãy kim loại chuyển tiếp thứ nhất và phức chất trang 136, 137 SBT Hóa 12 Chân trời sáng tạo
- Bài 20. Sơ lược về phức chất và sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch trang 132, 133, 134 SBT Hóa 12 Chân trời sáng tạo
- Bài 19. Đại cương về kim loại chuyển tiếp thứ nhất trang 128, 129, 130 SBT Hóa 12 Chấn trời sáng tạo
- Bài Ôn tập chương 7. Nguyên tố nhóm IA và IIA trang 121, 122 SBT Hóa 12 Chân trời sáng tạo
- Bài 18. Nguyên tố nhóm IIA trang 114, 115, 116 SBT Hóa 12 Chân trời sáng tạo











