Bài 12. Thế điện cực và nguồn điện hóa học trang 82, 83, 84 SBT Hóa Chân trời sáng tạo
Trong Pin điện hoá, quá trình oxi hoá
12.1
Trong Pin điện hoá, quá trình oxi hoá
A. Chỉ xảy ra ở cực dương B. Chỉ xảy ra ở cực âm
C. Xảy ra ở cả hai cực D. Không xảy ra ở cả hai cực
Phương pháp giải:
Dựa vào quá trình trong pin điện hóa.
Lời giải chi tiết:
Trong pin điện hoá, ở điện cực âm (anode) xảy ra quá trình oxi hoá và ở điện cực dương (cathode) xảy ra quá trình khử ion.
→ Chọn đáp án B.
12.2
Cho Pin điện hoá Fe – Cu. Biết \(E_{F{e^{2 + }}/Fe}^0 = - {\rm{0,44V}}\); \(E_{C{u^{2 + }}/Cu}^0 = 0,34{\rm{V}}\)
sức điện động chuẩn của pin điện hoá Fe – Cu là
A. 1,66V B. 0,1V C. 0,78V D. 0,92V
Phương pháp giải:
Dựa vào công thức tính sức điện động của pin
Lời giải chi tiết:
\(E_{pin{\rm{ Fe - Cu}}}^o\)= E0(+) - E(-) = 0,34 – (-0,44) = 0,78V
→ Chọn đáp án C.
12.3
Cho Pin điện hoá Al – Pb. Biết \(E_{A{l^{3 + }}/Al}^o = - 1,66V;E_{P{b^{2 + }}/Pb}^o = - 0,13V\) Sức điện động của Pin điện hoá Al – Pb là
A. 1,79V B. -1,79V C. -1,53V D. 1,53V
Phương pháp giải:
Dựa vào công thức tính sức điện động của pin
Lời giải chi tiết:
\(E_{PinAl - Pb}^o = E_{P{b^{2 + }}/Pb}^o - E_{A{l^{3 + }}/Al}^o = - 0,13 - ( - 1,66) = 1,53V\)
Đáp án D
12.4
Cho E0Pin (Ni – Cu) = 0,59V và \(E_{C{u^{2 + }}/Cu}^0 = 0,34{\rm{V}}\). Thế điện cực chuẩn của cặp oxi hoá – khử Ni2+/Ni là (\(E_{N{i^{2 + }}/Ni}^o\)) là
A. 0,34V B. 0,35 V C. -0,35V D. -0,25V
Phương pháp giải:
Dựa vào công thức tính sức điện động của pin.
Lời giải chi tiết:
E0Pin Ni – Cu \( = E_{C{u^{2 + }}/Cu}^o - E_{N{i^{2 + }}/Ni}^o = 0,34 - E_{N{i^{2 + }}/Ni}^o = 0,59V\)
→\(E_{N{i^{2 + }}/Ni}^o\)= -0,25 V → Chọn đáp án D.
12.5
Cho Pin điện hoá Zn– Fe, xác định các chất ion đóng vai trò là chất khử, chất oxi hoá trong Pin:
A. Zn là chất khử, Fe2+ là chất oxi hoá B. Zn là chất oxi hoá, Fe2+ là chất khử
C. Zn2+ là chất khử, Felà chất oxi hoá D. Zn2+ là chất oxi hoá, Felà chất khử
Phương pháp giải:
Dựa vào nguyên tắc hoạt động của pin điện hóa.
Lời giải chi tiết:
Phản ứng hoá học xảy ra khi pin hoạt động:
Zn + Fe2+ → Zn2+ + Fe
→ Zn là chất khử, Fe2+ là chất oxi hoá
→ Chọn đáp án A.
12.6
Dãy các kin loại được sắp xếp theo chiều tính khử giảm dần
A. K > Ca > Mg > Cu > Fe > Al.
B. Ca > K > Mg > Cu > Fe > Al.
C. K > Ca > Mg > Al > Fe > Cu.
D. Ca > K > Cu > Mg> Fe > Al.
Phương pháp giải:
Dựa vào ý nghĩa của thế điện cực.
Lời giải chi tiết:
C đúng.
12.7
Dãy các ion được sắp xếp theo chiều tính oxi hoá giảm dần là
A. K+ > Mg2+ > Al3+ > Fe2+ > Cu2+.
B. Fe2+ > Cu2+ > K+ > Mg2+ > Al3+.
C. Cu2+ > Fe2+ > K+ > Mg2+> Al3+.
D. Cu2+ > Fe2+ > Al3+ > Mg2+> K+.
Phương pháp giải:
Dựa vào ý nghĩa của thế điện cực.
Lời giải chi tiết:
Đáp án D
12.8
Cho pin điện hoá Zn-Cu. Quá trình xảy ra ở cực dương của pin là
A. Zn2+ + 2e → Zn. B. Cu2+ + 2e → Cu.
C. Zn → Zn2+ + 2e. D. Cu → Cu2+ + 2e.
Phương pháp giải:
Dựa vào quá trình xảy ra ở pin điện hóa.
Lời giải chi tiết:
Tại cực dương của pin xảy ra quá trình khử Cu2+: Cu2+ + 2e → Cu.
Đáp án B
12.9
Cho pin điện hoá Al-Pb. Quá trình xảy ra ở cực âm của pin là
A. Al3+ + 3e →Al. B. Pb2+ + 2e →Pb.
C. Al → Al3+ + 3e. D. Pb → Pb2+ + 2e.
Phương pháp giải:
Dựa vào quá trình xảy ra ở pin điện hóa.
Lời giải chi tiết:
Tại cực âm của pin điện xảy ra quá trình oxi hóa Al: Al → Al3+ + 3e.
Đáp án C
12.10
Cho các kim loại: Al, Ag, Fe, Cu, Mg, Na, K, Zn. Hãy sắp xếp các kim loại trên theo thứ tự tính khử giảm dần.
Phương pháp giải:
Dựa vào dãy thế điện cực chuẩn của kim loại.
Lời giải chi tiết:
K >Na >Mg> Al >Zn> Fe >Cu >Ag.
12.11
Cho các cation kim loại: Ag+, Na+, Fe2+, Fe3+, Al3+, Cu2+, Mg2+. Hãy sắp xếp các cation kim loại trên theo thứ tự tính oxi hoá giảm dần.
Phương pháp giải:
Dựa vào dãy thế điện cực chuẩn của kim loại.
Lời giải chi tiết:
Ag+ > Fe3+ > Cu2+ > Fe2+ > Al3+ > Mg2+ > Na+
12.12
Cho các kim loại Al, Mg, Fe, Cu lần lượt tác dụng với lượng dư mỗi dung dịch' chứa lần lượt ion Fe3+, Cu2+, Ag+. Viết phương trình hoá học của các phản ứng xảy ra (nếu có).
Phương pháp giải:
Dựa vào ý nghĩa của dãy điện cực kim loại.
Lời giải chi tiết:
Phương trình hoá học của phản ứng:
- Với Al:
Al + 3Fe3+ → Al3+ + 3Fe2+
2Al + 3Cu2+ → 2Al3+ + 3Cu
Al + 3Ag+ → Al3+ + 3Ag
- Với Mg:
Mg + 2Fe3+ → Mg2+ + 2Fe2+
Mg + Cu2+ → Mg2+ + Cu
Mg + 2Ag+ → Mg2+ + 2Ag
- Với Fe:
Fe + 2Fe3+ → 3Fe2+
Fe + Cu2+ → Fe2+ + Cu
Fe + 2Ag+ → Fe2+ + 2Ag
Fe2+ + Ag+ → Fe3+ + Ag
- Với Cu:
Cu + 2Fe3+ → 2Fe2+ + Cu2+
Cu + 2Ag+ → Cu2+ + 2Ag
12.13
Cho các thí nghiệm sau, hãy điền vào chỗ trống:
a. Cho Mg tác dụng với dung dịch FeCl3 dư thu được dung dịch X.
Chất tan trong X gồm:
b. Cho Fe tác dụng với dung dịch AgNO3 dư thu được dung dịch Y.
Chất tan trong Y gồm:
c. Cho Mg, Al tác dụng với dung dịch Cu(NO3)2 thu được dung dịch Z chứa 2 muối.
Công thức của hai muối trong Z là
Phương pháp giải:
Dựa vào quá trình xảy ra trong pin điện.
Lời giải chi tiết:
a) Mg + 2Fe3+ → Mg2+ + 2Fe2+
Chất tan trong X gồm : MgCl2, FeCl2 và FeCl3 dư
b) Fe + 2Ag+ → Fe2+ + 2Ag
Fe2+ + Ag+ → Fe3+ + Ag
Chất tan trong Y gồm : Fe(NO3)3 và AgNO3 dư
c) Mg + Cu2+ → Mg2+ + Cu
2Al + 3Cu2+ → 2Al3+ + 3Cu
Dung dịch Z chứa 2 muối nên Cu2+ hết, chất tan trong Z gồm : Mg(NO3)2 và Al(NO3)3
12.14
Trong các hoạt động của pin điện hóa Al-Zn nồng độ của các ion trong dung dịch biến đổi như thế nào?
Phương pháp giải:
Dựa vào quá trình xảy ra trong pin điện hóa.
Lời giải chi tiết:
Trong các hoạt động của pin điện hóa Al-Zn nồng độ của các ion Al3+tăng dần, nồng độ của các ion Zn2+giảm dần trong dung dịch.
12.15
Cho sức điện động chuẩn của các pin điện hoá sau:
Epin(T-X) = 2,46 V; E°pin (T – Y) = 0,9 V; (với X, Y, Z, T là bốn kim loại). Hãy sắp xếp các kim loại
Phương pháp giải:
Dựa vào sức điện động chuẩn của pin điện.
Lời giải chi tiết:
Trong kí hiệu pin điện hóa, kim loại viết trước là cực âm, kim loại viết sau là cực dương( kim loại đóng vai trò là cực âm có tính khử mạnh hơn kim loại đóng vai trò là cực dương. Do đó tính khử T > X, T > Y, Z > Y.
Tính khử của Y mạnh hơn của X
Vậy tính khử tăng dần theo thứ tự từ trái sang phải là X,Y,Z,T.
12.16
Khi nhúng một lá kẽm vào dung dịch muối Cu2+, sau một thời gian nhận thấy có một lớp kim loại đồng phủ ngoài lá kẽm. Khi nhúng lá chì vào dung dịch muối Cu2+ cũng sau một thời gian như trên, không nhận thấy hiện tượng nào xảy ra. Sắp xếp các cặp oxi hóa – khử của những kim loại trên theo chiều tăng dần tính oxi hóa của cation.
Phương pháp giải:
Dựa vào thế điện cực chuẩn của kim loại.
Lời giải chi tiết:
Các cặp oxi hóa – khử của những kim loại trên theo chiều tăng dần tính oxi hóa của cation tăng dần từ trái sang phải là: Zn2+/Zn, Co2+/Co, Pb2+/Pb.
12.17
Cho sức điện động chuẩn của các pin điện hoá sau:
Epin(Cu-X) = 0,46 V; E°pin (Y – Cu) = 2,71 V; E°pin(Z- Cu) = 0,78 V (với X, Y, Z là ba kim loại). Hãy sắp xếp các kim loại X, Y, Z trên theo chiều tăng dần tính khử.
Phương pháp giải:
Dựa vào thế điện cực chuẩn của kim loại.
Lời giải chi tiết:
E0 (Cu - X) = 0,46V > 0 → Tính khử của X < Cu
E0 (Y - Cu) = 2,71V > E0 (Z - Cu) = 0,78V > 0 → Tính khử của Y > Z > Cu.
→ tính khử tăng dần theo chiều X, Cu, Z, Y.
12.18
Cho giá trị thế điện cực chuẩn của một số cặp oxi hoá - khử:
\(E_{F{e^{2 + }}/Fe}^0 = - {\rm{0,44V}}\); \(E_{Z{n^{2 + }}/Zn}^0 = - {\rm{0,76V}}\);\(E_{C{u^{2 + }}/Cu}^0 = 0,34{\rm{V}}\); \(E_{A{g^ + }/Ag}^0 = 0,8{\rm{V}}\)
Hãy cho biết ion nào có thể oxi hoá được kim loại Fe.
Phương pháp giải:
Dựa vào sức điện động của pin.
Lời giải chi tiết:
Chất khử của cặp oxi hoá - khử có thế điện cực nhỏ hơn tác dụng với chất oxi hoá của cặp oxi hoá - khử có thế điện cực lớn hơn, tạo ra dạng oxi hoá và dạng khử tương ứng mà
\(E_{F{e^{2 + }}/Fe}^0 = - {\rm{0,44V}}\) < \(E_{C{u^{2 + }}/Cu}^0 = 0,34{\rm{V}}\) nên ion Cu2+ oxi hóa được kim loại Fe theo pư
Fe + Cu2+ → Fe2+ + Cu (thỏa mãn quy tắc α)
\(E_{F{e^{2 + }}/Fe}^0 = - {\rm{0,44V}}\) < \(E_{A{g^ + }/Ag}^0 = 0,8{\rm{V}}\)nên ion Ag+ oxi hóa được kim loại Fe theo pư
Fe + 2Ag+ → Fe2+ + 2Ag (thỏa mãn quy tắc α)
12.19
Cho \(E_{C{u^{2 + }}/Cu}^0 = 0,34{\rm{V}}\). Quan sát thí nghiệm như hình bên dưới và tính thế điện cực chuẩn của Zn2+/Zn.
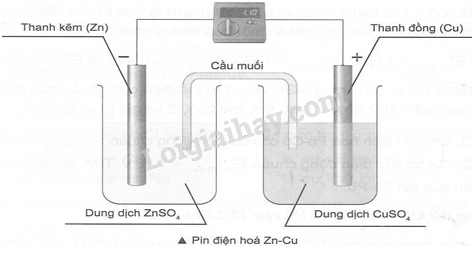
Phương pháp giải:
Dựa vào công thức tính sức điện động của pin.
Lời giải chi tiết:
Cathode của pin điện hoá: Cu, anode của pin điện hoá: Zn.
Vậy sức điện động chuẩn của pin là:
\(\begin{array}{l}E_{{\rm{pin Zn - Cu}}}^0 = E_{C{u^{2 + }}/Cu}^0 - E_{Z{n^{2 + }}/Zn}^0{\rm{ = 0,34 - }}E_{Z{n^{2 + }}/Zn}^0{\rm{ = 1,1}}\\ \to E_{Z{n^{2 + }}/Zn}^0 = - 0,76V\end{array}\)
12.20
Cho biết giá trị thế điện cực của một số cặp oxi hoá- khử như sau: \(E_{Z{n^{2 + }}/Zn}^o = - 0,76V\); \(E_{P{b^{2 + }}/Pb}^o = - 0,13V\); \(E_{C{u^{2 + }}/Cu}^o = 0,34V\).
Hãy dự đoán hiện tượng xảy ra khi:
a) Trộn dung dịch lead (II) nitrat với dung dịch copper (II) nitrat.
b) Nhúng một lá chì vào dung dịch copper (II) nitrat.
c) Nhúng một lá đồng vào dung dịch lead (II) nitrat.
d) Nhúng một lá kẽm trong dung dịch copper (II) nitrat và lead (II) nitrat.
Viết các phương trình hoá học xảy ra (nếu có)
Phương pháp giải:
Dựa vào quá trình xảy ra trong pin điện.
Lời giải chi tiết:
a) Pb(NO3)2 + Cu(NO3)2 \( \to \)Phản ứng không xảy ra, không hiện tượng
b) Phản ứng xảy ra
Pb + Cu(NO3)2 \( \to \) Pb(NO3)2 + Cu \( \downarrow \)
Hiện tượng: Màu xanh lam của dung dịch nhạt dần, đồng thời có kết tủa màu đỏ
c) Pb(NO3)2 + Cu\( \to \) phản ứng không xảy ra, không hiện tượng
d) Phản ứng xảy ra theo thứ tự
Zn + Cu(NO3)2 \( \to \) Zn(NO3)2 + Cu \( \downarrow \)
Zn + Pb(NO3)2 \( \to \) Zn(NO3)2 + Pb \( \downarrow \)
Hiện tượng: Màu xanh lam của dung dịch nhạt dần, đồng thời có kết tủa
12.21
Cho biết giá trị thế điện cực chuẩn của một số cặp oxi hoá – khử như sau:
\(E_{{M^{2 + }}/M}^o = - 2,37V\); \(E_{{X^{2 + }}/X}^o = - 0,44V\); \(E_{{Y^{2 + }}/Y}^o = - 0,76V\); \(E_{{Z^{2 + }}/Z}^o = 0,34V\). Viết phương trình hoá học phản ứng có thể xảy ra khi cho mỗi kim loại (M, X, Y, Z) phản ứng với từng dung dịch chứa các ion tương ứng của từng kim loại đó
Phương pháp giải:
Dựa vào công thức tính sức điện động của pin.
Lời giải chi tiết:
Theo thứ tự dãy điện hoá M2+/M; Y2+/Y; X2+/X; Z2+/Z
- Cho M vào các dung dịch chứa X2+, Y2+, Z2+ . Có 3 phản ứng
M + Z2+ \( \to \) M2+ + Z
M + Y2+ \( \to \) M2+ + Y
M + X2+ \( \to \) M2+ + X
- Cho X vào các dung dịch chứa M2+, Y2+, Z2+. Có 1 phản ứng
X + Z2+ \( \to \) X2+ + Z
- Cho Y vào các dung dịch chứa M2+, X2+, Z2+. Có 2 phản ứng
Y + X2+ \( \to \) Y2+ + X
Y + Z2+ \( \to \) Y2+ + Z
- Cho Z vào các dung dịch chứa M2+, X2+, Y2+. Không có phản ứng nào xảy ra.
12.22
Có 3 kim loại X, Y, Z và a, b, c lần lượt là hóa trị của các kim loại đó (biết rằng mỗi kim loại có một hóa trị duy nhất).
Cho E°pin(X-Ag) = 1,56 V; E°pin (Y – Ag) = 1,05 V; E°pin(Z- Ag) = 0,94 V và \(E_{A{g^ + }/Ag}^0 = 0,80{\rm{V}}\) . Sử dụng bảng 12.1 trong SGK về giá trị thế điện cực chuẩn của một số cặp oxi hóa – khử để xác định kim loại X, Y, Z và giá trị a, b, c.
Phương pháp giải:
Dựa vào công thức tính sức điện động của pin.
Lời giải chi tiết:
Ta có: E°pin(X-Ag) = \(E_{A{g^ + }/Ag}^0 - E_{{X^{a + }}/X}^0 = 1,56V\)
\( \to \) 0,80 - \(E_{{X^{a + }}/X}^0 = 1,56\)
=> \(E_{{X^{a + }}/X}^0 = 0,80 - 1,56\)= -0,76 (V)
Tương tự: E°pin(Y-Ag) = \(E_{A{g^ + }/Ag}^0 - E_{{Y^{b + }}/Y}^0 = 1,05V\)
\( \to \)0,80 - \(E_{{Y^{b + }}/Y}^0 = 1,05\)
\( \to \)\(E_{{Y^{b + }}/Y}^0 = 0,80 - 1,05\)= -0,25 (V)
\( \to \)E°pin(Z-Ag) = \(E_{A{g^ + }/Ag}^0 - E_{{Z^{c + }}/Z}^0 = 0,94V\)
\( \to \)0,80 - \(E_{{Z^{c + }}/Z}^0 = 0,94\)
=> \(E_{{Z^{c + }}/Z}^0 = 0,80 - 0,94\)= -0,14 (V)
Vậy X, Y, Z lần lượt là Zn, Ni, Sn và các giá trị a, b, c đều bằng 2.
12.23
Cho pin điện hóa Pb – Cu có sức điện động chuẩn E°pin (Pb – Cu) = 0,47 V, pin
Zn – Cu có sức điện động chuẩn E°pin (Zn – Cu) = 1,10 V. Tính sức điện động chuẩn của pin Zn – Pb.
Phương pháp giải:
Dựa vào công thức tính sức điện động chuẩn của pin.
Lời giải chi tiết:
Ta có: E°pin (Pb – Cu) = \(E_{C{u^{2 + }}/Cu}^0 - E_{P{b^{2 + }}/Pb}^0 = 0,47V\)
E°pin (Zn – Cu) = \(E_{C{u^{2 + }}/Cu}^0 - E_{Z{n^{2 + }}/Zn}^0 = 1,10V\)
=> E°pin (Zn – Pb) = \(E_{P{b^{2 + }}/Pb}^0 - E_{Z{n^{2 + }}/Zn}^0 = E{^\circ _{pin{\rm{ }}(Zn{\rm{ }}--{\rm{ }}Cu)}} - E{^\circ _{pin{\rm{ }}(Pb{\rm{ }}--{\rm{ }}Cu)}} = 1,10 - 0,47 = 0,63\) (V)
Vậy sức điện động chuẩn của pin Zn – Pb là 0,63 V.
12.24
Dùng dữ kiện sau để trả lời câu 12.24 và 12.25:
Cho hỗn hợp gồm Fe và Zn vào hỗn hợp dung dịch AgNO3 và Cu(NO3)2 đến khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X gồm 2 muối và chất rắn Y gồm 2 kim loại.
Xác định công thức hóa học của 2 muối trong dung dịch X
Phương pháp giải:
Dựa vào ý nghĩa của thế điện cực chuẩn.
Lời giải chi tiết:
Hai muối trong dung dịch X là Zn(NO3)2 và Fe(NO3)2 vì Fe và Zn có khả năng đẩy được Cu2+ và Ag+ ra khỏi dung dịch. Nên muốn thu được 2 muối thì Cu2+ và Ag+ phản ứng hết.
12.25
Xác định hai kim loại trong chất rắn Y
Phương pháp giải:
Dựa vào ý nghĩa của thế điện cực chuẩn.
Lời giải chi tiết:
Chất rắn Y bao gồm Ag và Fe dư( do Zn có tính khử mạnh hơn Fe nên ưu tiên phản ứng trước).
Luyện Bài Tập Trắc nghiệm Hóa 12 - Chân trời sáng tạo - Xem ngay
Các bài khác cùng chuyên mục
- Bài Ôn tập chương 8. Sơ lược về dãy kim loại chuyển tiếp thứ nhất và phức chất trang 136, 137 SBT Hóa 12 Chân trời sáng tạo
- Bài 20. Sơ lược về phức chất và sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch trang 132, 133, 134 SBT Hóa 12 Chân trời sáng tạo
- Bài 19. Đại cương về kim loại chuyển tiếp thứ nhất trang 128, 129, 130 SBT Hóa 12 Chấn trời sáng tạo
- Bài Ôn tập chương 7. Nguyên tố nhóm IA và IIA trang 121, 122 SBT Hóa 12 Chân trời sáng tạo
- Bài 18. Nguyên tố nhóm IIA trang 114, 115, 116 SBT Hóa 12 Chân trời sáng tạo
- Bài Ôn tập chương 8. Sơ lược về dãy kim loại chuyển tiếp thứ nhất và phức chất trang 136, 137 SBT Hóa 12 Chân trời sáng tạo
- Bài 20. Sơ lược về phức chất và sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch trang 132, 133, 134 SBT Hóa 12 Chân trời sáng tạo
- Bài 19. Đại cương về kim loại chuyển tiếp thứ nhất trang 128, 129, 130 SBT Hóa 12 Chấn trời sáng tạo
- Bài Ôn tập chương 7. Nguyên tố nhóm IA và IIA trang 121, 122 SBT Hóa 12 Chân trời sáng tạo
- Bài 18. Nguyên tố nhóm IIA trang 114, 115, 116 SBT Hóa 12 Chân trời sáng tạo












