 Đề thi hóa 11, đề kiểm tra hóa 11 cánh diều có đáp án và lời giải chi tiết
Đề thi hóa 11, đề kiểm tra hóa 11 cánh diều có đáp án và lời giải chi tiết
 Đề thi giữa kì 1 Hóa 11 - Chân trời sáng tạo
Đề thi giữa kì 1 Hóa 11 - Chân trời sáng tạo Đề thi giữa kì 1 Hóa 11 Chân trời sáng tạo - Đề số 6
Đồ thị dưới đây biểu diễn sự thay đổi tốc độ phản ứng thuận và phản ứng nghịch theo thời gian của phản ứng: A(g) ⇌ B(g). Đường nào dưới đây biểu diễn sự thay đổi tốc độ phản ứng thuận và phản ứng nghịch?
Đề thi
Câu 1: Đồ thị dưới đây biểu diễn sự thay đổi tốc độ phản ứng thuận và phản ứng nghịch theo thời gian của phản ứng: A(g) ⇌ B(g). Đường nào dưới đây biểu diễn sự thay đổi tốc độ phản ứng thuận và phản ứng nghịch?
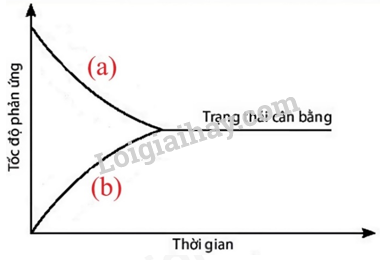
Hình 1.5. Đồ thị biểu diễn sự thay đổi tốc độ phản ứng thuận và phản ứng nghịch theo thời gian
A. Đường (a) biểu diễn sự thay đổi tốc độ phản ứng thuận và đường (b) biểu diễn sự thay đổi tốc độ phản ứng nghịch.
B. Đường (a) biểu diễn sự thay đổi tốc độ phản ứng nghịch và đường (b) biểu diễn sự thay đổi tốc độ phản ứng thuận.
C. Cả 2 đường (a) và (b) đều biểu diễn sự thay đổi tốc độ phản ứng thuận.
D. Cả 2 đường (a) và (b) đều không biểu diễn sự thay đổi tốc độ phản ứng thuận.
Câu 2: Cho các nhận xét sau:
(a) Ở trạng thái cân bằng, tốc độ phản ứng thuận bằng tốc độ phản nghịch.
(b) Ở trạng thái cân bằng, các chất không phản ứng với nhau.
(c) Ở trạng thái cân bằng, nồng độ chất sản phẩm luôn lớn hơn nồng độ chất ban đầu.
(d) Ở trạng thái cân bằng, nồng độ các chất không thay đổi.
Các nhận xét đúng là
A. (a) và (b). B. (b) và (c). C. (a) và (c). D. (a) và (d).
Câu 3: Hằng số cân bằng của phản ứng N2O4(g) ⇌ 2NO2(g) ở 2 °C là KC = 2,0. Nếu mỗi quả cầu màu vàng (  ) đại diện cho 1 mol N2O4 và mỗi quả cầu màu nâu là 1 mol NO2 (
) đại diện cho 1 mol N2O4 và mỗi quả cầu màu nâu là 1 mol NO2 (  ) thì bình chứa 1,0 L nào sau đây đại diện cho hỗn hợp cân bằng ở 2 °C?
) thì bình chứa 1,0 L nào sau đây đại diện cho hỗn hợp cân bằng ở 2 °C?
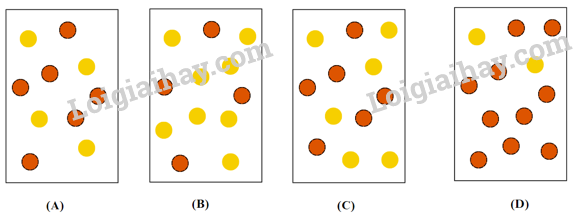
A. Hình A. B. Hình B. C. Hình C. D. Hình D.
Câu 4: Cân bằng nào dưới đây có sự chuyển dịch khi thay đổi áp suất của hệ phản ứng?
A. 2HI(g) ⇌ H2(g) + I2(g) B. FeO(s) + CO(g) ⇌ Fe(s) + CO2(g)
C. CaCO3(s) ⇌ CaO(s) + CO2(g) D. H2O(g) + CO(g) ⇌ CO2(g) + H2(g)
Câu 5: Ở nhiệt độ không đổi, hệ cân bằng nào sẽ chuyển dịch về bên phải nếu tăng áp suất chung của hệ?
A. H2(g)+ Cl2(g)⇌ 2HCl(g) B. 2H2 (g)+ O2 (g)⇌ 2H2O(g)
C. 2CO2(g) ⇌ 2CO(g)+ O2(g) D. H2(g)+ F2(g)⇌ 2HF(g)
Câu 6: Cho cân bằng sau trong bình kín: 2NO2(màu nâu đỏ) ⇌ N2O4 (không màu). Biết khi hạ nhiệt độ của bình thì màu nâu đỏ nhạt dần. Phản ứng thuận có
A. \({\Delta _r}H_{298}^o\) < 0, phản ứng toả nhiệt. B. \({\Delta _r}H_{298}^o\) > 0, phản ứng toả nhiệt.
C. \({\Delta _r}H_{298}^o\) < 0, phản ứng thu nhiệt. D. \({\Delta _r}H_{298}^o\) > 0, phản ứng thu nhiệt.
Câu 7: Khi đun nóng HI trong một bình kín, xảy ra phản ứng sau:
2HI(g) ⇌ H2(g) + I2 (g) ∆H0298 > 0
Ở to C hằng số cân bằng KC của phản ứng bằng \(\frac{1}{{81}}\). Phần trăm HI bị phân hủy ở nhiệt độ trên là
A. 18,18%. B. 36,67%. C. 33,33%. D. 66,67%.
Câu 8: Trong dung dịch nitric acid (bỏ qua sự phân li của H2O) có những phần tử nào?
A. H+, NO3-. B. H+, NO3-, H2O. C. H+, NO3-, HNO3. D. H+, NO3-, HNO3, H2O.
Câu 9: Dung dịch thu được khi trộn lẫn 200 mL dung dịch NaCl 0,2 M và 300 mL dung dịch Na2SO4 0,2 M có nồng độ cation Na+ là bao nhiêu?
A. 0,23 M. B. 1 M. C. 0,32 M. D. 0,1 M.
Câu 10: Dung dịch X gồm: 0,09 mol Cl− ,0,04 mol Na+, a mol Fe3+ và b mol SO42-. Khi cô cạn X thu được 7,715 gam muối khan. Giá trị của a và b lần lượt là
A. 0.05 và 0,05. B. 0,03 và 0,02. C. 0,07 và 0,08. D. 0,018 và 0,027.
Câu 11: Phát biểu nào sau đây không đúng khi nói về ammonia?
A. Trong công nghiệp, ammonia thường được sử dụng với vai trò chất làm lạnh (chất sinh hàn).
B. Do có hàm lượng nitrogen cao (82,35%) theo khối lượng) nên ammonia được sử dụng làm phân đạm rất hiệu quả.
C. Phần lớn ammonia được dùng phản ứng với acid để sản xuất các loại phân đạm.
D. Quá trình tổng hợp ammonia từ nitrogen và hydrogen là quá trình thuận nghịch nên không thể đạt hiệu suất 100%.
Câu 12: Hiện tượng khi cho quỳ tím ẩm vào bình chứa khí ammonia là
A. quỳ tím chuyển màu đỏ. B. quỳ tím chuyển màu vàng.
C. quỳ tím chuyển màu xanh. D. quỳ tím không chuyển màu.
Câu 13: Hiện tượng xả ra khi để hai ống nghiệm chứa lần lượt dung dịch HCl và dung dịch NH3 đặc gần nhau là
A. xuất hiện khói trắng. B. xuất hiện khói vàng.
C. xuất hiện khói màu đen. D. xuất hiện khói màu nâu.
Câu 14: Chất nào dưới đây tác dụng với dung dịch HNO3 không xảy ra phản ứng oxi hóa – khử?
A. Cu. B. Fe. C. CuO. D. FeO.
Câu 15: Để m gam Fe ngoài không khí, sau một thời gian thu được hỗn hợp A có khối lượng 12 gam gồm: FeO, Fe2O3, Fe3O4 và Fe. Hòa tan hết A bằng dung dịch HNO3 thu được 2,479 lít NO (đkc, sản phẩm khử duy nhất). Giá trị của m là
A. 10,08. B. 9,02. C. 11,2. D. 14,0.
Câu 16: Cho phản ứng: Al + H2SO4đặc ⟶ Al2(SO4)3 + SO2 + H2O. Hệ số cân bằng của H2SO4 là
A. 4. B. 8. C. 6. D. 3.
Câu 17: Trong số các tính chất sau, tính chất nào không là tính chất của sulfuric acid đặc, nguội?
A. Tan trong nước, tỏa nhiệt. B. Làm hóa than vải, giấy, đường.
C. Hòa tan được kim loại Al và Fe. D. Háo nước.
Câu 18: Sulfuric acid đặc nguội có thể đựng trong bình chứa làm bằng
A. Cu. B. Ag. C. Ca. D. Al.
Câu 19: Cho các chất: Cu, CuO, BaSO4, Mg, KOH, C, Na2CO3. Tổng số chất tác dụng với dung dịch H2SO4 đặc, nóng là
A. 4. B. 5. C. 6. D. 7.
Câu 20: Khi làm thí nghiệm với H2SO4 đặc, nóng thường sinh ra khí SO2. Để hạn chế tốt nhất khí SO2 thoát ra gây ô nhiễm môi trường, người ta nút ống nghiệm bằng bông tẩm dung dịch nào sau đây?
A. Giấm ăn. B. Muối ăn. C. Cồn. D. Xút.
----- HẾT -----
Đáp án
|
1.A |
2.D |
3.B |
4.C |
5.B |
6.A |
7.A |
8.B |
9.C |
10.B |
|
11.D |
12.B |
13.A |
14.C |
15.A |
16.C |
17.C |
18.D |
19.B |
20.D |
Câu 1: Đồ thị dưới đây biểu diễn sự thay đổi tốc độ phản ứng thuận và phản ứng nghịch theo thời gian của phản ứng: A(g) ⇌ B(g). Đường nào dưới đây biểu diễn sự thay đổi tốc độ phản ứng thuận và phản ứng nghịch?
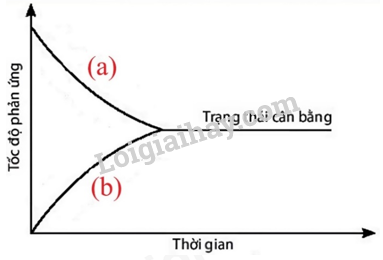
Hình 1.5. Đồ thị biểu diễn sự thay đổi tốc độ phản ứng thuận và phản ứng nghịch theo thời gian
A. Đường (a) biểu diễn sự thay đổi tốc độ phản ứng thuận và đường (b) biểu diễn sự thay đổi tốc độ phản ứng nghịch.
B. Đường (a) biểu diễn sự thay đổi tốc độ phản ứng nghịch và đường (b) biểu diễn sự thay đổi tốc độ phản ứng thuận.
C. Cả 2 đường (a) và (b) đều biểu diễn sự thay đổi tốc độ phản ứng thuận.
D. Cả 2 đường (a) và (b) đều không biểu diễn sự thay đổi tốc độ phản ứng thuận.
Phương pháp giải
Dựa vào lý thuyết về cân bằng hoá học.
Lời giải chi tiết
Đường (a) biểu diễn sự thay đổi tốc độ phản ứng thuận và đường (b) biểu diễn sự thay đổi tốc độ phản ứng nghịch.
Chọn A.
Câu 2: Cho các nhận xét sau:
(a) Ở trạng thái cân bằng, tốc độ phản ứng thuận bằng tốc độ phản nghịch.
(b) Ở trạng thái cân bằng, các chất không phản ứng với nhau.
(c) Ở trạng thái cân bằng, nồng độ chất sản phẩm luôn lớn hơn nồng độ chất ban đầu.
(d) Ở trạng thái cân bằng, nồng độ các chất không thay đổi.
Các nhận xét đúng là
A. (a) và (b). B. (b) và (c). C. (a) và (c). D. (a) và (d).
Phương pháp giải
Dựa vào lý thuyết về cân bằng hoá học.
Lời giải chi tiết
a), d) đúng.
b) sai, vì ở trạng thái cân bằng các chất có phản ứng với nhau.
c) sai.
Chọn D.
Câu 3: Hằng số cân bằng của phản ứng N2O4(g) ⇌ 2NO2(g) ở 2 °C là KC = 2,0. Nếu mỗi quả cầu màu vàng (  ) đại diện cho 1 mol N2O4 và mỗi quả cầu màu nâu là 1 mol NO2 (
) đại diện cho 1 mol N2O4 và mỗi quả cầu màu nâu là 1 mol NO2 ( ) thì bình chứa 1,0 L nào sau đây đại diện cho hỗn hợp cân bằng ở 2 °C?
) thì bình chứa 1,0 L nào sau đây đại diện cho hỗn hợp cân bằng ở 2 °C?
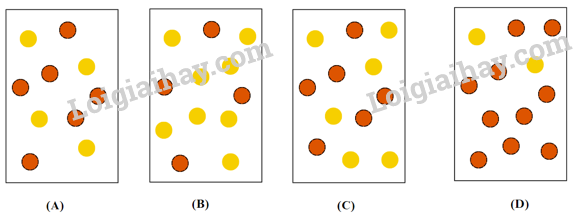
A. Hình A. B. Hình B. C. Hình C. D. Hình D.
Phương pháp giải
Dựa vào lý thuyết về cân bằng hoá học.
Lời giải chi tiết
Giả sử ban đầu hỗn hợp có nồng độ N2O4 là 1 M. Ta có:
N2O4(g) ⇌ 2NO2(g)
Ban đầu: 1 M
P/ư x M 2x M
CB 1 - x 2x
Ta có: \({K_C} = \frac{{{{[N{O_2}]}^2}}}{{[{N_2}{O_4}]}} = \frac{{{{(2x)}^2}}}{{(1 - x)}} = 2 = {\rm{ \;}} > x = 0,5\).
Vậy tại thời điểm cân bằng nồng độ của N2O4 là 0,5 M, của NO2 là 1 M. Vậy hỗn hợp tại thời điểm cân bằng số phân tử NO2 luôn gấp đôi N2O4 ⟹ Hình B thỏa mãn.
Chọn B.
Câu 4: Cân bằng nào dưới đây có sự chuyển dịch khi thay đổi áp suất của hệ phản ứng?
A. 2HI(g) ⇌ H2(g) + I2(g) B. FeO(s) + CO(g) ⇌ Fe(s) + CO2(g)
C. CaCO3(s) ⇌ CaO(s) + CO2(g) D. H2O(g) + CO(g) ⇌ CO2(g) + H2(g)
Phương pháp giải
Dựa vào lý thuyết về cân bằng hoá học.
Lời giải chi tiết
Trong phản ứng A, B, D do số mol phân tử khí ở hai vế bằng nhau nên áp suất không ảnh hưởng đến cân bằng hóa học.
Chọn C.
Câu 5: Ở nhiệt độ không đổi, hệ cân bằng nào sẽ chuyển dịch về bên phải nếu tăng áp suất chung của hệ?
A. H2(g)+ Cl2(g)⇌ 2HCl(g) B. 2H2 (g)+ O2 (g)⇌ 2H2O(g)
C. 2CO2(g) ⇌ 2CO(g)+ O2(g) D. H2(g)+ F2(g)⇌ 2HF(g)
Phương pháp giải
Dựa vào lý thuyết về cân bằng hoá học.
Lời giải chi tiết
A và D không chuyển dịch vì số mol phân tử khí ở 2 vế bằng nhau.
Khi tăng áp suất cân bằng tại ý C chuyển dịch sang trái (chiều nghịch).
Khi tăng áp suất, cân bằng tại ý B sẽ chuyển dịch theo chiều làm giảm số mol khí, CBCD sang phải (chiều thuận).
Chọn B.
Câu 6: Cho cân bằng sau trong bình kín: 2NO2(màu nâu đỏ) ⇌ N2O4 (không màu). Biết khi hạ nhiệt độ của bình thì màu nâu đỏ nhạt dần. Phản ứng thuận có
A. \(_r\Delta H_{298}^o\) < 0, phản ứng toả nhiệt. B. \(_r\Delta H_{298}^o\) > 0, phản ứng toả nhiệt.
C. \(_r\Delta H_{298}^o\) < 0, phản ứng thu nhiệt. D. \(_r\Delta H_{298}^o\) > 0, phản ứng thu nhiệt.
Phương pháp giải
Dựa vào lý thuyết về cân bằng hoá học.
Lời giải chi tiết
Phản ứng thuận có \({\Delta _r}H_{298}^o\) < 0, phản ứng toả nhiệt.
Chọn A.
Câu 7: Khi đun nóng HI trong một bình kín, xảy ra phản ứng sau:
2HI(g) ⇌ H2(g) + I2 (g) ∆H0298 > 0
Ở to C hằng số cân bằng KC của phản ứng bằng \(\frac{1}{{81}}\). Phần trăm HI bị phân hủy ở nhiệt độ trên là
A. 18,18%. B. 36,67%. C. 33,33%. D. 66,67%.
Phương pháp giải
Dựa vào lý thuyết về cân bằng hoá học.
Lời giải chi tiết
Ta có:
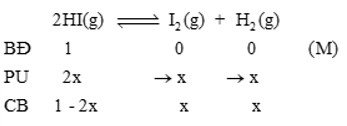
\({K_C} = \frac{{[{H_2}].[{I_2}]}}{{{{[HI]}^2}}} \Rightarrow \frac{{x.x}}{{{{(1 - 2x)}^2}}} = \frac{1}{{81}} \Rightarrow x = {\rm{0}},{\rm{0909}}\)
%HI bị phân hủy = \(\frac{{{C_{H{I_{(pu)}}}}}}{{{C_{H{I_{(bd)}}}}}}.100\% {\rm{ \;}} = \frac{{2x}}{1}.100\% {\rm{ \;}} = \frac{{2.0,0909}}{1}.100\% {\rm{ \;}} = 18,18\% \)
Chọn A.
Câu 8: Trong dung dịch nitric acid (bỏ qua sự phân li của H2O) có những phần tử nào?
A. H+, NO3-. B. H+, NO3-, H2O. C. H+, NO3-, HNO3. D. H+, NO3-, HNO3, H2O.
Phương pháp giải
Dựa vào lý thuyết về sự điện li.
Lời giải chi tiết
Trong dung dịch nitric acid (bỏ qua sự phân li của H2O) có những phần tử H+, NO3-, H2O.
Chọn B.
Câu 9: Dung dịch thu được khi trộn lẫn 200 mL dung dịch NaCl 0,2 M và 300 mL dung dịch Na2SO4 0,2 M có nồng độ cation Na+ là bao nhiêu?
A. 0,23 M. B. 1 M. C. 0,32 M. D. 0,1 M.
Phương pháp giải
Dựa vào lý thuyết về sự điện li.
Lời giải chi tiết
NaCl ⟶ Na+ + Cl-
Na2SO4 ⟶ 2Na+ + SO42-
nNa+ = 0,2.0,2 + 0,2.2.0,3 = 0,16 (mol)
⟹ CNa+ = 0,16/0,5 = 0,32 M
Chọn C.
Câu 10: Dung dịch X gồm: 0,09 mol Cl− ,0,04 mol Na+, a mol Fe3+ và b mol SO42-. Khi cô cạn X thu được 7,715 gam muối khan. Giá trị của a và b lần lượt là
A. 0.05 và 0,05. B. 0,03 và 0,02. C. 0,07 và 0,08. D. 0,018 và 0,027.
Phương pháp giải
Dựa vào lý thuyết về định luật bảo toàn điện tích.
Lời giải chi tiết
Theo bảo toàn điện tích: 3a + 0,04 = 0,09 + 2b (1)
Theo bảo toàn khối lượng: 56a + 0,04.23 + 0,09.35,5 + 96b = 7,715 (2)
Giải hệ (1) và (2) ⇒ a = 0,03 và b = 0,02.
Chọn B.
Câu 11: Phát biểu nào sau đây không đúng khi nói về ammonia?
A. Trong công nghiệp, ammonia thường được sử dụng với vai trò chất làm lạnh (chất sinh hàn).
B. Do có hàm lượng nitrogen cao (82,35%) theo khối lượng) nên ammonia được sử dụng làm phân đạm rất hiệu quả.
C. Phần lớn ammonia được dùng phản ứng với acid để sản xuất các loại phân đạm.
D. Quá trình tổng hợp ammonia từ nitrogen và hydrogen là quá trình thuận nghịch nên không thể đạt hiệu suất 100%.
Phương pháp giải
Kiến thức về ammonia.
Lời giải chi tiết
D sai, vì quá trình tổng hợp ammonia từ nitrogen và hydrogen là quá trình một chiều.
Chọn D.
Câu 12: Hiện tượng khi cho quỳ tím ẩm vào bình chứa khí ammonia là
A. quỳ tím chuyển màu đỏ. B. quỳ tím chuyển màu vàng.
C. quỳ tím chuyển màu xanh. D. quỳ tím không chuyển màu.
Phương pháp giải
Lý thuyết về tính chất hóa học của ammonia.
Lời giải chi tiết
Ammonia có tính base nên làm quỳ tím chuyển xanh.
Chọn B.
Câu 13: Hiện tượng xả ra khi để hai ống nghiệm chứa lần lượt dung dịch HCl và dung dịch NH3 đặc gần nhau là
A. xuất hiện khói trắng. B. xuất hiện khói vàng.
C. xuất hiện khói màu đen. D. xuất hiện khói màu nâu.
Phương pháp giải
Lý thuyết về tính chất hóa học của ammonia.
Lời giải chi tiết
HCl + NH3 ⟶ NH4Cl trắng
Chọn A.
Câu 14: Chất nào dưới đây tác dụng với dung dịch HNO3 không xảy ra phản ứng oxi hóa – khử?
A. Cu. B. Fe. C. CuO. D. FeO.
Phương pháp giải
Lý thuyết về tính chất hóa học của nitric acid.
Lời giải chi tiết
Chất tác dụng với HNO3 không xảy ra phản ứng oxi hóa – khử khi nguyên tử trong nguyên tố đó đã đạt trạng thái hóa trị cao nhất.
CuO + 2HNO3 ⟶ Cu(NO3)2 + H2O
Chọn C.
Câu 15: Để m gam Fe ngoài không khí, sau một thời gian thu được hỗn hợp A có khối lượng 12 gam gồm: FeO, Fe2O3, Fe3O4 và Fe. Hòa tan hết A bằng dung dịch HNO3 thu được 2,479 lít NO (đkc, sản phẩm khử duy nhất). Giá trị của m là
A. 10,08. B. 9,02. C. 11,2. D. 14,0.
Phương pháp giải
Bảo toàn electron.
Lời giải chi tiết
Sơ đồ:
\(m(g)Fe + {O_2} \to 12(g)A\left\{ {\begin{array}{*{20}{l}}{KL}\\{Oxide}\end{array}} \right. + HN{O_3}du \to Fe{(N{O_3})_3} + 0,1(mol)NO + {H_2}O\)
mA = mFe + mO2 = 56.x + 32.y
BTe: 3x = 4.y + 3.0,1
⟹ x = 0,18 (mol); y = 0,06 (mol).
⟹ mFe = 0,18.56 = 10,08 (g)
Chọn A.
Câu 16: Cho phản ứng: Al + H2SO4đặc ⟶ Al2(SO4)3 + SO2 + H2O. Hệ số cân bằng của H2SO4 là
A. 4. B. 8. C. 6. D. 3.
Phương pháp giải
Cân bằng phản ứng oxi hóa - khử.
Lời giải chi tiết
2Al + 6H2SO4đặc ⟶ Al2(SO4)3 + 3SO2 + 6H2O
Chọn C.
Câu 17: Trong số các tính chất sau, tính chất nào không là tính chất của sulfuric acid đặc, nguội?
A. Tan trong nước, tỏa nhiệt. B. Làm hóa than vải, giấy, đường.
C. Hòa tan được kim loại Al và Fe. D. Háo nước.
Phương pháp giải
Lý thuyết về tính chất hóa học của H2SO4 đặc, nguội.
Lời giải chi tiết
Al, Fe bị thụ động hóa trong H2SO4 đặc, nguội.
Chọn C.
Câu 18: Sulfuric acid đặc nguội có thể đựng trong bình chứa làm bằng
A. Cu. B. Ag. C. Ca. D. Al.
Phương pháp giải
Lý thuyết về tính chất hóa học của sulfuric acid đặc, nguội.
Lời giải chi tiết
Sử dụng những bình có chất liệu không tác dụng với H2SO4 đặc, nguội để đựng acid này.
Chọn D.
Câu 19: Cho các chất: Cu, CuO, BaSO4, Mg, KOH, C, Na2CO3. Tổng số chất tác dụng với dung dịch H2SO4 đặc, nóng là
A. 4. B. 5. C. 6. D. 7.
Lời giải chi tiết
Cu, CuO, Mg, KOH, C tác dụng được với H2SO4 đặc nóng.
Chọn B.
Câu 20: Khi làm thí nghiệm với H2SO4 đặc, nóng thường sinh ra khí SO2. Để hạn chế tốt nhất khí SO2 thoát ra gây ô nhiễm môi trường, người ta nút ống nghiệm bằng bông tẩm dung dịch nào sau đây?
A. Giấm ăn. B. Muối ăn. C. Cồn. D. Xút.
Phương pháp giải
Lý thuyết về tính chất hóa học của SO2
Lời giải chi tiết
Người ta nút ống nghiệm bằng bông tẩm dung dịch xút để hấp thụ khí SO2 được sinh ra.
NaOH + SO2 ⟶ NaHSO3
Hoặc 2NaOH + SO2 ⟶ Na2SO3 + H2O.
Chọn D.
- Đề thi giữa kì 1 Hóa 11 Chân trời sáng tạo - Đề số 7
- Đề thi giữa kì 1 Hóa 11 Chân trời sáng tạo - Đề số 8
- Đề thi giữa kì 1 Hóa 11 Chân trời sáng tạo - Đề số 9
- Đề thi giữa kì 1 Hóa 11 Chân trời sáng tạo - Đề số 10
- Đề thi giữa kì 1 Hóa 11 Chân trời sáng tạo - Đề số 11
>> Xem thêm
Luyện Bài Tập Trắc nghiệm Hóa 11 - Chân trời sáng tạo - Xem ngay












Danh sách bình luận