 Hóa 12 ctst, giải hóa 12 chân trời sáng tạo
Hóa 12 ctst, giải hóa 12 chân trời sáng tạo
 Chương 3. Hợp chất chứa nitrogen - Hóa 12 Chân trời sán..
Chương 3. Hợp chất chứa nitrogen - Hóa 12 Chân trời sán.. Bài 6. Amine trang 30, 31, 32 Hóa 12 Chân trời sáng tạo
Histamine là một amine tự nhiên được tìm thấy trong cơ
CH tr 30
Trả lời câu hỏi Mở đầu trang 30 SGK Hóa 12 Chân trời sáng tạo
Histamine là một amine tự nhiên được tìm thấy trong cơ thể người và nhiều loại động vật. Histamine tồn tại một trong hai dạng, dạng dự trữ ở khắp các mô trong cơ thể hoặc dạng tự do. Một trong những tác động của histamine là gây viêm, dị ứng. Khi cơ thể gặp tình huống gây kích thích (dị ứng thời tiết, thực phẩm, hoá chất,...), histamine chuyển thành dạng tự do, gây ra các triệu chứng sưng, đỏ, ngứa. Điều này giúp cơ thể chống lại các tác nhân gây hại bằng cách kích thích hệ thống miễn dịch của cơ thể.
Amine là gì? Amine có những tính chất và ứng dụng nào trong thực tiễn?
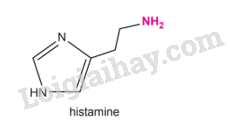
Phương pháp giải:
Nêu khái niệm, tính chất vật lí, tính chất hóa học và ứng dụng của amine.
Lời giải chi tiết:
- Amine là dẫn xuất của ammonia, trong đó nguyên tử hydrogen trong phân tử ammonia được thay thế bằng gốc hydrocarbon.
- Tính chất của amine:
+ Tính chất vật lí: Ở điều kiện thường, amine có thể tồn tại ở thể khí, lỏng hoặc rắn.
- · Nhiệt độ nóng chảy, nhiệt độ sôi của các amine cùng bậc có xu hướng tăng khi phân tử khối tăng.
- · Các amine có số nguyên tử carbon nhỏ thường tan nhiều trong nước.
+ Tính chất hóa học:
· Amine có tính base. Dung dịch alkylamine có thể làm quỳ tím hoá xanh, dung dịch aniline không làm quỳ tím đổi màu.
· Phản ứng với nitrous acid.
· Phản ứng ở nhân thơm ở aniline.
· Phản ứng tạo phức ở methylamine hoặc ethylamine.
- Ứng dụng: Amine ứng dụng trong nhiều lĩnh vực công nghiệp, nông nghiệp, dược phẩm, thuốc nhuộm và sản xuất vật liệu.
CH tr 31 TL1
Trả lời câu hỏi Thảo luận 1 trang 31 SGK Hóa 12 Chân trời sáng tạo
Quan sát Hình 6.1, cho biết nhóm chức đặc trưng nào có trong phân tử amine.
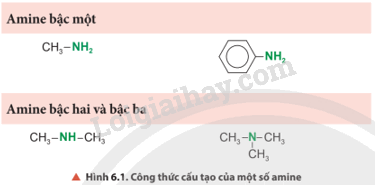
Phương pháp giải:
Amine là dẫn xuất của ammonia, trong đó nguyên tử hydrogen trong phân tử ammonia được thay thế bằng gốc hydrocarbon.
Lời giải chi tiết:
Nhóm chức đặc trưng trong phân tử amine là nhóm amine (–NH2 hoặc –NH- hoặc –N<).
CH tr 31 TL2
Trả lời câu hỏi Thảo luận 2 trang 31 SGK Hóa 12 Chân trời sáng tạo
Dựa vào số nguyên tử hydrogen của phân tử NH3 bị thay thế và đặc điểm cấu tạo của nhóm thế, cho biết amine được phân loại như thế nào. Thế nào là amine bậc một, amine bậc hai và amine bậc ba?
Phương pháp giải:
Bậc của amine được tính bằng số nguyên tử hydrogen trong phân tử ammonia bị thay thế bởi gốc hydrocarbon. Theo đó, các amine được phân loại thành : amine bậc một, bậc hai, bậc ba.
Lời giải chi tiết:
Bậc của amine được tính bằng số nguyên tử hydrogen trong phân tử ammonia bị thay thế bởi gốc hydrocarbon. Theo đó, các amine được phân loại thành : amine bậc một, bậc hai, bậc ba:
+ Amine bậc một là amine có 1 nguyên tử hydrogen trong phân tử ammonia bị thay thế bởi gốc hydrocarbon. Do đó amine bậc I có dạng R-NH2.
+ Amine bậc hai là amine có 2 nguyên tử hydrogen trong phân tử ammonia bị thay thế bởi gốc hydrocarbon. Do đó amine bậc II có dạng R-NH-R’.
+ Amine bậc ba là amine có 3 nguyên tử hydrogen trong phân tử ammonia bị thay thế bởi gốc hydrocarbon. Do đó amine bậc III có dạng 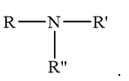
CH tr 31 LT
Trả lời câu hỏi Luyện tập trang 31 SGK Hóa 12 Chân trời sáng tạo
Cho 2 chất sau: CH3-CH2-NH2 và CH3-COONH4. Chất nào thuộc loại amine? Xác định bậc của amine đó.
Phương pháp giải:
- Amine là dẫn xuất của ammonia, trong đó nguyên tử hydrogen trong phân tử ammonia được thay thế bằng gốc hydrocarbon.
- Bậc của amine được tính bằng số nguyên tử hydrogen trong phân tử ammonia bị thay thế bởi gốc hydrocarbon.
Lời giải chi tiết:
CH3-CH2-NH2 là amine. Đây là amine bậc I.
CH tr 32 TL1
Trả lời câu hỏi Thảo luận 1 trang 32 SGK Hóa 12 Chân trời sáng tạo
Quan sát Hình 6.2 và Hình 6.3, cho biết hình dạng của phân tử methylamine và aniline.
Phương pháp giải:
Amine có nguyên tử nitrogen liên kết trực tiếp với nguyên tử carbon của vòng benzene gọi là arylamine, nguyên tử nitrogen liên kết với gốc alkyl gọi là alkylamine.
Lời giải chi tiết:
Phân tử methylamine có nhóm –NH2 liên kết với nhóm –CH3 và một cặp electron chưa liên kết của nguyên tử N.
Phân tử aniline có nhóm –NH2 liên kết với nhóm –C6H5 (vòng benzene) và một cặp electron chưa liên kết của nguyên tử N.
Þ Cấu tạo của amine tương tự ammonia.
CH tr 32 TL2
Trả lời câu hỏi Thảo luận 2 trang 32 SGK Hóa 12 Chân trời sáng tạo
Nghiên cứu Ví dụ 1, cho biết amine có loại đồng phân nào. Phân tích cách gọi tên amine theo 2 loại danh pháp đã nêu.
Phương pháp giải:
- Amine có đồng phân mạch carbon, đồng phân vị trí nhóm chức và đồng phân bậc amine.
- Nêu cách gọi tên amine:
+ Theo danh pháp gốc – chức.
+ Theo danh pháp thay thế.
Lời giải chi tiết:
- Amine có đồng phân mạch carbon, đồng phân vị trí nhóm chức và đồng phân bậc amine.
- Cách gọi tên amine theo 2 loại danh pháp:
+ Theo danh pháp gốc – chức: Tên hydrocarbon + amine.
+ Theo danh pháp thay thế:
· Amine bậc một: Tên hydrocarbon (bỏ kí tự e) – số chỉ vị trí nhóm amine – amine.
· Amine bậc hai: N-tên hydrocarbon + tên hydrocarbon mạch chính (bỏ kí tự e) – số chỉ vị trí nhóm amine – amine.
· Amine bậc ba: N-tên hydrocarbon thứ nhất - N-tên hydrocarbon + tên hydrocarbon mạch chính (bỏ kí tự e) – số chỉ vị trí nhóm amine – amine.
CH tr 33 LT
Trả lời câu hỏi Luyện tập trang 33 SGK Hóa 12 Chân trời sáng tạo
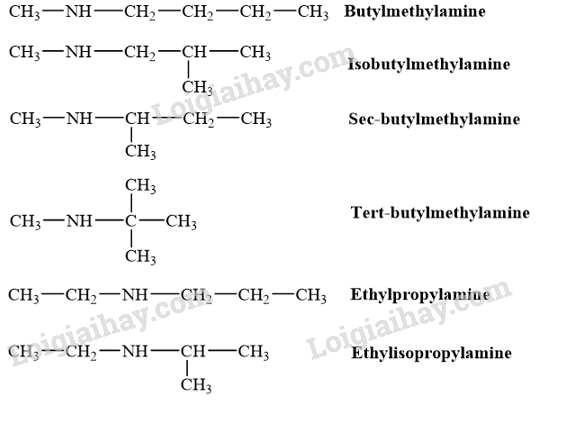
Viết công thức cấu tạo và gọi tên theo danh pháp gốc - chức các amine bậc hai có công thức phân tử C5H13N.
Phương pháp giải:
Amine bậc hai là amine có 2 nguyên tử hydrogen trong phân tử ammonia bị thay thế bởi gốc hydrocarbon. Do đó amine bậc II có dạng R-NH-R’.
Cách gọi tên amine theo danh pháp gốc – chức: Tên hydrocarbon + amine.
Lời giải chi tiết:
Công thức cấu tạo của các amine bậc hai có công thức phân tử C5H13N
CH tr 33 TL
Trả lời câu hỏi Thảo luận trang 33 SGK Hóa 12 Chân trời sáng tạo
Quan sát Bảng 6.1, kể tên các amine thể khí ở điều kiện thường. Nhận xét xu hướng biến đổi nhiệt độ nóng chảy, nhiệt độ sôi và khả năng hoà tan trong nước của các amine.
Phương pháp giải:
- Các chất có nhiệt độ sôi thấp hơn nhiệt độ phòng thì ở thể khí trong điều kiện thường.
- Ở điều kiện thường, amine có thể tồn tại ở thể khí, lỏng hoặc rắn.
· Nhiệt độ nóng chảy, nhiệt độ sôi của các amine cùng bậc có xu hướng tăng khi phân tử khối tăng.
· Các amine có số nguyên tử carbon nhỏ thường tan nhiều trong nước.
Lời giải chi tiết:
- Các amine ở thể khí (có nhiệt độ sôi thấp hơn nhiệt độ phòng) ở điều kiện thường trong Bảng 6.1:
+ Methylamine: CH3NH2.
+ Ethylamine: CH3CH2NH2.
+ Dimethylamine: (CH3)2NH.
+ Trimethylamine: (CH3)3N.
- Nhận xét:
+ Nhiệt độ nóng chảy, nhiệt độ sôi của các amine cùng bậc có xu hướng tăng khi phân tử khối tăng.
+ Các amine có số nguyên tử carbon nhỏ thường tan nhiều trong nước.
CH tr 34 TL1
Trả lời câu hỏi Thảo luận 1 trang 34 SGK Hóa 12 Chân trời sáng tạo
Cho biết liên kết hydrogen ảnh hưởng như thế nào đến nhiệt độ nóng chảy, nhiệt độ sôi, độ tan trong nước của amine.
Phương pháp giải:
Những chất có khả năng tạo liên kết hydrogen liên phân tử, sẽ có nhiệt độ nóng chảy, nhiệt độ sôi cao hơn.
Những chất có khả năng tạo liên kết hydrogen với nước, sẽ tan tốt trong nước.
Lời giải chi tiết:
- Giữa các phân tử amine bậc một hoặc amine bậc hai có liên kết hydrogen liên phân tử, nên nhiệt độ nóng chảy, nhiệt độ sôi của chúng cao hơn so với những phân tử có phân tử khối lượng tương đương mà không có liên kết hydrogen.
- Các amine có thể hình thành liên kết hydrogen với nước thì tan tốt trong nước.
CH tr 34 TL2
Trả lời câu hỏi Thảo luận 2 trang 34 SGK Hóa 12 Chân trời sáng tạo
Tiến hành Thí nghiệm 1, quan sát và nêu hiện tượng thí nghiệm. Dựa vào phương trình hoá học của các phản ứng (nếu có), giải thích kết quả thí nghiệm.
Phương pháp giải:
Trong dung dịch, amine phản ứng với H2O, tạo ra ion ammonium và ion hydroxide.
\({\rm{RN}}{{\rm{H}}_{\rm{2}}} + {{\rm{H}}_{\rm{2}}}{\rm{O}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{RNH}}_3^ + + {\rm{O}}{{\rm{H}}^ - }\)
Lời giải chi tiết:
- Thí nghiệm xảy ra trên đĩa thủy tinh: Nhỏ vào giọt CH3NH2 vào mẩu giấy quỳ tím, quỳ tím hóa xanh.
→ Dung dịch methyl amine có môi trường base, làm quỳ tím hóa xanh.
\({\rm{C}}{{\rm{H}}_3}{\rm{N}}{{\rm{H}}_{\rm{2}}} + {{\rm{H}}_{\rm{2}}}{\rm{O}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{C}}{{\rm{H}}_3}{\rm{NH}}_3^ + + {\rm{O}}{{\rm{H}}^ - }\)
- Thí nghiệm xảy ra ở ống nghiệm (1):
+ Lấy vài giọt phenolphthalein vào dung dịch methyl amine, dung dịch hóa hồng.
→ Dung dịch methylamine có môi trường base, làm phenolphthalein hóa hồng.
.\({\rm{C}}{{\rm{H}}_3}{\rm{N}}{{\rm{H}}_{\rm{2}}} + {{\rm{H}}_{\rm{2}}}{\rm{O}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{C}}{{\rm{H}}_3}{\rm{NH}}_3^ + + {\rm{O}}{{\rm{H}}^ - }\).
+ Thêm dung dịch HCl vào ống nghiệm, dung dịch bị mất màu hồng.
→ Methylamine phản ứng với hydrochloric acid, dung dịch sau phản ứng không có môi trường base nên không còn phenolphthalein hóa hồng.
\({\rm{C}}{{\rm{H}}_3}{\rm{N}}{{\rm{H}}_{\rm{2}}} + {\rm{HCl}} \to {\rm{C}}{{\rm{H}}_3}{\rm{N}}{{\rm{H}}_3}{\rm{Cl}}\)
- Thí nghiệm xảy ra ở ống nghiệm (2): Nhỏ methylamine vào dung dịch iron (III) chloride, thấy xuất hiện kết tủa màu nâu đỏ.
→ Phản ứng giữa methyl amine và iron (III) chloride sinh ra kết tủa Fe(OH)3 có màu nâu đỏ.
\({\rm{3C}}{{\rm{H}}_3}{\rm{N}}{{\rm{H}}_{\rm{2}}} + 3{{\rm{H}}_2}{\rm{O + FeC}}{{\rm{l}}_3} \to 3{\rm{C}}{{\rm{H}}_3}{\rm{N}}{{\rm{H}}_3}{\rm{Cl + Fe(OH}}{{\rm{)}}_3}\)
CH tr 34 LT
Trả lời câu hỏi Luyện tập trang 34 SGK Hóa 12 Chân trời sáng tạo
Viết phương trình hoá học thể hiện tính base của aniline qua phản ứng với dung dịch HCl.
Phương pháp giải:
Phương trình hóa học giữa amine và hydrochloric acid:
\({\rm{RN}}{{\rm{H}}_{\rm{2}}} + {\rm{HCl}} \to {\rm{RN}}{{\rm{H}}_3}{\rm{Cl}}\)
Lời giải chi tiết:
\({{\rm{C}}_{\rm{6}}}{{\rm{H}}_{\rm{5}}}{\rm{N}}{{\rm{H}}_{\rm{2}}} + {\rm{HCl}} \to {{\rm{C}}_{\rm{6}}}{{\rm{H}}_{\rm{5}}}{\rm{N}}{{\rm{H}}_3}{\rm{Cl}}\)
CH tr 35 TL1
Trả lời câu hỏi Thảo luận 1 trang 35 SGK Hóa 12 Chân trời sáng tạo
Từ Ví dụ 2 và Ví dụ 3, xác định bậc của amine trong 2 phản ứng với nitrous acid. Cho biết sự khác nhau về 2 loại sản phẩm hữu cơ.
Phương pháp giải:
Aniline phản ứng với nitrous acid ở nhiệt độ thấp tạo ra muối diazonium, là chất trung gian quan trọng trong tổng hợp nhiều hợp chất hữu cơ.
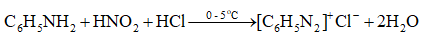
Phản ứng của alkylamine bậc một với nitrous acid sinh ra nitrogen và alcohol.
\({\rm{RN}}{{\rm{H}}_{\rm{2}}} + {\rm{HN}}{{\rm{O}}_{\rm{2}}} \to {\rm{ROH}} + {{\rm{N}}_{\rm{2}}} \uparrow + {{\rm{H}}_{\rm{2}}}{\rm{O}}\)
Lời giải chi tiết:
|
|
Ví dụ 2: Ethylamine phản ứng với nitrous acid. |
Ví dụ 3: Aniline phản ứng với nitrous acid |
|
Bậc của amine |
Amine no bậc một. |
Amine thơm bậc một. |
|
Sản phẩm hữu cơ thu được |
Alcohol C2H5OH. |
Muối diazonium \({[{{\rm{C}}_{\rm{6}}}{{\rm{H}}_{\rm{5}}}{{\rm{N}}_{\rm{2}}}]^ + }{\rm{C}}{{\rm{l}}^ - }\) |
CH tr 35 TL2
Trả lời câu hỏi Thảo luận 2 trang 35 SGK Hóa 12 Chân trời sáng tạo
Tiến hành Thí nghiệm 2, nêu hiện tượng và giải thích kết quả thí nghiệm.
Phương pháp giải:
Aniline phản ứng với nước bromine tạo kết tủa trắng.
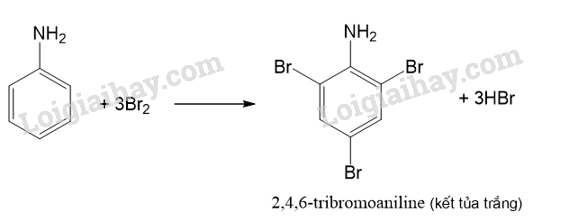
Lời giải chi tiết:
- Hiện tượng: Khi nhỏ vài giọt bromine vào ống nghiệm chứa aniline thì kết tủa trắng xuất hiện.
- Giải thích: Phản ứng giữa bromine và aniline sinh ra kết tủa trắng là 2,4,6-tribromoaniline.
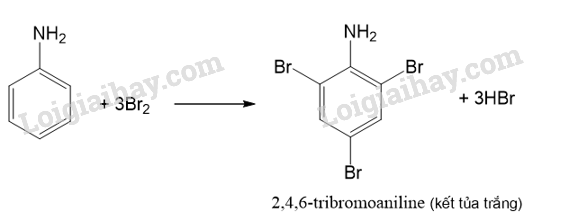
CH tr 36 LT1
Trả lời câu hỏi Luyện tập 1 trang 36 SGK Hóa 12 Chân trời sáng tạo
Có thể phân biệt aniline với benzene bằng phản ứng với nước bromine không? Giải thích.
Phương pháp giải:
Ở điều kiện thường, benzene không phản ứng với nước bromine, aniline phản ứng với bromine tạo kết tủa trắng.
Lời giải chi tiết:
Có thể phân biệt aniline với benzene bằng phản ứng với nước bromine vì ta thu được hai kết quả khác nhau:
- Benzene không phản ứng với nước bromine nên không có hiện tượng.
- Aniline phản ứng với bromine tạo kết tủa trắng.
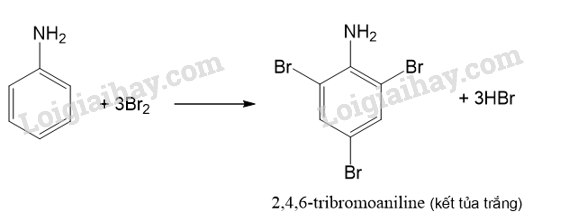
CH tr 36 TL
Trả lời câu hỏi Thảo luận trang 36 SGK Hóa 12 Chân trời sáng tạo
Tiến hành Thí nghiệm 3, nêu hiện tượng và giải thích kết quả thí nghiệm.
Phương pháp giải:
Methylamine và ethylamine có phản ứng tạo phức với Cu(OH)2.
Lời giải chi tiết:
- Khi thêm methylamine vào ống nghiệm chứa dung dịch copper (II) sulfate, kết tủa màu xanh lam xuất hiện.
→ Methylamine phản ứng với copper (II) sulfate tạo kết tủa copper (II) hydroxide màu xanh lam.
\({\rm{2C}}{{\rm{H}}_3}{\rm{N}}{{\rm{H}}_{\rm{2}}} + 2{{\rm{H}}_2}{\rm{O + CuS}}{{\rm{O}}_4} \to {({\rm{C}}{{\rm{H}}_3}{\rm{N}}{{\rm{H}}_3}{\rm{)}}_2}{\rm{S}}{{\rm{O}}_4}{\rm{ + Cu(OH}}{{\rm{)}}_2} \downarrow \)
- Sau đó, lắc đều ống nghiệm thì kết tủa tan, tạo thành dung dịch màu xanh lam.
→ Dung dịch methylamine hoà tan được kết tủa Cu(OH)2, tạo thành dung dịch có màu xanh lam là phức chất của methylamine với Cu2+.
\({\rm{4C}}{{\rm{H}}_3}{\rm{N}}{{\rm{H}}_{\rm{2}}} + {\rm{Cu(OH}}{{\rm{)}}_2} \to [{\rm{Cu}}{({\rm{C}}{{\rm{H}}_3}{\rm{N}}{{\rm{H}}_2}{\rm{)}}_4}{\rm{](OH}}{{\rm{)}}_2}{\rm{ }}\)
CH tr 36 LT2
Trả lời câu hỏi Luyện tập 2 trang 36 SGK Hóa 12 Chân trời sáng tạo
Viết phương trình hoá học của phản ứng tạo phức khi cho ethylamine tác dụng với Cu(OH)2.
Phương pháp giải:
Methylamine và ethylamine có phản ứng tạo phức với Cu(OH)2.
Lời giải chi tiết:
\({\rm{4}}{{\rm{C}}_2}{{\rm{H}}_5}{\rm{N}}{{\rm{H}}_{\rm{2}}} + {\rm{Cu(OH}}{{\rm{)}}_2} \to [{\rm{Cu}}{({{\rm{C}}_2}{{\rm{H}}_5}{\rm{N}}{{\rm{H}}_2}{\rm{)}}_4}{\rm{](OH}}{{\rm{)}}_2}{\rm{ }}\)
CH tr 37 TL1
Trả lời câu hỏi Thảo luận 1 trang 37 SGK Hóa 12 Chân trời sáng tạo
Từ thông tin về ứng dụng của amine, cho biết vai trò của amine trong đời sống, sản xuất, y học.
Phương pháp giải:
Amine ứng dụng trong nhiều lĩnh vực công nghiệp, nông nghiệp, dược phẩm, thuốc nhuộm và sản xuất vật liệu.
Lời giải chi tiết:
- Trong đời sống và sản xuất, amine được dùng để tổng hợp polyamide, hoá chất sử dụng trong nông nghiệp và các vật liệu khác.
- Trong y học, amine được sử dụng để làm dược phẩm.
CH tr 37 TL2
Trả lời câu hỏi Thảo luận 2 trang 37 SGK Hóa 12 Chân trời sáng tạo
Nêu phương pháp phổ biến điều chế amine.
Phương pháp giải:
Phương pháp phổ biến để điểu chế amine: khử hợp chất nitro hoặc alkyl hoá ammonia.
Lời giải chi tiết:
Các phương pháp phổ biến điều chế amine là khử hợp chất nitro hoặc alkyl hoá ammonia.
- Khử hợp chất nitro: Hợp chất có nhóm nitro có thể bị khử thành nhóm amine bởi một số kim loại như Fe, Zn,... trong môi trường acid.
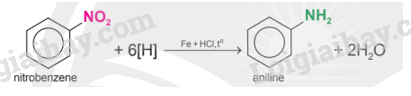
- Alkyl hóa ammonia: Dẫn xuất halogen phản ứng với ammonia có thể tạo ra các sản phẩm là amine bậc một, bậc hai, bậc ba.
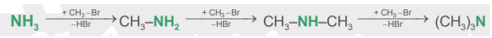
CH tr 37 VD
Trả lời câu hỏi Vận dụng trang 37 SGK Hóa 12 Chân trời sáng tạo
Khói thuốc lá và thuốc lá điện tử chứa các thành phần nicotine, carbon monoxide, benzene, formaldehyde, acetaldehyde, hydrogen cyanide,... là những chất tác động trực tiếp lên não, thần kinh, tim mạch, hệ hô hấp và nguy cơ dẫn đến ung thư. Một số bạn trẻ cho rằng hút thuốc là "sành điệu" thuốc lá điện tử không gây hại,... Hãy nêu quan điểm của em.
Phương pháp giải:
Dựa vào thông tin về thành phần của khói thuốc và thuốc lá điện tử để nêu quan điểm của mình.
Lời giải chi tiết:
Theo kiến thức của em, cả thuốc lá điếu và thuốc lá điện tử đều chứa nhiều chất độc hại và gây hại cho sức khỏe:
+ Nicotine trong cả hai loại thuốc lá đều gây nghiện và ảnh hưởng xấu đến não bộ, tim mạch.
+ Carbon monoxide, formaldehyde, acetaldehyde là những chất gây ung thư. Benzene có thể gây các bệnh liên quan đến bạch cầu.
+ Hydrogen cyanide có thể ảnh hưởng đến hệ thần kinh trung ương.
+ Cả hai loại thuốc lá đều gây tổn thương phổi, tăng nguy cơ mắc bệnh phổi tắc nghẽn mạn tính, ung thư phổi.
Do đó, theo quan điểm của em, không loại thuốc lá nào có thể coi là "sành điệu" hay lành mạnh. Hút thuốc có thể ảnh hưởng nghiêm trọng đến sức khỏe của người hút và những người xung quanh. Việc chấp nhận rủi ro cho sức khỏe vì lý do "sành điệu" là không nên. Do đó mọi người nên tránh xa mọi loại thuốc lá để bảo vệ sức khỏe bản thân và cộng đồng.
CH tr 38 BT1
Trả lời câu hỏi Bài tập 1 trang 38 SGK Hóa 12 Chân trời sáng tạo
Tên gọi và bậc của amine có công thức cấu tạo CH3CH2CH(CH3)CH2-NH2 là
A. 3-methylbutan-4-amine, bậc một.
B. 2-methylbutan-l-amine, bậc hai.
C. 3-methylbutan-4-amine, bậc hai.
D. 2-methylbutan-l-amine, bậc một.
Phương pháp giải:
- Bậc của amine được tính bằng số nguyên tử hydrogen trong phân tử ammonia bị thay thế bởi gốc hydrocarbon. - Danh pháp thay thế của amine:
· Amine bậc một: Tên hydrocarbon (bỏ kí tự e) – số chỉ vị trí nhóm amine – amine.
· Amine bậc hai: N-tên hydrocarbon + tên hydrocarbon mạch chính (bỏ kí tự e) – số chỉ vị trí nhóm amine – amine.
· Amine bậc ba: N-tên hydrocarbon thứ nhất - N-tên hydrocarbon + tên hydrocarbon mạch chính (bỏ kí tự e) – số chỉ vị trí nhóm amine – amine.
Lời giải chi tiết:
CH3CH2CH(CH3)CH2-NH2 là amine bậc một và có tên gọi như sau:
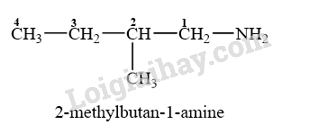
→ Chọn D.
CH tr 38 BT2
Trả lời câu hỏi Bài tập 2 trang 38 SGK Hóa 12 Chân trời sáng tạo
Số đồng phân amine bậc ba có công thức phân tử C5H13N là
A. 2. B. 3. C. 4. D. 5.
Phương pháp giải:
Amine bậc ba là amine có 3 nguyên tử hydrogen trong phân tử ammonia bị thay thế bởi gốc hydrocarbon. Do đó amine bậc III có dạng 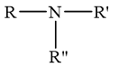
Lời giải chi tiết:
Các đồng phân amine bậc ba có công thức phân tử C5H13N là
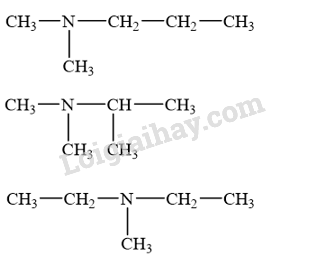
→ Chọn B.
CH tr 38 BT3
Trả lời câu hỏi Bài tập 3 trang 38 SGK Hóa 12 Chân trời sáng tạo
Mùi tanh của cá chủ yếu do amine gây ra như trimethylamine. Làm thế nào để khử mùi tanh của cá?
Phương pháp giải:
Amine có tính base, để khử amine ta có thể dùng những hợp chất có tính acid.
Lời giải chi tiết:
Mùi tanh cá gây ra bởi các amine (các chất có tính base) như trimetylamin, ta có thể sử dụng chất có tính acid như giấm hoặc chanh. Giấm và chanh đều chứa acid yếu sẽ tạo muối với amine và bị rửa trôi bằng nước, mà không ảnh hưởng nhiều đến chất lượng cá.
CH tr 38 BT4
Trả lời câu hỏi Bài tập 4 trang 38 SGK Hóa 12 Chân trời sáng tạo
Ephedrine được sử dụng với hàm lượng nhất định trong các loại thuốc điều trị cảm và dị ứng. Ephedrine có mùi tanh và dễ bị oxi hoá trong không khí, do đó người ta thường hạn chế sử dụng trực tiếp. Ephedrine hydrochloride khó bị oxi hoá, không mùi và vẫn giữ được hoạt tính của hợp chất. Ephedrine hydrochloride được điều chế từ phản ứng của ephedrine với hydrochloric acid. Viết phương trình hoá học của phản ứng xảy ra.
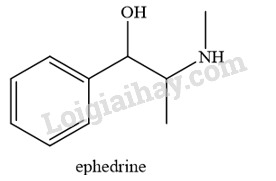
Phương pháp giải:
Phương trình hóa học giữa amine và hydrochloric acid:
\({\rm{RN}}{{\rm{H}}_{\rm{2}}} + {\rm{HCl}} \to {\rm{RN}}{{\rm{H}}_3}{\rm{Cl}}\)
Lời giải chi tiết:
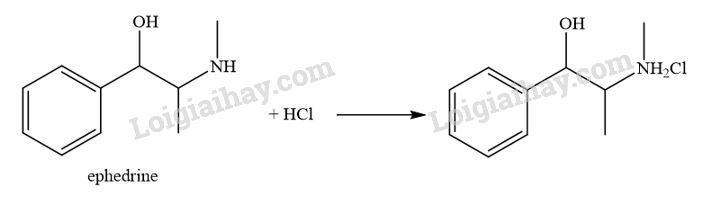
Luyện Bài Tập Trắc nghiệm Hóa 12 - Chân trời sáng tạo - Xem ngay
Các bài khác cùng chuyên mục
- Lý thuyết Sơ lược về phức chất và sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch - Hóa 12 Chân trời sáng tạo
- Lý thuyết Đại cương về kim loại chuyển tiếp dãy thứ nhất - Hóa 12 Chân trời sáng tạo
- Lý thuyết Nguyên tố nhóm IIA - Hóa 12 Chân trời sáng tạo
- Lý thuyết Nguyên tố nhóm IA - Hóa 12 Chân trời sáng tạo
- Lý thuyết Hợp kim – Sự ăn mòn kim loại - Hóa 12 Chân trời sáng tạo
- Lý thuyết Sơ lược về phức chất và sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch - Hóa 12 Chân trời sáng tạo
- Lý thuyết Đại cương về kim loại chuyển tiếp dãy thứ nhất - Hóa 12 Chân trời sáng tạo
- Lý thuyết Nguyên tố nhóm IIA - Hóa 12 Chân trời sáng tạo
- Lý thuyết Nguyên tố nhóm IA - Hóa 12 Chân trời sáng tạo
- Lý thuyết Hợp kim – Sự ăn mòn kim loại - Hóa 12 Chân trời sáng tạo












Danh sách bình luận