 Hóa 12 ctst, giải hóa 12 chân trời sáng tạo
Hóa 12 ctst, giải hóa 12 chân trời sáng tạo
 Chương 5. Pin điện và điện phân - Hóa 12 Chân trời sáng..
Chương 5. Pin điện và điện phân - Hóa 12 Chân trời sáng.. Bài 12. Thế điện cực và nguồn điện hóa học trang 64, 65, 66 Hóa 12 Chân trời sáng tạo
Người ta dùng hai sợi dây làm bằng hai kim loại khác nhau cắm
CH tr 64 MĐ
Trả lời câu hỏi Mở đầu trang 64 SGK Hóa 12 Chân trời sáng tạo
Người ta dùng hai sợi dây làm bằng hai kim loại khác nhau cắm vào một quả chanh và nối với một bóng đèn 3 V thì thấy bóng đèn sáng. Như vậy, quả chanh có cắm hai sợi dây kim loại khác nhau đóng vai trò như một viên pin, phát sinh ra dòng điện.
Cấu tạo và nguyên tắc hoạt động của pin như thế nào?
Phương pháp giải:
Nêu cấu tạo và nguyên tắc hoạt động của pin.
Lời giải chi tiết:
- Cấu tạo: Pin Galvani gồm 2 điện cực có thế điện cực khác nhau, thường được ghép với nhau qua cầu muối.
- Nguyên tắc hoạt động: Pin Galvani chuyển năng lượng của phản ứng hoá học thành năng lượng điện.
CH tr 64 TL1
Trả lời câu hỏi Thảo luận 1 trang 64 SGK Hóa 12 Chân trời sáng tạo
Xác định dạng oxi hoá và dạng khử trong các quá trình (2) và (3).
Phương pháp giải:
Dạng oxi hoá Mn+ và dạng khử M của cùng một kim loại được gọi là cặp oxi hoá - khử của kim loại, kí hiệu là Mn+/M.
\({{\rm{M}}^{{\rm{n + }}}}{\rm{ + ne }} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{ M}}\)
Dạng oxi hóa Dạng khử
Lời giải chi tiết:
Quá trình (2): \({\rm{C}}{{\rm{u}}^{{\rm{2 + }}}}{\rm{ + 2e }} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{ Cu}}\)
Dạng oxi hóa Dạng khử
Quá trình (3): \({\rm{A}}{{\rm{g}}^{\rm{ + }}}{\rm{ + 1e }} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{ Ag}}\)
Dạng oxi hóa Dạng khử
CH tr 64 TL2
Trả lời câu hỏi Thảo luận 2 trang 64 SGK Hóa 12 Chân trời sáng tạo
Viết các cặp oxi hóa - khử trong quá trình (2) và (3).
Phương pháp giải:
Dạng oxi hoá Mn+ và dạng khử M của cùng một kim loại được gọi là cặp oxi hoá - khử của kim loại, kí hiệu là Mn+/M.
Lời giải chi tiết:
Cặp oxi hóa khử ở quá trình (2): Cu2+/Cu.
Cặp oxi hóa khử ở quá trình (3): Ag+/Ag.
CH tr 64 LT
Trả lời câu hỏi Luyện tập trang 64 SGK Hóa 12 Chân trời sáng tạo
Viết các cặp oxi hoá - khử của kim loại Na, Mg và Al.
Phương pháp giải:
Dạng oxi hoá Mn+ và dạng khử M của cùng một kim loại được gọi là cặp oxi hoá - khử của kim loại, kí hiệu là Mn+/M.
Lời giải chi tiết:
|
Kim loại |
Cặp oxi hóa – khử |
|
Na |
Na+/Na |
|
Mg |
Mg2+/Mg |
|
Al |
Al3+/Al |
CH tr 65 TL1
Trả lời câu hỏi Thảo luận 1 trang 65 SGK Hóa 12 Chân trời sáng tạo
Quan sát Hình 12.1, hãy mô tả cấu tạo của pin Galvani. Cho biết cực dương, cực âm và chiều di chuyển của electron trong pin.
Phương pháp giải:
- Pin Galvani gồm 2 điện cực có thế điện cực khác nhau, thường được ghép với nhau qua cầu muối.
- Điện cực dương, cathode (+): Xảy ra quá trình khử
Điện cực âm, anode (-): Xảy ra quá trình oxi hoá.
- Dòng điện di chuyển ngược chiều với dòng electron.
Lời giải chi tiết:
- Cấu tạo của pin Galvani: hai điện cực (Zn và Cu), cầu muối.
- Cực dương của pin là điện cực Cu, cực âm của pin là điện cực Zn.
- Electron di chuyển từ cực âm (thanh Zn) qua dây dẫn đến cực dương (thanh Cu).
CH tr 65 TL2
Trả lời câu hỏi Thảo luận 2 trang 65 SGK Hóa 12 Chân trời sáng tạo
Điện cực nào bị tan dần trong pin Galvani Zn-Cu?
Phương pháp giải:
Trong pin Galvani:
- Điện cực dương, cathode (+): Xảy ra quá trình khử
- Điện cực âm, anode (-): Xảy ra quá trình oxi hoá.
Lời giải chi tiết:
Trong pin Galvani Zn-Cu, xảy ra các quá trình sau:
+ Anode (-): \({\rm{Zn}} \to {\rm{Z}}{{\rm{n}}^{2 + }} + 2{\rm{e}}\)
+ Cathode (+): \({\rm{C}}{{\rm{u}}^{2 + }} + 2{\rm{e}} \to {\rm{Cu}}\)
Þ Điện cực Zn bị tan dần.
CH tr 66
Trả lời câu hỏi Thảo luận trang 66 SGK Hóa 12 Chân trời sáng tạo
Dựa vào Bảng 12.1, hãy sắp xếp theo chiều tăng dần tính oxi hoá của các ion Li+, Fe2+, Ag+ và chiều tăng dần tính khử của các kim loại tương ứng.
Phương pháp giải:
Thế điện cực chuẩn của kim loại (\({\rm{E}}_{{{\rm{M}}^{{\rm{n + }}}}{\rm{/M}}}^{\rm{o}}\)) càng lớn thì tính oxi hoá của cation Mn+ càng mạnh, tính khử của kim loại càng yếu và ngược lại.
Lời giải chi tiết:
Ta có: \({\rm{E}}_{{\rm{L}}{{\rm{i}}^{\rm{ + }}}{\rm{/Li}}}^{\rm{o}} < {\rm{E}}_{{\rm{F}}{{\rm{e}}^{{\rm{2 + }}}}{\rm{/Fe}}}^{\rm{o}} < {\rm{E}}_{{\rm{A}}{{\rm{g}}^{\rm{ + }}}{\rm{/Ag}}}^{\rm{o}}\)
- Tính oxi hóa: Li+ < Fe2+ < Ag+.
- Tính khử: Ag < Fe < Li.
CH tr 67 TL1
Trả lời câu hỏi Thảo luận 1 trang 67 SGK Hóa 12 Chân trời sáng tạo
Cho Al và Ag vào dung dịch HCl 1 M. Dựa vào Bảng 12.1, dự đoán phản ứng nào có thể xảy ra. Viết phương trình hoá học của phản ứng (nếu có).
Phương pháp giải:
Kim loại trong cặp oxi hoá - khử có thế điện cực chuẩn âm có thể khử được ion hydrogen (H+) trong dung dịch acid ở điều kiện chuẩn.
Lời giải chi tiết:
- Ta có: \({\rm{E}}_{{\rm{A}}{{\rm{l}}^{{\rm{3 + }}}}{\rm{/Al}}}^{\rm{o}} = - 1,66{\rm{ (V) < 0}}\);\({\rm{E}}_{{\rm{A}}{{\rm{g}}^{\rm{ + }}}{\rm{/Ag}}}^{\rm{o}} = 0,8{\rm{ (V) > 0}}\)
Þ Al phản ứng được với dung dịch HCl; Ag không phản ứng được với dung dịch HCl.
- Phương trình hóa học:\(2{\rm{Al}} + 6{\rm{HCl}} \to 2{\rm{AlC}}{{\rm{l}}_{\rm{3}}} + 3{{\rm{H}}_{\rm{2}}} \uparrow \)
CH tr 67 TL2
Trả lời câu hỏi Thảo luận 2 trang 67 SGK Hóa 12 Chân trời sáng tạo
Dựa vào Bảng 12.1, xác định cathode và anode trong pin điện hoá Zn-Pb gồm điện cực chuẩn Zn2+/Zn và điện cực chuẩn Pb2+/Pb. Tính sức điện động chuẩn của pin.
Phương pháp giải:
- Pin Galvani gồm hai điện cực được nối với nhau bằng cầu muối. Khi pin hoạt động, ở điện cực âm (anode) xảy ra quá trình oxi hoá và ở điện cực dương (cathode) xảy ra quá trình khử ion.
- Sức điện động chuẩn của pin: \({\rm{E}}_{{\rm{pin}}}^{\rm{o}} = {\rm{E}}_{\rm{ + }}^{\rm{o}} - {\rm{E}}_ - ^{\rm{o}}\)
Lời giải chi tiết:
- Trong pin điện hóa Zn – Pb:
+ Cathode: Pb.
+ Anode: Zn.
- Sức điện động chuẩn của pin: \({\rm{E}}_{{\rm{pin}}}^{\rm{o}} = {\rm{E}}_{{\rm{P}}{{\rm{b}}^{{\rm{2 + }}}}{\rm{/Pb}}}^{\rm{o}} - {\rm{E}}_{{\rm{Z}}{{\rm{n}}^{{\rm{2 + }}}}{\rm{/Zn}}}^{\rm{o}} = - 0,13 - ( - 0,76) = 0,63{\rm{ (V)}}\)
CH tr 68 TL1
Trả lời câu hỏi Thảo luận 1 trang 68 SGK Hóa 12 Chân trời sáng tạo
Hãy nêu một số ứng dụng của pin mặt trời trong đời sống.
Phương pháp giải:
Pin mặt trời (pin quang điện) bao gồm nhiều tế bào quang điện làm biến đổi năng lượng ánh sáng thành năng lượng điện.
Lời giải chi tiết:
Ứng dụng của pin mặt trời:
- Trạm sạc năng lượng mặt trời: cung cấp nguồn năng lượng vô tận để sạc các thiết bị di động như điện thoại, máy tính bảng, laptop…
- Thùng rác năng lượng mặt trời: thùng rác thông minh có chức năng lọc nước thải để nuôi cây xanh và có thể sạc pin điện thoại bằng năng lượng mặt trời ở Đà Nẵng.
- Đèn đường năng lượng mặt trời.
- Xe ô tô năng lượng mặt trời,…
CH tr 68 TL2
Trả lời câu hỏi Thảo luận 2 trang 68 SGK Hóa 12 Chân trời sáng tạo
Hãy nêu một số thiết bị sử dụng acquy mà em biết.
Phương pháp giải:
Acquy đơn giản là acquy chì, gồm bản cực dương bằng PbO2, bản cực âm bằng Pb, cả hai điện cực được đặt vào dung dịch H2SO4 loãng. Nguyên tắc hoạt động của acquy chì tương tự như pin điện hoá.
Lời giải chi tiết:
Các thiết bị sử dụng acquy: xe máy; ô tô; máy phát điện; hệ thống báo cháy, chống trộm;…
CH tr 68 TL3
Trả lời câu hỏi Thảo luận 3 trang 68 SGK Hóa 12 Chân trời sáng tạo
Tìm hiểu và nêu ưu, nhược điểm của pin nhiên liệu, pin mặt trời và acquy.
Phương pháp giải:
Dựa vào thông tin trang 68, sách giáo khoa.
Lời giải chi tiết:
|
Các loại pin |
Ưu điểm |
Nhược điểm |
|
Pin nhiên liệu |
Thời gian hoạt động của pin không bị hạn chế. |
- Chưa được phổ biến - Giá thành cao. |
|
Pin mặt trời |
- Thân thiện với môi trường. - Chi phí không quá cao. - Thời gian sử dụng dài. |
- Phải lắp đặt ở không gian rộng rãi. - Khó di chuyển. |
|
Acquy |
- Dung lượng cao. - Tuổi thọ cao. - Khả năng chịu tải cao. - Dễ dàng tích hợp với nhiều thiết bị khác nhau. |
- Thời gian sạc lâu. - Nặng. - Giá thành cao,… |
CH tr 69 VD
Trả lời câu hỏi Vận dụng trang 69 SGK Hóa 12 Chân trời sáng tạo
Lắp ráp thêm một số pin đơn giản từ các nguyên liệu khác và đo sức điện động của pin.
Phương pháp giải:
Có thể tự lắp ráp pin đơn giản bằng cách cắm 2 thanh kim loại khác nhau vào quả chanh, cốc nước muối,... và đo sức điện động của pin.
Lời giải chi tiết:
Thí nghiệm. Lắp ráp pin khoai tây và đo sức điện động của pin.
- Dụng cụ: thanh kim loại đồng và kẽm; vôn kế; 2 dây dẫn.
- Nguyên liệu: 1 quả khoai tây tươi.
- Tiến hành thí nghiệm:
+ Bước 1: Cắm 2 thanh kim loại vào quả khoai tây và không để chúng chạm vào nhau.
+ Bước 2: Lắp hệ thống như Hình 12.6. Ghi nhận giá trị hiện trên vôn kế.
CH tr 69 BT1
Trả lời câu hỏi Bài tập 1 trang 69 SGK Hóa 12 Chân trời sáng tạo
Cho các kim loại: K, Mg, Al, Ag. Hãy viết các cặp oxi hoá - khử tạo bởi các kim loại đó và dựa vào bảng giá trị thế điện cực chuẩn, sắp xếp theo thứ tự giảm dần tính oxi hóa của các ion kim loại tương ứng.
Phương pháp giải:
- Dạng oxi hoá Mn+ và dạng khử M của cùng một kim loại được gọi là cặp oxi hoá - khử của kim loại, kí hiệu là Mn+/M.
- Thế điện cực chuẩn của kim loại (\({\rm{E}}_{{{\rm{M}}^{{\rm{n + }}}}{\rm{/M}}}^{\rm{o}}\)) càng lớn thì tính oxi hoá của cation Mn+ càng mạnh, tính khử của kim loại càng yếu và ngược lại.
Lời giải chi tiết:
- Các cặp oxi hoá - khử: \(\frac{{{{\rm{K}}^{\rm{ + }}}}}{{\rm{K}}};\frac{{{\rm{M}}{{\rm{g}}^{{\rm{2 + }}}}}}{{{\rm{Mg}}}};\frac{{{\rm{A}}{{\rm{l}}^{{\rm{3 + }}}}}}{{{\rm{Al}}}};\frac{{{\rm{A}}{{\rm{g}}^{\rm{ + }}}}}{{{\rm{Ag}}}}\)
- Thứ tự giảm dần tính oxi hóa của các ion kim loại trên: Ag+; Al3+; Mg2+; K+.
CH tr 69 BT2
Trả lời câu hỏi Bài tập 2 trang 69 SGK Hóa 12 Chân trời sáng tạo
Xác định chiều của các phản ứng hoá học xảy ra giữa các cặp oxi hoá - khử: Cu2+/Cu, Zn2+/Zn và Ag+/Ag ở điều kiện chuẩn. Giải thích và viết phương trình hoá học.
Phương pháp giải:
- Kim loại của cặp oxi hoá - khử có thế điện cực chuẩn nhỏ hơn có thể khử được cation kim loại của cặp oxi hoá - khử có thế điện cực chuẩn lớn hơn ở điều kiện chuẩn.
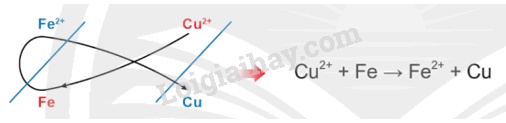
- Sử dụng quy tắc alpha để xác định chiều phản ứng:
Lời giải chi tiết:
Chiều của phản ứng hóa học xảy ra giữa các cặp oxi hóa – khử: Kim loại của cặp oxi hoá - khử có thế điện cực chuẩn nhỏ hơn có thể khử được cation kim loại của cặp oxi hoá - khử có thế điện cực chuẩn lớn hơn ở điều kiện chuẩn.
- Cặp oxi hoá - khử: Cu2+/Cu, Zn2+/Zn
Vì \({\rm{E}}_{{\rm{Z}}{{\rm{n}}^{{\rm{2 + }}}}{\rm{/Zn}}}^{\rm{o}} < {\rm{E}}_{{\rm{C}}{{\rm{u}}^{{\rm{2 + }}}}{\rm{/Cu}}}^{\rm{o}}\) nên Zn + Cu2+ → Zn2+ + Cu
- Cặp oxi hoá - khử: Cu2+/Cu, Ag+/Ag
Vì \({\rm{E}}_{{\rm{C}}{{\rm{u}}^{{\rm{2 + }}}}{\rm{/Cu}}}^{\rm{o}} < {\rm{E}}_{{\rm{A}}{{\rm{g}}^{\rm{ + }}}{\rm{/Ag}}}^{\rm{o}}\) nên Cu + 2Ag+ → Cu2+ + 2Ag
- Cặp oxi hoá - khử: Zn2+/Zn, Ag+/Ag
Vì \({\rm{E}}_{{\rm{Z}}{{\rm{n}}^{{\rm{2 + }}}}{\rm{/Zn}}}^{\rm{o}} < {\rm{E}}_{{\rm{A}}{{\rm{g}}^{\rm{ + }}}{\rm{/Ag}}}^{\rm{o}}\) nên Zn + 2Ag+ → Zn2+ + 2Ag
CH tr 69 BT3
Trả lời câu hỏi Bài tập 3 trang 69 SGK Hóa 12 Chân trời sáng tạo
Trong pin điện hoá, quá trình khử
A. xảy ra ở cực âm. B. xảy ra ở cực dương.
C. xảy ra ở cực âm và cực dương. D. không xảy ra ở cả cực âm và cực dương.
Phương pháp giải:
Pin Galvani gồm hai điện cực được nối với nhau bằng cầu muối. Khi pin hoạt động, ở điện cực âm (anode) xảy ra quá trình oxi hoá và ở điện cực dương (cathode) xảy ra quá trình khử ion.
Lời giải chi tiết:
Trong pin điện hoá, quá trình khử xảy ra ở cực dương.
→ Chọn B.
CH tr 69 BT4
Trả lời câu hỏi Bài tập 4 trang 69 SGK Hóa 12 Chân trời sáng tạo
Khi pin Galvani Zn-Cu hoạt động thì nồng độ
A. Cu2+ giảm, Zn2+ tăng. B. Cu2+ giảm, Zn2+ giảm.
C. Cu2+ tăng, Zn2+ tăng. D. Cu2+ tăng, Zn2+ giảm.
Phương pháp giải:
Pin Galvani gồm hai điện cực được nối với nhau bằng cầu muối. Khi pin hoạt động, ở điện cực âm (anode) xảy ra quá trình oxi hoá và ở điện cực dương (cathode) xảy ra quá trình khử ion.
Lời giải chi tiết:
Khi pin Galvani Zn-Cu hoạt động, phản ứng xảy ra như sau: Zn + Cu2+ → Zn2+ + Cu
Do đó nồng độ Cu2+ giảm, Zn2+ tăng.
→ Chọn A.
CH tr 69 BT5
Trả lời câu hỏi Bài tập 5 trang 69 SGK Hóa 12 Chân trời sáng tạo
Cho một pin điện hoá được tạo bởi các cặp oxi hoá khử Fe2+/Fe, Ag+/Ag ở điều kiện chuẩn. Quá trình xảy ra ở cực âm khi pin hoạt động là
A. Fe → Fe2+ + 2e B. Fe2+ + 2e → Fe
C. Ag+ + le → Ag D. Ag → Ag+ + 1e
Phương pháp giải:
Pin Galvani gồm hai điện cực được nối với nhau bằng cầu muối. Khi pin hoạt động, ở điện cực âm (anode) xảy ra quá trình oxi hoá kim loại và ở điện cực dương (cathode) xảy ra quá trình khử cation.
Cực dương là kim loại có thế điện cực lớn hơn, cực âm là kim loại có thế điện cực nhỏ hơn.
Lời giải chi tiết:
Vì \({\rm{E}}_{{\rm{F}}{{\rm{e}}^{{\rm{2 + }}}}{\rm{/Fe}}}^{\rm{o}} < {\rm{E}}_{{\rm{A}}{{\rm{g}}^{\rm{ + }}}{\rm{/Ag}}}^{\rm{o}}\)nên cực âm là Fe.
Khi pin hoạt động, ở điện cực âm (anode) xảy ra quá trình oxi hoá kim loại: Fe → Fe2+ + 2e
→ Chọn A.
CH tr 69 BT6
Trả lời câu hỏi Bài tập 6 trang 69 SGK Hóa 12 Chân trời sáng tạo
Dựa vào Bảng 12.1, tính sức điện động chuẩn của các pin điện hoá tạo bởi các cặp oxi hoá - khử sau: Fe2+/Fe và Cu2+/Cu; Sn2+/Sn và Ag+/Ag; Pb2+/Pb và Ag+/Ag.
Phương pháp giải:
Sức điện động chuẩn của pin: \({\rm{E}}_{{\rm{pin}}}^{\rm{o}} = {\rm{E}}_{\rm{ + }}^{\rm{o}} - {\rm{E}}_ - ^{\rm{o}}\)
Lời giải chi tiết:
- Pin : Fe2+/Fe và Cu2+/Cu
\({\rm{E}}_{{\rm{pin}}}^{\rm{o}} = {\rm{E}}_{{\rm{C}}{{\rm{u}}^{{\rm{2 + }}}}{\rm{/Cu}}}^{\rm{o}} - {\rm{E}}_{{\rm{F}}{{\rm{e}}^{{\rm{2 + }}}}{\rm{/Fe}}}^{\rm{o}} = 0,34 - ( - 0,44) = 0,78{\rm{ (V)}}\)
- Pin : Sn2+/Sn và Ag+/Ag
\({\rm{E}}_{{\rm{pin}}}^{\rm{o}} = {\rm{E}}_{{\rm{A}}{{\rm{g}}^{{\rm{2 + }}}}{\rm{/Ag}}}^{\rm{o}} - {\rm{E}}_{{\rm{S}}{{\rm{n}}^{{\rm{2 + }}}}{\rm{/Sn}}}^{\rm{o}} = 0,8 - ( - 0,14) = 0,94{\rm{ (V)}}\)
- Pin : Pb2+/Pb và Ag+/Ag
\({\rm{E}}_{{\rm{pin}}}^{\rm{o}} = {\rm{E}}_{{\rm{A}}{{\rm{g}}^{{\rm{2 + }}}}{\rm{/Ag}}}^{\rm{o}} - {\rm{E}}_{{\rm{P}}{{\rm{b}}^{{\rm{2 + }}}}{\rm{/Pb}}}^{\rm{o}} = 0,8 - ( - 0,13) = 0,93{\rm{ (V)}}\)
Luyện Bài Tập Trắc nghiệm Hóa 12 - Chân trời sáng tạo - Xem ngay
Các bài khác cùng chuyên mục
- Lý thuyết Sơ lược về phức chất và sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch - Hóa 12 Chân trời sáng tạo
- Lý thuyết Đại cương về kim loại chuyển tiếp dãy thứ nhất - Hóa 12 Chân trời sáng tạo
- Lý thuyết Nguyên tố nhóm IIA - Hóa 12 Chân trời sáng tạo
- Lý thuyết Nguyên tố nhóm IA - Hóa 12 Chân trời sáng tạo
- Lý thuyết Hợp kim – Sự ăn mòn kim loại - Hóa 12 Chân trời sáng tạo
- Lý thuyết Sơ lược về phức chất và sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch - Hóa 12 Chân trời sáng tạo
- Lý thuyết Đại cương về kim loại chuyển tiếp dãy thứ nhất - Hóa 12 Chân trời sáng tạo
- Lý thuyết Nguyên tố nhóm IIA - Hóa 12 Chân trời sáng tạo
- Lý thuyết Nguyên tố nhóm IA - Hóa 12 Chân trời sáng tạo
- Lý thuyết Hợp kim – Sự ăn mòn kim loại - Hóa 12 Chân trời sáng tạo












Danh sách bình luận