 Hóa 12 ctst, giải hóa 12 chân trời sáng tạo
Hóa 12 ctst, giải hóa 12 chân trời sáng tạo
 Chương 5. Pin điện và điện phân - Hóa 12 Chân trời sáng..
Chương 5. Pin điện và điện phân - Hóa 12 Chân trời sáng.. Bài 13. Điện phân trang 70, 71, 72 Hóa 12 Chân trời sáng tạo
Pin điện hoá hoạt động dựa trên các phản ứng oxi hoá - khử
CH tr 70 MĐ
Trả lời câu hỏi Mở đầu trang 70 SGK Hóa 12 Chân trời sáng tạo
Pin điện hoá hoạt động dựa trên các phản ứng oxi hoá - khử tự xảy ra trong pin (hoá năng chuyển thành điện năng). Tuy nhiên, một số phản ứng oxi hoá - khử chỉ có thể xảy ra nhờ năng lượng dòng điện, được gọi là phản ứng điện phân (điện năng chuyển thành hoá năng).
Khi điện phân, các quá trình trên bề mặt điện cực xảy ra theo nguyên tắc nào? Điện phân có ứng dụng gì trong đời sống, sản xuất?
Phương pháp giải:
Nêu nguyên tắc, ứng dụng của điện phân.
Lời giải chi tiết:
- Nguyên tắc điện phân:
+ Nguyên tắc điện phân nóng chảy:
• Tại cathode (điện cực âm): xảy ra quá trình khử ion dương.
• Tại anode (điện cực dương): xảy ra quá trình oxi hoá ion âm.
+ Nguyên tắc điện phân dung dịch: ở cathode, ưu tiên điện phân chất có tính oxi hoá mạnh hơn; ở anode, ưu tiên điện phân chất có tính khử mạnh hơn.
- Ứng dụng: điều chế, tinh chế một số kim loại, mạ điện,...
CH tr 70 TL1
Trả lời câu hỏi Thảo luận trang 70 SGK Hóa 12 Chân trời sáng tạo
Xác định sản phẩm tạo thành ở hai điện cực khi điện phân NaCl nóng chảy.
Phương pháp giải:
Nguyên tắc điện phân nóng chảy:
• Tại cathode (điện cực âm): xảy ra quá trình khử ion dương.
• Tại anode (điện cực dương): xảy ra quá trình oxi hoá ion âm.
Lời giải chi tiết:
Sản phẩm tạo thành ở hai điện cực khi điện phân NaCl nóng chảy:
- Cathode: Na.
- Anode: Cl2.
CH tr 70 LT
Trả lời câu hỏi Luyện tập trang 70 SGK Hóa 12 Chân trời sáng tạo
Viết phương trình hoá học của quá trình điện phân nóng chảy các chất: MgCl2, Al2O3.
Phương pháp giải:
Nguyên tắc điện phân nóng chảy:
• Tại cathode (điện cực âm): xảy ra quá trình khử ion dương.
• Tại anode (điện cực dương): xảy ra quá trình oxi hoá ion âm.
Lời giải chi tiết:
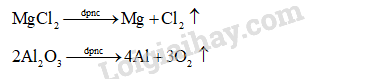
CH tr 71 TL1
Trả lời câu hỏi Thảo luận 1 trang 71 SGK Hóa 12 Chân trời sáng tạo
Tiến hành Thí nghiệm 1 và nêu hiện tượng quan sát được.
Phương pháp giải:
Dựa vào phương trình điện phân để nêu hiện tượng:
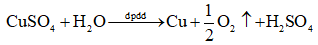
Lời giải chi tiết:
Hiện tượng: kim loại đồng (màu đỏ) bám vào cathode, sủi bọt khí không màu (O2) thoát ra ở anode.
CH tr 71 TL2
Trả lời câu hỏi Thảo luận 2 trang 71 SGK Hóa 12 Chân trời sáng tạo
Cho biết khi điện phân dung dịch CuSO4 ion Cu2+ và \({\rm{SO}}_4^{2 - }\) di chuyển về điện cực nào.
Phương pháp giải:
Nguyên tắc điện phân dung dịch: ở cathode, ưu tiên điện phân chất có tính oxi hoá mạnh hơn; ở anode, ưu tiên điện phân chất có tính khử mạnh hơn.
Lời giải chi tiết:
- Ion Cu2+ di chuyển về điện cực âm (cathode).
- Ion \({\rm{SO}}_4^{2 - }\) di chuyển về điện cực dương (anode).
CH tr 72 TL
Trả lời câu hỏi Thảo luận trang 72 SGK Hóa 12 Chân trời sáng tạo
Tiến hành Thí nghiệm 2 và nêu hiện tượng xảy ra. Giải thích.
Phương pháp giải:
Dựa vào phương trình điện phân để nêu hiện tượng:
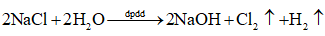
Dựa vào sơ đồ điện phân để giải thích.
Lời giải chi tiết:
- Hiện tượng: ở cả hai điện cực đều thoát ra khí không màu.
- Giải thích: Xét sơ đồ điện phân
Cathode (-) NaCl Anode (+)
Na+, H2O H2O Cl-, H2O
\({\rm{2}}{{\rm{H}}_{\rm{2}}}{\rm{O}} + 2{\rm{e}} \to 2{\rm{O}}{{\rm{H}}^ - } + {{\rm{H}}_2}\) \(2{\rm{C}}{{\rm{l}}^ - } \to {\rm{C}}{{\rm{l}}_2} + 2{\rm{e}}\)
CH tr 72 LT
Trả lời câu hỏi Luyện tập trang 72 SGK Hóa 12 Chân trời sáng tạo
Viết quá trình xảy ra ở mỗi điện cực và phương trình hoá học của phản ứng điện phân khi điện phân dung dịch: AgNO3; CuCl2 với điện cực graphite.
Phương pháp giải:
Nguyên tắc điện phân dung dịch: ở cathode, ưu tiên điện phân chất có tính oxi hoá mạnh hơn; ở anode, ưu tiên điện phân chất có tính khử mạnh hơn.
Lời giải chi tiết:
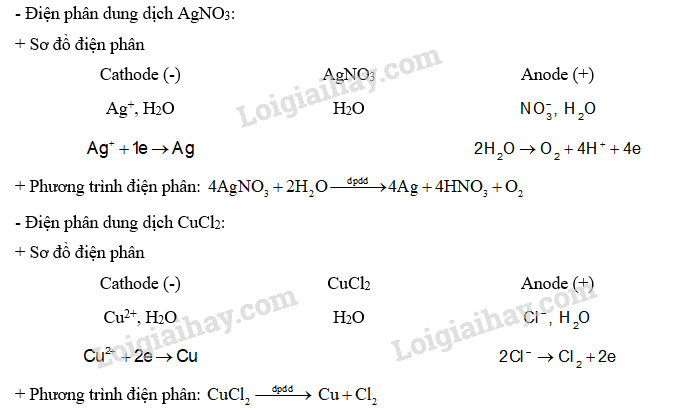
CH tr 73
Trả lời câu hỏi Thảo luận trang 73 SGK Hóa 12 Chân trời sáng tạo
Em hãy tìm hiểu và nêu một số ứng dụng của phương pháp điện phân trong thực tiễn.
Phương pháp giải:
Nêu các ứng dụng của điện phân trong thực tiễn từ thông tin trong SGK.
Lời giải chi tiết:
- Sản xuất kim loại: Trong công nghiệp, các kim loại mạnh (Na, K, Ca, Mg, Al,…) được điều chế bằng phương pháp điện phân nóng chảy, các kim loại yếu và trung bình được điều chế bằng phương pháp điện phân dung dịch.
- Tinh chế kim loại: các kim loại từ nguồn kim loại thô được tinh chế bằng phương pháp điện phân.
- Mạ điện: ion kim loại bị khử, tạo thành lớp kim loại rắn bao phủ trên bề mặt kim loại cần mạ nhằm trang trí bề mặt hoặc chống sự ăn mòn.
CH tr 74 BT1
Trả lời câu hỏi Bài tập 1 trang 74 SGK Hóa 12 Chân trời sáng tạo
Điện phân CaCl2 nóng chảy, ở cathode xảy ra quá trình nào?
A. Oxi hoá ion Ca2+. B. Khử ion Ca2+.
C. Oxi hoá ion Cl-. D. Khử ion Cl-.
Phương pháp giải:
Nguyên tắc điện phân nóng chảy:
• Tại cathode (điện cực âm): xảy ra quá trình khử ion dương.
• Tại anode (điện cực dương): xảy ra quá trình oxi hoá ion âm.
Lời giải chi tiết:
Điện phân CaCl2 nóng chảy, ở cathode xảy ra quá trình khử Ca2+: \({\rm{C}}{{\rm{a}}^{2 + }} + 2{\rm{e}} \to {\rm{Ca}}\)
→ Chọn B.
CH tr 74 BT2
Trả lời câu hỏi Bài tập 2 trang 74 SGK Hóa 12 Chân trời sáng tạo
Điện phân dung dịch Cu(NO3)2 với điện cực trơ, ở anode xảy ra quá trình nào?
\(\begin{array}{l}{\rm{A}}{\rm{. }}{{\rm{H}}_{\rm{2}}}{\rm{O }} \to \frac{1}{2}{{\rm{O}}_{\rm{2}}}{\rm{ + 2}}{{\rm{H}}^{\rm{ + }}}{\rm{ + 2e}}{\rm{.}}\\{\rm{B}}{\rm{. 2}}{{\rm{H}}_{\rm{2}}}{\rm{O + 2e}} \to {{\rm{H}}_{\rm{2}}}{\rm{ + 2O}}{{\rm{H}}^ - }.\\{\rm{C}}{\rm{. Cu}} \to {\rm{C}}{{\rm{u}}^{{\rm{2 + }}}}{\rm{ + 2e}}{\rm{.}}\\{\rm{D}}{\rm{. C}}{{\rm{u}}^{{\rm{2 + }}}}{\rm{ + 2e}} \to {\rm{Cu}}.\end{array}\)
Phương pháp giải:
Nguyên tắc điện phân dung dịch: ở cathode, ưu tiên điện phân chất có tính oxi hoá mạnh hơn; ở anode, ưu tiên điện phân chất có tính khử mạnh hơn.
Lời giải chi tiết:
Ở anode, ion \({\rm{NO}}_3^ - \)không bị điện phân, H2O bị điện phân:
\({\rm{2}}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {{\rm{O}}_2} + 4{{\rm{H}}^ + } + 4{\rm{e}}\)hay có thể viết \({{\rm{H}}_{\rm{2}}}{\rm{O }} \to \frac{1}{2}{{\rm{O}}_{\rm{2}}}{\rm{ + 2}}{{\rm{H}}^{\rm{ + }}}{\rm{ + 2e}}\)
→ Chọn A.
CH tr 74 BT3
Trả lời câu hỏi Bài tập 3 trang 74 SGK Hóa 12 Chân trời sáng tạo
Viết phương trình hoá học của phản ứng điện phân khi điện phân KCl nóng chảy.
Phương pháp giải:
Nguyên tắc điện phân nóng chảy:
• Tại cathode (điện cực âm): xảy ra quá trình khử ion dương.
• Tại anode (điện cực dương): xảy ra quá trình oxi hoá ion âm.
Lời giải chi tiết:
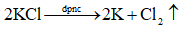
CH tr 74 BT4
Trả lời câu hỏi Bài tập 4 trang 74 SGK Hóa 12 Chân trời sáng tạo
Hãy đề xuất và trình bày cách mạ đồng (Cu) lên một đồ vật làm từ sắt (Fe) bằng phương pháp điện phân.
Phương pháp giải:
Mạ điện: ion kim loại bị khử, tạo thành lớp kim loại rắn bao phủ trên bề mặt kim loại cần mạ nhằm trang trí bề mặt hoặc chống sự ăn mòn.
Lời giải chi tiết:
- Sử dụng bình mạ điện chứa dung dịch CuCl2, thanh kim loại đồng (anode) và vật dụng bằng sắt (cathode).
- Trong bình mạ điện sẽ xảy ra các quá trình khử anode (+): \({\rm{C}}{{\rm{u}}^{{\rm{2 + }}}}{\rm{ + 2e}} \to {\rm{Cu}}\)
Đồng tan và bám vào cathode (vật dụng bằng sắt).
Luyện Bài Tập Trắc nghiệm Hóa 12 - Chân trời sáng tạo - Xem ngay
Các bài khác cùng chuyên mục
- Lý thuyết Sơ lược về phức chất và sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch - Hóa 12 Chân trời sáng tạo
- Lý thuyết Đại cương về kim loại chuyển tiếp dãy thứ nhất - Hóa 12 Chân trời sáng tạo
- Lý thuyết Nguyên tố nhóm IIA - Hóa 12 Chân trời sáng tạo
- Lý thuyết Nguyên tố nhóm IA - Hóa 12 Chân trời sáng tạo
- Lý thuyết Hợp kim – Sự ăn mòn kim loại - Hóa 12 Chân trời sáng tạo
- Lý thuyết Sơ lược về phức chất và sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch - Hóa 12 Chân trời sáng tạo
- Lý thuyết Đại cương về kim loại chuyển tiếp dãy thứ nhất - Hóa 12 Chân trời sáng tạo
- Lý thuyết Nguyên tố nhóm IIA - Hóa 12 Chân trời sáng tạo
- Lý thuyết Nguyên tố nhóm IA - Hóa 12 Chân trời sáng tạo
- Lý thuyết Hợp kim – Sự ăn mòn kim loại - Hóa 12 Chân trời sáng tạo












Danh sách bình luận