Trắc nghiệm Bài 10. Quy tắc octet - Hóa 10 Kết nối tri thức
Đề bài
Liên kết hóa học là
-
A.
sự kết hợp của các hạt cơ bản hình thành nguyên tử bền vững
-
B.
sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn
-
C.
sự kết hợp của các phân tử hình thành các chất bền vững
-
D.
sự kết hợp của chất tạo thành vật thể bền vững
Theo nguyên tắc octet, khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững giống như
-
A.
kim loại kiềm gần kề
-
B.
kim loại kiềm thổ gần kề
-
C.
nguyên tử halogen gần kề
-
D.
nguyên tử khí hiếm gần kề
Khi hình thành liên kết hóa học, nguyên tử có số hiệu nào sau đây có xu hướng nhường 2 electron để đạt cấu hình electron bền vững theo quy tắc octet?
-
A.
Z = 12
-
B.
Z = 9
-
C.
Z = 11
-
D.
Z = 10
Liên kết hoá học là
-
A.
sự kết hợp của các hạt cơ bản hình thành nguyên tử bền vững.
-
B.
sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
-
C.
sự kết hợp của các phân tử hình thành các chất bền vững.
-
D.
sự kết hợp của chất tạo thành vật thể bền vững.
Theo quy tắc octet, khi hình thành liên kết hoá học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững giống như
-
A.
kim loại kiềm gần kề.
-
B.
kim loại kiềm thổ gần kề.
-
C.
nguyên tử halogen gần kề.
-
D.
nguyên tử khí hiếm gần kể.
Khi hình thành liên kết hoá học, nguyên tử có số hiệu nào sau đây có xu hướng nhường 2 electron để đạt cấu hình electron bền vững theo quy tắc octet?
-
A.
(Z = 12).
-
B.
(Z = 9).
-
C.
(Z=11).
-
D.
(Z=10).
Công thức cấu tạo nào sau đây không đủ electron theo quy tắc octet?
-
A.
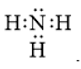
-
B.
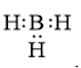
-
C.
-
D.
Trong công thức CS2, tổng số cặp electron lớp ngoài cùng của C và S chưa tham gia liên kết là
-
A.
2
-
B.
3
-
C.
4
-
D.
5
Phân tử nào sau đây có các nguyên tử đều đã đạt cấu hình electron bão hòa theo quy tắc octet?
-
A.
BeH2.
-
B.
AlCl3.
-
C.
PCl5.
-
D.
SiF4
Quy tắc octet không đúng với trường hợp phân tử chất nào sau đây?
-
A.
H2O.
-
B.
NO2.
-
C.
CO2.
-
D.
Cl2.
Vì sao các nguyên tử lại liên kết với nhau thành phân tử?
-
A.
Để mỗi nguyên tử trong phân tử đạt được cơ cấu electron ổn định, bền vững.
-
B.
Để mỗi nguyên tử trong phân tử đều đạt 8 electron ở lớp ngoài cùng.
-
C.
Để tổng số electron ngoài cùng của các nguyên tử trong phân tử là 8.
-
D.
Để lớp ngoài cùng của mỗi nguyên tử trong phân tử có nhiều electron độc thân nhất.
Nguyên tử nào sau đây có khuynh hướng đạt cấu hình electron bền của khí hiếm neon khi tham gia hình thành liên kết hóa học?
-
A.
Chlorine.
-
B.
Sulfur.
-
C.
Oxygen.
-
D.
Hydrogen.
Sodium hydride (NaH) là một hợp chất được sử dụng như một chất lưu trữ hydrogen trong các phương tiện chạy bằng pin nhiên liệu do khả năng giải phóng hydrogen của nó. Trong sodium hydride, nguyên tử sodium có cấu hình electron bền của khí hiếm
-
A.
helium.
-
B.
argon
-
C.
krypton.
-
D.
neon.
Khi tham gia hình thành liên kết hoá học, các nguyên tử lithium và chlorine có khuynh hướng đạt cấu hình electron bền của lần lượt các khí hiếm nào dưới đây?
-
A.
Helium và argon.
-
B.
Helium và Neon.
-
C.
Neon và argon.
-
D.
Argon và helium.
Trong phân tử HBr, nguyên tử hydrogen và bromine đã lần lượt đạt cấu hình electron bền của các khí hiếm nào dưới đây?
-
A.
Helium và Chlorine
-
B.
Helium và xenon.
-
C.
Helium và radon.
-
D.
Helium và krypton.
Trong các hợp chất, nguyên tử magnesium đã đạt được cấu hình bền của khí hiếm gần nhất bằng cách
-
A.
cho đi 2 electron.
-
B.
nhận vào 1 electron.
-
C.
cho đi 3 electron.
-
D.
nhận vào 2 electron.
Cho các phân tử sau: Cl2, H2O, NaF và CH4. Có bao nhiêu nguyên tử trong các phân tử trên đạt cấu hình electron bền của khí hiếm neon?
-
A.
3
-
B.
2
-
C.
5
-
D.
4
Nguyên tử trong phân tử nào dưới đây ngoại lệ với quy tắc octet?
-
A.
H2O.
-
B.
NH3.
-
C.
HCl.
-
D.
BF3.
Lời giải và đáp án
Liên kết hóa học là
-
A.
sự kết hợp của các hạt cơ bản hình thành nguyên tử bền vững
-
B.
sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn
-
C.
sự kết hợp của các phân tử hình thành các chất bền vững
-
D.
sự kết hợp của chất tạo thành vật thể bền vững
Đáp án : B
Liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn
Theo nguyên tắc octet, khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững giống như
-
A.
kim loại kiềm gần kề
-
B.
kim loại kiềm thổ gần kề
-
C.
nguyên tử halogen gần kề
-
D.
nguyên tử khí hiếm gần kề
Đáp án : D
Khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của khí hiếm
Khi hình thành liên kết hóa học, nguyên tử có số hiệu nào sau đây có xu hướng nhường 2 electron để đạt cấu hình electron bền vững theo quy tắc octet?
-
A.
Z = 12
-
B.
Z = 9
-
C.
Z = 11
-
D.
Z = 10
Đáp án : A
Viết cấu hình electron của các nguyên tử có số hiệu nguyên tử Z = 12, 9, 11, 10
Nguyên tử nào có 2 electron ở lớp ngoài cùng
=> Có xu hướng nhường 2 electron
Z = 12: 1s22s22p63s2
Z = 9: 1s22s22p5
Z = 11: 1s22s22p63s1
Z = 10: 1s22s22p6
Ta thấy nguyên tử có Z = 12 thì có 2 electron ở lớp ngoài cùng
=> Có xu hướng nhường 2 electron
Liên kết hoá học là
-
A.
sự kết hợp của các hạt cơ bản hình thành nguyên tử bền vững.
-
B.
sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
-
C.
sự kết hợp của các phân tử hình thành các chất bền vững.
-
D.
sự kết hợp của chất tạo thành vật thể bền vững.
Đáp án : B
Dựa vào định nghĩa của liên kết hóa học: liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn
- Đáp án: B
Theo quy tắc octet, khi hình thành liên kết hoá học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững giống như
-
A.
kim loại kiềm gần kề.
-
B.
kim loại kiềm thổ gần kề.
-
C.
nguyên tử halogen gần kề.
-
D.
nguyên tử khí hiếm gần kể.
Đáp án : D
Dựa vào
- Quy tắc octet: Trong quá trình hình thành liên kết hóa học, nguyên tử của các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm Helium)
- Đáp án: D
Khi hình thành liên kết hoá học, nguyên tử có số hiệu nào sau đây có xu hướng nhường 2 electron để đạt cấu hình electron bền vững theo quy tắc octet?
-
A.
(Z = 12).
-
B.
(Z = 9).
-
C.
(Z=11).
-
D.
(Z=10).
Đáp án : A
- Bước 1: Xác định vị trí nguyên tử của nguyên tố trong bảng tuần hoàn
- Bước 2: Xác định vị trí khí hiếm gần nhất với nguyên tố đó
+ Nếu khí hiếm đứng trước nguyên tử của nguyên tố đang xét => cho đi (trừ đi) số electron = sự chênh lệch vị trí giữa hai nguyên tố
+ Nếu khí hiếm đứng sau nguyên tử của nguyên tố đang xét => nhận thêm (cộng thêm) số electron = sự chênh lệch vị trí giữa hai nguyên tố
- Bước 1: Vị trí của các nguyên tố trong bảng tuần hoàn hóa học
|
Nhóm Chu kì |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
VIIIA |
|
1 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
Z=9 |
Z=10 |
|
3 |
Z=11 |
Z=12 |
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
- Bước 2:
+ Nguyên tố này có xu hướng nhường 2 electron để đạt cấu hình electron bền vững
+ Khí hiếm gần 4 nguyên tố trong đề cho nhất là Z=10
=> Nguyên tử này sẽ ở ô số 10 + 2 = 12
=> Đáp án: A
Công thức cấu tạo nào sau đây không đủ electron theo quy tắc octet?
-
A.
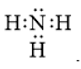
-
B.
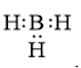
-
C.
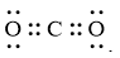
-
D.
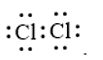
Đáp án : B
Dựa vào
- Quy tắc octet: Trong quá trình hình thành liên kết hóa học, nguyên tử của các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm Helium)
- Đáp án: B vì lớp vỏ ngoài cùng của nguyên tử B mới chỉ có 6 electron
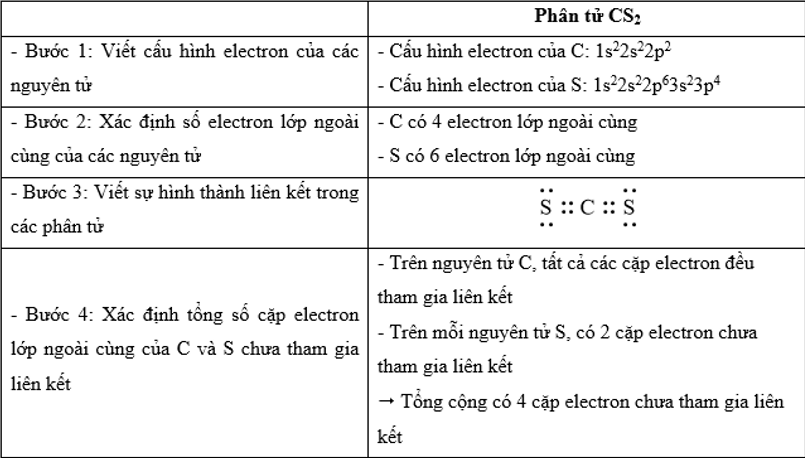
Trong công thức CS2, tổng số cặp electron lớp ngoài cùng của C và S chưa tham gia liên kết là
-
A.
2
-
B.
3
-
C.
4
-
D.
5
Đáp án : C
Dựa vào
- Quy tắc octet: Trong quá trình hình thành liên kết hóa học, nguyên tử của các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm Helium)
- Các bước thực hiện:
+ Bước 1: Viết cấu hình electron của các nguyên tử
+ Bước 2: Xác định số electron lớp ngoài cùng của các nguyên tử
+ Bước 3: Viết sự hình thành liên kết trong các phân tử
+ Bước 4: Xác định tổng số cặp electron lớp ngoài cùng của C và S chưa tham gia liên kết
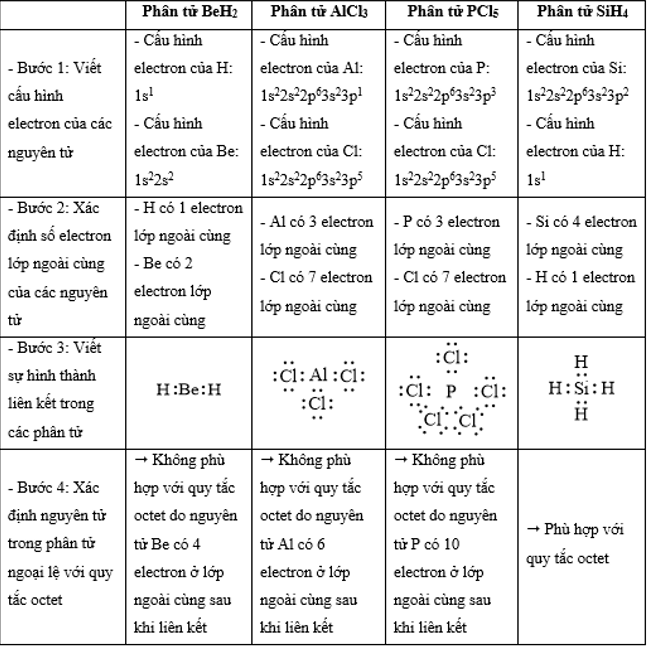
Phân tử nào sau đây có các nguyên tử đều đã đạt cấu hình electron bão hòa theo quy tắc octet?
-
A.
BeH2.
-
B.
AlCl3.
-
C.
PCl5.
-
D.
SiF4
Đáp án : D
Dựa vào
- Quy tắc octet: Trong quá trình hình thành liên kết hóa học, nguyên tử của các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm Helium)
- Các bước thực hiện:
+ Bước 1: Viết cấu hình electron của các nguyên tử
+ Bước 2: Xác định số electron lớp ngoài cùng của các nguyên tử
+ Bước 3: Viết sự hình thành liên kết trong các phân tử
+ Bước 4: Xác định nguyên tử trong phân tử ngoại lệ với quy tắc octet
Quy tắc octet không đúng với trường hợp phân tử chất nào sau đây?
-
A.
H2O.
-
B.
NO2.
-
C.
CO2.
-
D.
Cl2.
Đáp án : B
Dựa vào
- Quy tắc octet: Trong quá trình hình thành liên kết hóa học, nguyên tử của các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm Helium)
- Các bước thực hiện:
+ Bước 1: Viết cấu hình electron của các nguyên tử
+ Bước 2: Xác định số electron lớp ngoài cùng của các nguyên tử
+ Bước 3: Viết sự hình thành liên kết trong các phân tử
+ Bước 4: Xác định nguyên tử trong phân tử ngoại lệ với quy tắc octet
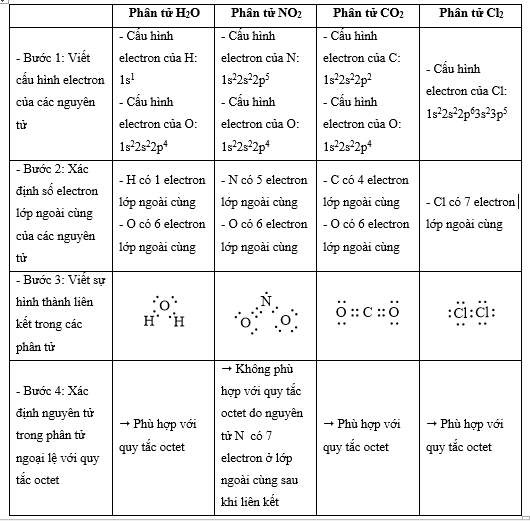
=> Đáp án: B
Vì sao các nguyên tử lại liên kết với nhau thành phân tử?
-
A.
Để mỗi nguyên tử trong phân tử đạt được cơ cấu electron ổn định, bền vững.
-
B.
Để mỗi nguyên tử trong phân tử đều đạt 8 electron ở lớp ngoài cùng.
-
C.
Để tổng số electron ngoài cùng của các nguyên tử trong phân tử là 8.
-
D.
Để lớp ngoài cùng của mỗi nguyên tử trong phân tử có nhiều electron độc thân nhất.
Đáp án : A
Để đạt cấu hình electron bền vững của khí hiếm gần nhất, các nguyên tử của các nguyên tố có xu hướng nhường, hoặc nhận thêm, hoặc góp chung các electron hóa trị với các nguyên tử khác khi tham gia liên kết hóa học.
- Đáp án: A
Nguyên tử nào sau đây có khuynh hướng đạt cấu hình electron bền của khí hiếm neon khi tham gia hình thành liên kết hóa học?
-
A.
Chlorine.
-
B.
Sulfur.
-
C.
Oxygen.
-
D.
Hydrogen.
Đáp án : C
- Bước 1: Xác định vị trí nguyên tử của nguyên tố trong bảng tuần hoàn
- Bước 2: Tìm nguyên tử đó dựa vào: nguyên tử của nguyên tố có khuynh hướng đạt cấu hình electron bền của khí hiếm ở gần nó nhất
- Bước 1: Vị trí của các nguyên tố trong bảng tuần hoàn hóa học
|
Nhóm Chu kì |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
VIIIA |
|
1 |
H |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
O |
|
Ne |
|
3 |
|
|
|
|
|
S |
Cl |
|
|
4 |
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
- Bước 2: Nguyên tố Oxygen có vị trí gần với khí hiếm Neon nhất
=> Đáp án: C
Sodium hydride (NaH) là một hợp chất được sử dụng như một chất lưu trữ hydrogen trong các phương tiện chạy bằng pin nhiên liệu do khả năng giải phóng hydrogen của nó. Trong sodium hydride, nguyên tử sodium có cấu hình electron bền của khí hiếm
-
A.
helium.
-
B.
argon
-
C.
krypton.
-
D.
neon.
Đáp án : D
- Bước 1: Xác định vị trí nguyên tử của nguyên tố trong bảng tuần hoàn
- Bước 2: Xác định vị trí khí hiếm gần nhất với nguyên tố đó
- Bước 1: Vị trí của các nguyên tố trong bảng tuần hoàn hóa học
|
Nhóm Chu kì |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
VIIIA |
|
1 |
|
|
|
|
|
|
|
He |
|
2 |
|
|
|
|
|
|
|
Ne |
|
3 |
Na |
|
|
|
|
|
|
Ar |
|
4 |
|
|
|
|
|
|
|
Kr |
|
5 |
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
- Bước 2: Nguyên tố Sodium có vị trí gần với khí hiếm Neon nhất
=> Đáp án: D
Khi tham gia hình thành liên kết hoá học, các nguyên tử lithium và chlorine có khuynh hướng đạt cấu hình electron bền của lần lượt các khí hiếm nào dưới đây?
-
A.
Helium và argon.
-
B.
Helium và Neon.
-
C.
Neon và argon.
-
D.
Argon và helium.
Đáp án : A
- Bước 1: Xác định vị trí nguyên tử của nguyên tố trong bảng tuần hoàn
- Bước 2: Xác định vị trí khí hiếm gần nhất với nguyên tố đó
- Bước 1: Vị trí của các nguyên tố trong bảng tuần hoàn hóa học
|
Nhóm Chu kì |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
VIIIA |
|
1 |
|
|
|
|
|
|
|
He |
|
2 |
Li |
|
|
|
|
|
|
Ne |
|
3 |
|
|
|
|
|
|
Cl |
Ar |
|
4 |
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
- Bước 2:
+ Nguyên tố Lithium có vị trí gần với khí hiếm Helium nhất
+ Nguyên tố Chlorine có vị trí gần với khí hiếm Argon nhất
=> Đáp án: C
Trong phân tử HBr, nguyên tử hydrogen và bromine đã lần lượt đạt cấu hình electron bền của các khí hiếm nào dưới đây?
-
A.
Helium và Chlorine
-
B.
Helium và xenon.
-
C.
Helium và radon.
-
D.
Helium và krypton.
Đáp án : D
- Bước 1: Xác định vị trí nguyên tử của nguyên tố trong bảng tuần hoàn
- Bước 2: Xác định vị trí khí hiếm gần nhất với nguyên tố đó
- Bước 1: Vị trí của các nguyên tố trong bảng tuần hoàn hóa học
|
Nhóm Chu kì |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
VIIIA |
|
1 |
H |
|
|
|
|
|
|
He |
|
2 |
|
|
|
|
|
|
|
Ne |
|
3 |
|
|
|
|
|
|
|
Ar |
|
4 |
|
|
|
|
|
|
Br |
Kr |
|
5 |
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
- Bước 2:
+ Nguyên tố Hydrogen có vị trí gần với khí hiếm Helium nhất
+ Nguyên tố Bromine có vị trí gần với khí hiếm Krypton nhất
=> Đáp án: D
Trong các hợp chất, nguyên tử magnesium đã đạt được cấu hình bền của khí hiếm gần nhất bằng cách
-
A.
cho đi 2 electron.
-
B.
nhận vào 1 electron.
-
C.
cho đi 3 electron.
-
D.
nhận vào 2 electron.
Đáp án : A
- Bước 1: Xác định vị trí nguyên tử của nguyên tố trong bảng tuần hoàn
- Bước 2: Xác định vị trí khí hiếm gần nhất với nguyên tố đó
+ Nếu khí hiếm đứng trước nguyên tử của nguyên tố đang xét " cho đi (trừ đi) số electron = sự chênh lệch vị trí giữa hai nguyên tố
+ Nếu khí hiếm đứng sau nguyên tử của nguyên tố đang xét " nhận thêm (cộng thêm) số electron = sự chênh lệch vị trí giữa hai nguyên tố
- Bước 1: Vị trí của các nguyên tố trong bảng tuần hoàn hóa học
|
Nhóm Chu kì |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
VIIIA |
|
1 |
|
|
|
|
|
|
|
He |
|
2 |
|
|
|
|
|
|
|
Ne |
|
3 |
|
Mg |
|
|
|
|
|
Ar |
|
4 |
|
|
|
|
|
|
|
Kr |
|
5 |
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
- Bước 2: Nguyên tố Magnesium (ô số 12) có vị trí gần với khí hiếm Neon (ô số 10) nhất
=> Nguyên tử của nguyên tố Magnesium sẽ cho đi 12 - 10 = 2 electron để đạt cấu hình của khí hiếm gần nhất
=> Đáp án: A
Cho các phân tử sau: Cl2, H2O, NaF và CH4. Có bao nhiêu nguyên tử trong các phân tử trên đạt cấu hình electron bền của khí hiếm neon?
-
A.
3
-
B.
2
-
C.
5
-
D.
4
Đáp án : D
- Bước 1: Xác định vị trí nguyên tử của nguyên tố trong bảng tuần hoàn
- Bước 2: Xác định vị trí khí hiếm gần nhất với nguyên tố đó
- Bước 1: Vị trí của các nguyên tố trong bảng tuần hoàn hóa học
|
Nhóm Chu kì |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
VIIIA |
|
1 |
H |
|
|
|
|
|
|
He |
|
2 |
|
|
|
C |
|
O |
F |
Ne |
|
3 |
Na |
|
|
|
|
|
Cl |
Ar |
|
4 |
|
|
|
|
|
|
|
Kr |
|
5 |
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
- Bước 2: Các nguyên tố Carbon, Oxygen, Fluorine và Sodium có vị trí gần với khí hiếm Neon nhất
=> Đáp án: D
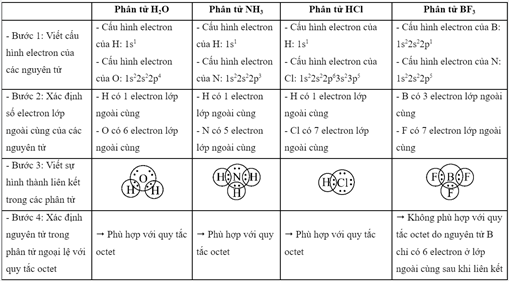
Nguyên tử trong phân tử nào dưới đây ngoại lệ với quy tắc octet?
-
A.
H2O.
-
B.
NH3.
-
C.
HCl.
-
D.
BF3.
Đáp án : D
- Quy tắc octet: Trong quá trình hình thành liên kết hóa học, nguyên tử của các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm Helium)
- Các bước thực hiện:
+ Bước 1: Viết cấu hình electron của các nguyên tử
+ Bước 2: Xác định số electron lớp ngoài cùng của các nguyên tử
+ Bước 3: Viết sự hình thành liên kết trong các phân tử
+ Bước 4: Xác định nguyên tử trong phân tử ngoại lệ với quy tắc octet
Luyện tập và củng cố kiến thức Bài 11. Liên kết ion Hóa 10 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 12. Liên kết cộng hóa trị Hóa 10 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 13. Liên kết hydrogen và tương tác van der Waals Hóa 10 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
- Trắc nghiệm Bài 22. Hydrogen halide. Muối halide - Hóa 10 Kết nối tri thức
- Trắc nghiệm Bài 21. Nhóm halogen - Hóa 10 Kết nối tri thức
- Trắc nghiệm Bài 19. Tốc độ phản ứng - Hóa 10 Kết nối tri thức
- Trắc nghiệm Bài 17. Biến thiên enthalpy trong các phản ứng hóa học - Hóa 10 Kết nối tri thức
- Trắc nghiệm Bài 15. Phản ứng oxi hóa - khử - Hóa 10 Kết nối tri thức










Danh sách bình luận