Trắc nghiệm Bài 2. Nguyên tố hóa học - Hóa 10 Kết nối tri thức
Đề bài
Nguyên tố hóa học là những nguyên tử có cùng
-
A.
số khối
-
B.
số neutron
-
C.
số proton
-
D.
số neutron và số proton
Kí hiệu nguyên tử biểu thị đầy đủ đặc trưng cho một nguyên tử của một nguyên tố hóa học vì nó cho biết
-
A.
số khối A
-
B.
số hiệu nguyên tử Z
-
C.
nguyên tử khối của nguyên tử
-
D.
số khối A và số hiệu nguyên tử Z
Nguyên tố carbon có hai đồng vị bền: \({}_6^{12}C\) chiếm 98,89% và \({}_6^{13}C\) chiếm 1,11%. Nguyên tử khối trung bình của nguyên tố carbon là
-
A.
12,500
-
B.
12,011
-
C.
12,022
-
D.
12,055
Trong dãy kí hiệu các nguyên tử sau:
\({}_7^{14}A\), \({}_9^{19}B\), \({}_{26}^{56}E\), \({}_{27}^{56}F\), \({}_8^{17}G\), \({}_{10}^{20}H\), \({}_{11}^{23}I\), \({}_{10}^{22}K\)
Các kí hiệu nào chỉ cùng 1 nguyên tố hóa học?
-
A.
A, G và B
-
B.
H và K
-
C.
H, I và K
-
D.
E và F
Cho ba nguyên tử có kí hiệu là \({}_{12}^{24}Mg\), \({}_{12}^{25}Mg\), \({}_{12}^{26}Mg\). Phát biểu nào sau đây sai?
-
A.
Số hạt electron của các nguyên tử lần lượt là: 12, 13, 14
-
B.
Đây là 3 đồng vị
-
C.
Ba nguyên tử trên đều thuộc nguyên tố Mg
-
D.
Hạt nhân của mỗi nguyên tử đều có 12 proton
Điện tích hạt nhân của nguyên tử chlorine có 17 electron là
-
A.
15+
-
B.
16+
-
C.
17+
-
D.
18+
Số neutron trong nguyên tử \({}_3^7Li\) là
-
A.
3
-
B.
7
-
C.
11
-
D.
4
Cho các nguyên tử X, Y, Z, T có các đặc điểm như sau:
(1) nguyên tử X có 17 proton và số khối bằng 35
(2) nguyên tử Y có 17 neutron và số khối bằng 33
(3) nguyên tử Z có 17 neutron và 15 proton
(4) nguyên tử T có 20 neutron và số khối bằng 37
Những nguyên tử là đồng vị của cùng một nguyên tố hóa học là
-
A.
X và Y
-
B.
Y và T
-
C.
Z và Y
-
D.
X và T
Nguyên tử A có 12 electron, 12 neutron, kí hiệu nguyên tử của A là
-
A.
\({}_{25}^{12}A\).
-
B.
\({}_{12}^{25}A\).
-
C.
\({}_{24}^{12}A\).
-
D.
\({}_{12}^{24}A\).
Cho những nguyên tử của các nguyên tố sau:
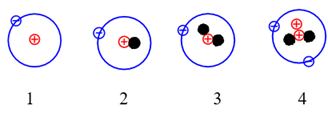
Những nguyên tử nào sau đây là đồng vị của nhau ?
-
A.
1 và 2
-
B.
2 và 3
-
C.
1, 2 và 3
-
D.
Cả 1, 2, 3, 4
Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của nguyên tử X là 3p1 . Số hiệu nguyên tử của nguyên tố X là
-
A.
13
-
B.
14
-
C.
12
-
D.
11
Nguyên tố X có 2 đồng vị bền X1 và X2. Đồng vị X1 có tổng số hạt là 18. Đồng vị X2 có tổng số hạt là 20. Biết rằng phần trăm số nguyên tử các đồng vị bằng nhau và các loại hạt trong X1 cũng bằng nhau. Nguyên tử khối trung bình của X là
-
A.
15
-
B.
14
-
C.
12
-
D.
13
Cho phổ khối của nguyên tố A được biểu diễn tại hình 1.33, Nguyên tử khối trung bình của A là
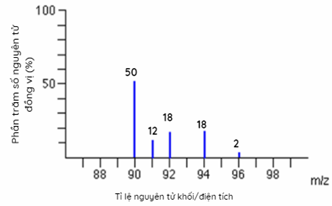
-
A.
91,32.
-
B.
91,40.
-
C.
90,00
-
D.
94,23
Phổ khối lượng của nguyên tố X được cho ở hình 1.34. Nguyên tử khối trung bình của nguyên tố này là bao nhiêu?
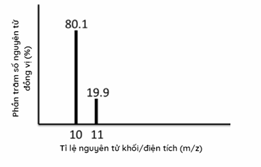
-
A.
10
-
B.
10,8
-
C.
10,2
-
D.
11
Trong tự nhiên, nguyên tử Chlorine có hai đồng vị bền là 35Cl và 37Cl. Tại sao nguyên tử khối tương đối của Chlorine thường được sử dụng là 35,5?
-
A.
Đây là giá trị trung bình cộng số khối của hai đồng vị.
-
B.
Lấy giá trị ngẫu nhiên.
-
C.
Nó là khối lượng trung bình của các đồng vị.
-
D.
Đây là giá trị nguyên tử khối trung bình của hai đồng vị.
Nguyên tố X có ba đồng vị bền, thông tin về phần trăm số lượng nguyên tử tương ứng của từng đồng vị được cho trong bảng sau:
|
Số khối của đồng vị |
Phần trăm số lượng nguyên tử |
|
24 |
79,0 |
|
25 |
10,0 |
|
26 |
11,0 |
Phần trăm số lượng nguyên tử các đồng vị bền của X
Nguyên tử khối trung bình của nguyên tố X là
-
A.
24,00.
-
B.
24,15.
-
C.
24,32.
-
D.
24,50
Tai nạn hạt nhân tại Nhật Bản đã sinh ra một lượng rất nhỏ 131I, sự có mặt của 131I trong không khí có thể gây ung thư tuyến giáp khi con người tiếp xúc với nó; vậy nhưng khác với 131I, 127I lại là nguyên tố vi lượng cần thiết cho cơ thể con người với vai trò ngăn chặn sự hấp thụ phóng xạ 131I của tuyến giáp. Ngoài ra người sử dụng đủ hàm lượng 127I có tác dụng ngăn ngừa bệnh bướu cổ. Khẳng định nào sau đây là sai ?
-
A.
131I và 127 I là đồng vị của nhau.
-
B.
131I và 127 I có cùng số proton.
-
C.
131I và 127 I là hai nguyên tố hóa học khác nhau.
-
D.
Dùng muối I ốt hàng ngày không có tác dụng ngăn ngừa bức xạ i-ốt.
Trong tự nhiên, nguyên tố Copper có hai đồng vị là 63Cu và 65Cu. Nguyên tử khối trung bình của Copper là 63,54. Thành phần % số nguyên tử của đồng vị 65Cu là
-
A.
27%.
-
B.
50%.
-
C.
54%.
-
D.
73%.
Argon được sử dụng trong các loại đèn điện vì nó không phản ứng với dây tóc bóng đèn ngay cả trong nhiệt độ cao, tạo môi trường luyện kim cho các nguyên tố có hoạt tính cao, là lớp khí bảo vệ để nuôi cấy các tinh thể silicon và gecmani trong công nghiệp sản xuất chất bán dẫn và là chất khí dùng trong các đèn plasma.Nguyên tố Argon có 3 loại đồng vị có số khối bằng 36; 38 và A. Phần trăm số nguyên tử tương ứng của 3 đồng vị lần lượt bằng 0,34%; 0,06% và 99,6%. Biết 125 nguyên tử Ar có khối lượng 4997,5 đvc. Số khối A của đồng vị thứ 3 là:
-
A.
40
-
B.
41
-
C.
39
-
D.
37
Một nguyên tố có 2 đồng vị mà số khối là 2 số nguyên liên tiếp và có tổng bằng 29. Biết rằng đồng vị nhẹ nhất có số proton bằng số số nơtron. Số nơtron của hai đồng vị lần lượt là:
-
A.
14, 15
-
B.
7, 8
-
C.
15, 8
-
D.
15,16
Lời giải và đáp án
Nguyên tố hóa học là những nguyên tử có cùng
-
A.
số khối
-
B.
số neutron
-
C.
số proton
-
D.
số neutron và số proton
Đáp án : C
Nguyên tố hóa học là tập hợp các nguyên tử có cùng số đơn vị điện tích hạt nhân
- Nguyên tố hóa học là tập hợp các nguyên tử có cùng số đơn vị điện tích hạt nhân
- Số đơn vị điện tích hạt nhân = số proton
=> Nguyên tố hóa học là những nguyên tử có cùng số proton
Kí hiệu nguyên tử biểu thị đầy đủ đặc trưng cho một nguyên tử của một nguyên tố hóa học vì nó cho biết
-
A.
số khối A
-
B.
số hiệu nguyên tử Z
-
C.
nguyên tử khối của nguyên tử
-
D.
số khối A và số hiệu nguyên tử Z
Đáp án : D
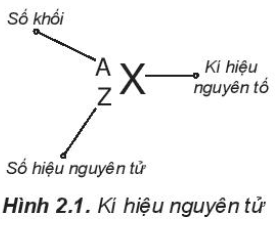
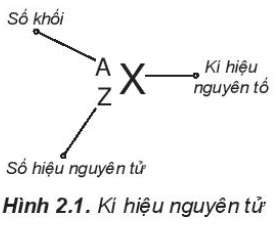
Dựa vào Hình 2.1, có thể thấy số đơn vị điện tích hạt nhân (Z) và số khối (A) được coi là những đặc trung cơ bản của nguyên tử
Nguyên tố carbon có hai đồng vị bền: \({}_6^{12}C\) chiếm 98,89% và \({}_6^{13}C\) chiếm 1,11%. Nguyên tử khối trung bình của nguyên tố carbon là
-
A.
12,500
-
B.
12,011
-
C.
12,022
-
D.
12,055
Đáp án : B
Nguyên tử khối trung bình:\(M = \frac{{aA + bB + cC + {\text{dD}} + ...}}{{100}}\)
Trong đó: A, B, C, D… là số khối của các đồng vị
a, b, c, d… là phần trăm của các đồng vị tương ứng
Ta có: \({}^{12}C\)chiếm 98,89%; \(^{13}C\)chiếm 1,11%
=> \({M_C} = \frac{{98,89.12 + 1,11.13}}{{100}} = 12,011\)
Vậy nguyên tử khối trung bình của C là 12,011
Trong dãy kí hiệu các nguyên tử sau:
\({}_7^{14}A\), \({}_9^{19}B\), \({}_{26}^{56}E\), \({}_{27}^{56}F\), \({}_8^{17}G\), \({}_{10}^{20}H\), \({}_{11}^{23}I\), \({}_{10}^{22}K\)
Các kí hiệu nào chỉ cùng 1 nguyên tố hóa học?
-
A.
A, G và B
-
B.
H và K
-
C.
H, I và K
-
D.
E và F
Đáp án : B
Nguyên tố hóa học là tập hợp các nguyên tử có cùng số đơn vị điện tích hạt nhân
H và K cùng 1 nguyên tố hóa học do có cùng số hiệu nguyên tử (số đơn vị điện tích hạt nhân) là 10
Cho ba nguyên tử có kí hiệu là \({}_{12}^{24}Mg\), \({}_{12}^{25}Mg\), \({}_{12}^{26}Mg\). Phát biểu nào sau đây sai?
-
A.
Số hạt electron của các nguyên tử lần lượt là: 12, 13, 14
-
B.
Đây là 3 đồng vị
-
C.
Ba nguyên tử trên đều thuộc nguyên tố Mg
-
D.
Hạt nhân của mỗi nguyên tử đều có 12 proton
Đáp án : A
- Kí hiệu của nguyên tử có dạng với Z là số hiệu nguyên tử, A là số khối
- Nhận thấy 3 nguyên tử đều có cùng số Z, khác số khối → 3 nguyên tử là đồng vị của nguyên tố Mg → B, C đúng
Luôn có Z = số p = số e = 12
Điện tích hạt nhân của nguyên tử chlorine có 17 electron là
-
A.
15+
-
B.
16+
-
C.
17+
-
D.
18+
Đáp án : C
Điện tích hạt nhân nguyên tử = số electron = số proton
Nếu hạt nhân có Z proton, thì điện tích của hạt nhân sẽ bằng Z+
Chlorine có 17 electron
=> Có 17 proton
=> Điện tích hạt nhân = 17+
Số neutron trong nguyên tử \({}_3^7Li\) là
-
A.
3
-
B.
7
-
C.
11
-
D.
4
Đáp án : D
- Số khối A = Z + N
=> 7 = 3 + N
=> N = 4
Vậy số neutron của nguyên tử \({}_3^7Li\) là 4
Cho các nguyên tử X, Y, Z, T có các đặc điểm như sau:
(1) nguyên tử X có 17 proton và số khối bằng 35
(2) nguyên tử Y có 17 neutron và số khối bằng 33
(3) nguyên tử Z có 17 neutron và 15 proton
(4) nguyên tử T có 20 neutron và số khối bằng 37
Những nguyên tử là đồng vị của cùng một nguyên tố hóa học là
-
A.
X và Y
-
B.
Y và T
-
C.
Z và Y
-
D.
X và T
Đáp án : D
Các nguyên tử có cùng số proton là đồng vị của cùng 1 nguyên tố hóa học
- Nguyên tử X có 17 proton, nguyên tử Y có 16 proton, nguyên tử Z có 15 proton, nguyên tử T có 17 proton
=> Nguyên tử X và T là đồng vị của cùng một nguyên tố hóa học (đều có 17 proton)
Nguyên tử A có 12 electron, 12 neutron, kí hiệu nguyên tử của A là
-
A.
\({}_{25}^{12}A\).
-
B.
\({}_{12}^{25}A\).
-
C.
\({}_{24}^{12}A\).
-
D.
\({}_{12}^{24}A\).
Đáp án : D
Dựa vào kí hiệu của nguyên tử
Vì nguyên tử A có 12e => E = P =12
Số khối A = 12 + 12 = 24
Vậy kí hiệu của A là: \({}_{12}^{24}A\)
Đáp án D
Cho những nguyên tử của các nguyên tố sau:

Những nguyên tử nào sau đây là đồng vị của nhau ?
-
A.
1 và 2
-
B.
2 và 3
-
C.
1, 2 và 3
-
D.
Cả 1, 2, 3, 4
Đáp án : C
Các nguyên tử nguyên tố có cùng số proton khác nhau về neutron được gọi là đồng vị của nhau
1, 2, 3 cùng có 1 proton
Đáp án C
Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của nguyên tử X là 3p1 . Số hiệu nguyên tử của nguyên tố X là
-
A.
13
-
B.
14
-
C.
12
-
D.
11
Đáp án : A
Dựa vào số proton của nguyên tử X
Nguyên tử X có 3 lớp electron => lớp 1 có 2 electron, lớp 2 có 8 electron, lớp 3 có 3 electron (vì lớp ngoài cùng nguyên tử X là 3p1) => có tổng: 2 + 8 + 3 = 13 electron
Đáp án A
Nguyên tố X có 2 đồng vị bền X1 và X2. Đồng vị X1 có tổng số hạt là 18. Đồng vị X2 có tổng số hạt là 20. Biết rằng phần trăm số nguyên tử các đồng vị bằng nhau và các loại hạt trong X1 cũng bằng nhau. Nguyên tử khối trung bình của X là
-
A.
15
-
B.
14
-
C.
12
-
D.
13
Đáp án : D
Tính số e, p, n của X
Tổng số hạt trong X1: p + n + e = 18
Vì các loại hạt trong X1 bằng nhau => p = e = n = 6
Vì X1 và X2 là đồng vị của nhau nên số proton của X2 = 6
Các hạt trong X2: p = e = 6 => n = 20 – 6 – 6 = 8
Nguyên tử khối X1 = 6 + 6 = 12; nguyên tử khối X2 = 8 + 6 = 14
Nguyên tử khối trung bình của X là: (12 + 14 ): 2 = 13
Đáp án D
Cho phổ khối của nguyên tố A được biểu diễn tại hình 1.33, Nguyên tử khối trung bình của A là

-
A.
91,32.
-
B.
91,40.
-
C.
90,00
-
D.
94,23
Đáp án : A
Dựa vào phần trăm số nguyên tử các đồng vị
Nguyên tử khối trung bình của A: (90.50 + 12.91 + 18.92 + 18.94 + 96.2) : 100 = 91,32
Đáp án A
Phổ khối lượng của nguyên tố X được cho ở hình 1.34. Nguyên tử khối trung bình của nguyên tố này là bao nhiêu?

-
A.
10
-
B.
10,8
-
C.
10,2
-
D.
11
Đáp án : C
Dựa vào phần trăm số nguyên tử đồng vị
Nguyên tử khối trung bình của X: (80,1.10 + 19,9.11):100 = 10,2
Đáp án C
Trong tự nhiên, nguyên tử Chlorine có hai đồng vị bền là 35Cl và 37Cl. Tại sao nguyên tử khối tương đối của Chlorine thường được sử dụng là 35,5?
-
A.
Đây là giá trị trung bình cộng số khối của hai đồng vị.
-
B.
Lấy giá trị ngẫu nhiên.
-
C.
Nó là khối lượng trung bình của các đồng vị.
-
D.
Đây là giá trị nguyên tử khối trung bình của hai đồng vị.
Đáp án : D
Dựa vào kiến thức về đồng vị
Vì giá trị 35,5 là nguyên tử khối trung bình của hai đồng vị
Đáp án D
Nguyên tố X có ba đồng vị bền, thông tin về phần trăm số lượng nguyên tử tương ứng của từng đồng vị được cho trong bảng sau:
|
Số khối của đồng vị |
Phần trăm số lượng nguyên tử |
|
24 |
79,0 |
|
25 |
10,0 |
|
26 |
11,0 |
Phần trăm số lượng nguyên tử các đồng vị bền của X
Nguyên tử khối trung bình của nguyên tố X là
-
A.
24,00.
-
B.
24,15.
-
C.
24,32.
-
D.
24,50
Đáp án : C
Dựa vào phần trăm số lượng nguyên tử
Nguyên tử khối trung bình của X là: (24.79 + 25.10 + 26.11) : 100 = 24,32
Đáp án C
Tai nạn hạt nhân tại Nhật Bản đã sinh ra một lượng rất nhỏ 131I, sự có mặt của 131I trong không khí có thể gây ung thư tuyến giáp khi con người tiếp xúc với nó; vậy nhưng khác với 131I, 127I lại là nguyên tố vi lượng cần thiết cho cơ thể con người với vai trò ngăn chặn sự hấp thụ phóng xạ 131I của tuyến giáp. Ngoài ra người sử dụng đủ hàm lượng 127I có tác dụng ngăn ngừa bệnh bướu cổ. Khẳng định nào sau đây là sai ?
-
A.
131I và 127 I là đồng vị của nhau.
-
B.
131I và 127 I có cùng số proton.
-
C.
131I và 127 I là hai nguyên tố hóa học khác nhau.
-
D.
Dùng muối I ốt hàng ngày không có tác dụng ngăn ngừa bức xạ i-ốt.
Đáp án : C
131I và 127 I là hai nguyên tố hóa học khác nhau.
Đáp án C
Trong tự nhiên, nguyên tố Copper có hai đồng vị là 63Cu và 65Cu. Nguyên tử khối trung bình của Copper là 63,54. Thành phần % số nguyên tử của đồng vị 65Cu là
-
A.
27%.
-
B.
50%.
-
C.
54%.
-
D.
73%.
Đáp án : A
Dựa vào nguyên tử khối trung bình của Cu
Gọi % đồng vị 63Cu và 65Cu lần lượt là a và b
Ta có: a + b = 100
\({\bar M_{Cu}} = \frac{{a.63 + b.65}}{{100}} = 63,54\) => a = 73%; b = 27%
Đáp án A
Argon được sử dụng trong các loại đèn điện vì nó không phản ứng với dây tóc bóng đèn ngay cả trong nhiệt độ cao, tạo môi trường luyện kim cho các nguyên tố có hoạt tính cao, là lớp khí bảo vệ để nuôi cấy các tinh thể silicon và gecmani trong công nghiệp sản xuất chất bán dẫn và là chất khí dùng trong các đèn plasma.Nguyên tố Argon có 3 loại đồng vị có số khối bằng 36; 38 và A. Phần trăm số nguyên tử tương ứng của 3 đồng vị lần lượt bằng 0,34%; 0,06% và 99,6%. Biết 125 nguyên tử Ar có khối lượng 4997,5 đvc. Số khối A của đồng vị thứ 3 là:
-
A.
40
-
B.
41
-
C.
39
-
D.
37
Đáp án : A
Dựa vào % các đồng vị của A để tính số khối
\(\frac{{36.0,34 + 38.0,06 + A.99,6}}{{100}} = \frac{{4997,5}}{{125}} \Rightarrow A = 40\)
Đáp án A
Một nguyên tố có 2 đồng vị mà số khối là 2 số nguyên liên tiếp và có tổng bằng 29. Biết rằng đồng vị nhẹ nhất có số proton bằng số số nơtron. Số nơtron của hai đồng vị lần lượt là:
-
A.
14, 15
-
B.
7, 8
-
C.
15, 8
-
D.
15,16
Đáp án : B
Dựa vào kiến thức đồng vị
A1 + (A1 + 1) = 29 => A1 = 14 => A2 = 15
N1 = Z = 7; N2 = 15 -7 = 8
Đáp án B
Luyện tập và củng cố kiến thức Bài 3. Cấu trúc lớp vỏ electron nguyên tử Hóa 10 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 1. Thành phần của nguyên tử Hóa 10 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
- Trắc nghiệm Bài 22. Hydrogen halide. Muối halide - Hóa 10 Kết nối tri thức
- Trắc nghiệm Bài 21. Nhóm halogen - Hóa 10 Kết nối tri thức
- Trắc nghiệm Bài 19. Tốc độ phản ứng - Hóa 10 Kết nối tri thức
- Trắc nghiệm Bài 17. Biến thiên enthalpy trong các phản ứng hóa học - Hóa 10 Kết nối tri thức
- Trắc nghiệm Bài 15. Phản ứng oxi hóa - khử - Hóa 10 Kết nối tri thức










Danh sách bình luận