 SBT Hóa 12 - giải SBT Hóa học 12 - Cánh diều
SBT Hóa 12 - giải SBT Hóa học 12 - Cánh diều
 Chủ đề 8. Sơ lược về kim loại chuyển tiếp dãy thứ nhất ..
Chủ đề 8. Sơ lược về kim loại chuyển tiếp dãy thứ nhất .. Bài 21. Sơ lược về phức chất trang 69, 70, 71 SBT Hóa 12 Cánh diều
Cho phát biểu sau: “Phức chất đơn giản thường có một
21.1
Cho phát biểu sau: “Phức chất đơn giản thường có một ...(1)... liên kết với các phối tử bao quanh. Liên kết giữa nguyên tử trung tâm và phối tử trong phức chất là liên kết ...(2)....”. Cụm từ cần điền vào (1) và (2) lần lượt là
A. cation kim loại, ion.
B. nguyên tử kim loại, cho - nhận.
C. nguyên tử trung tâm, cho - nhận.
D. phối tử, ion.
Phương pháp giải:
Dựa vào khái niệm của phức chất.
Lời giải chi tiết:
Phức chất đơn giản có một nguyên tử trung tâm (1) liên kết với các phối tử bao quanh. Liên kết giữa nguyên tử trung tâm và phối tử trong phức chất là liên kết cho – nhận (2).
Đáp án C
21.2
Theo thuyết Liên kết hoá trị, để trở thành phối tử trong phức chất thì phân tử hoặc anion cần có
A. các orbital trống.
B. cặp electron hoá trị riêng.
C. ít nhất 4 orbital trống.
D. ít nhất hai cặp electron hoá trị riêng.
Phương pháp giải:
Dựa vào các liên kết trong phức chất.
Lời giải chi tiết:
Liên kết trong phức chất là liên kết cho – nhận nên phân tử hoặc anion cần có cặp electron hóa trị riêng.
Đáp án B
21.3
Cho các chất có công thức: CuCl2 , NH3,[CuCl4]2-. Phát biểu nào sau đây là không đúng?
A. Do không có liên kết cộng hoá trị theo kiểu cho – nhận trong phân tử nên CuCl2, không phải là phức chất.
B. Do có nguyên tử trung tâm là nguyên tố kim loại, đồng thời các phối tử xung quanh liên kết với nguyên tử trung tâm bằng liên kết cho – nhận nên ,[ CuCl4]2-là phức chất.
C. Dù có các nguyên tử H xung quanh N, nhưng NH3 không phải là phức chất.
D. Do nguyên tố đồng có hoá trị II nên quanh nguyên tử Cu trong CuCl2 và trong [CuCl4]2-đều có 2 liên kết.
Phương pháp giải:
Dựa vào sự hình thành phức chất.
Lời giải chi tiết:
D sai vì trong [CuCl₄]²⁻, ion Cu²⁺ có 4 phối tử Cl⁻ xung quanh, nên có 4 liên kết.
Đáp án D
21.4
Phát biểu nào sau đây không đúng về phức chất?
A. Phức chất đơn giản thường có một nguyên tử trung tâm liên kết với các phối tử bao quanh.
B. Phức chất có thể mang điện tích hoặc không mang điện tích.
C. Liên kết giữa nguyên tử trung tâm và phối tử trong phức chất là liên kết ion.
D. K2[PtCl4] hoặc anion [PtCl4]- đều được xếp vào loại phức chất.
Phương pháp giải:
Dựa vào sự hình thành phức chất.
Lời giải chi tiết:
C sai, liên kết giữa nguyên tử trung tâm và phối tử trong phức chất là liên kết cho – nhận.
Đáp án C
21.5
Những phát biểu nào sau đây là không đúng về nguyên tử trung tâm trong phức chất?
(a) Nguyên tử trung tâm trong phức chất là cation kim loại hoặc nguyên tử kim loại đã nhận cặp electron hoá trị riêng của phân tử hoặc anion.
(b) Cation tạo nguyên tử trung tâm trong phức chất [Co(OH2)6]3+ là Co3+.
(c) Nguyên tử trung tâm trong phức chất là các nguyên tố kim loại chuyển tiếp.
(d) Nguyên tử trung tâm trong phức chất [Ni(CO)4] được hình thành từ quá trình cation Ni2+ sử dụng các orbital trống để nhận các cặp electron hoá trị của các phân tử CO.
Phương pháp giải:
Dựa vào liên kết trong phức chất.
Lời giải chi tiết:
(c) sai vì nguyên tử trung tâm trong phức chất có thể không phải nguyên tố kim loại chuyển tiếp ví dụ: [SiF6]2-
(d) sai, Phức chất [Ni(CO)4] hình thành từ quá trình nguyên tử Ni nhận các cặp electron hoá trị riêng của 4 phân tử CO.
21.6
Theo thuyết Liên kết hoá trị, những phát biểu nào sau đây là không đúng?
(a) Phối tử là các phân tử hoặc anion đã cho một hoặc một số cặp electron hoá trị riêng.
(b) Các phần tử gồm NH3, N2, H2, OH- ,C1- đều có thể trở thành phối tử trong phức chất.
(c) Có phối tử là anion và phối tử là phân tử trong phức chất[Cu(NH3)4(OH2)2]2+.
(d) Khi tham gia quá trình tạo phức chất, phân tử ethylenediamine H2N-CH2-CH2-NH2, sử dụng hai cặp electron hoá trị riêng để tạo 2 liên kết cho - nhận.
Phương pháp giải:
Dựa vào liên kết trong phức chất.
Lời giải chi tiết:
(b) sai, H2 không trở thành phổi tử trong phức chất vì không còn cặp electron hóa trị riêng.
(c) sai, không có phối tử là anion, đều là phối tử trung hòa.
(d) sai, Không phải trong mọi trường hợp ethylenediamine đều sử dụng cả hai cặp electron để hình thành liên kết cho – nhận với nguyên tử trung tâm.
21.7
Những phát biểu nào sau đây về dạng hình học của phức chất là đúng?
(a) Phức chất mà xung quanh nguyên tử trung tâm có 4 liên kết σ thường có dạng hình học là tứ diện hoặc vuông phẳng và được gọi là phức chất tứ diện hoặc phức chất vuông phẳng.
(b) Phức chất mà xung quanh nguyên tử trung tâm có 6 liên kết σ có dạng hình học là bát diện và được gọi là phức chất bát diện.
(c) Hai liên kết Pt-C1 kế cận nhau trong anion [PtCl4]2- tạo thành một góc liên kết. Thực nghiệm xác nhận trong anion [PtCl4]- có bốn góc liên kết đều có giá trị xấp xỉ 90°. Vì vậy, [PtCl4]2- là phức chất vuông phẳng
(d) Dạng hình học của phức chất được xác nhận bằng thực nghiệm.
Phương pháp giải:
Dựa vào hình dạng của phức chất.
Lời giải chi tiết:
(a) đúng
(b) sai vì Phức chất mà xung quanh nguyên tử trung tâm có số phối trí là 6 có dạng hình học là bát diện và được gọi là phức chất bát diện.
(c) đúng
(d) đúng
21.8
Những phát biểu nào sau đây về phức chất bát diện [Cu(OH2)6]2+ là đúng?
(a) Nguyên tử trung tâm được hình thành từ quá trình cation Cu2+ sử dụng 6 orbital trống để nhận các cặp electron hoá trị riêng của các phân tử H2O.
(b) Số oxi hoá của nguyên tử trung tâm là +2.
(c) Số liên kết cho – nhận giữa phối tử và nguyên tử trung tâm cũng là hoá trị phổ biến của đồng.
(d) Mỗi phân tử nước chỉ sử dụng 1 trong 2 cặp electron hoá trị riêng của nó để tạo liên kết cho — nhận với cation Cu2+
Phương pháp giải:
Dựa vào liên kết trong phức chất.
Lời giải chi tiết:
(a), (b), (d) đúng
(c) sai, với nguyên tử trung tâm trong phức chất: hóa trị và số phối trí thường không đồng nhất.
21.9
Những phát biểu nào sau đây về phức chất Na3[Co(NO2)6] là đúng?
(a) Có liên kết cho − nhận và liên kết ion trong phân tử.
(b) Có anion [Co(NO2)6]3- cũng là một phức chất.
(c) Có nguyên tử trung tâm là natri (sodium) và cobalt.
(d) Nguyên tử trung tâm có số oxi hoá là +2.
Phương pháp giải:
Dựa vào cấu tạo của phức chất.
Lời giải chi tiết:
(a), (b) đúng
(c) sai, nguyên tử trung tâm là Co3+
(d) sai, nguyên tử trung tâm có số oxi hóa là +3.
21.10
Cho hai phức chất A và B có công thức lần lượt sau:
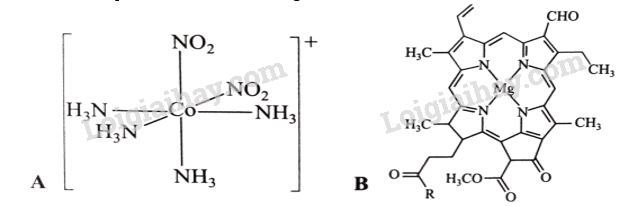
Mỗi phát biểu sau đây đúng hay sai?
(a) Nguyên tử trung tâm của hai phức chất đều là nguyên tố kim loại chuyển tiếp.
(b) Trong phức chất B có 4 phối tử.
(c) Hai phức chất A và B có dạng hình học khác nhau.
(d) Trong A và trong B đều có hai loại phối tử.
Phương pháp giải:
Dựa vào hình dạng của phức chất.
Lời giải chi tiết:
(a) Sai. Nguyên tử trung tâm không chỉ là nguyên tố kim loại chuyển tiếp.
(b) Sai, trong phứ chất B chỉ có 1 phối tử.
(c) Đúng. Do số liên kết ở giữa nguyên tử trung tâm và phối tử ở hai phức chất khác nhau.
(d) Sai. Ở B chỉ có một loại phối tử.
21.11
Nối những đặc điểm ở cột B với phức chất tương ứng ở cột A.
Biết rằng khi ion Cr3+ hoặc nguyên tử Cr tạo phức chất thì trở thành nguyên tử trung tâm chromium có 6 liên kết cho – nhận với các phối tử xung quanh.
|
Cột A 1. [Cr(en)3]3+ 2. [Cr(NH3)6]6+ 3. [Cr(CO)6]
|
Cột B a) Một phối tử chỉ tạo một liên kết cho - nhận với nguyên tử trung tâm b) Một phối tử tạo hai liên kết cho - nhận với nguyên tử trung tâm c) Là phức chất trung hoà d) Là phức chất ion e) Nguyên tử trung tâm được hình thành từ quá trình cation kim loại nhận các cặp electron hoá trị g) Nguyên tử trung tâm được hình thành từ quá trình nguyên tử kim loại nhận các cặp electron hoá trị |
Phương pháp giải:
Dựa vào liên kết trong phức chất.
Lời giải chi tiết:
1-b, d, e; 2-a, d; 3-a, c, g.
21.12
Mỗi phân tử ethylenediamine (H2N–CH2-CH2-NH2):
a) có bao nhiêu cặp electron hoá trị riêng có thể được dùng để tạo phức chất với cation kim loại?
b) có luôn dùng tất cả các cặp electron hoá trị riêng để tạo liên kết với cation kim loại không?
Phương pháp giải:
Dựa vào liên kết trong phức chất.
Lời giải chi tiết:
a) có 2 cặp electron hóa trị riêng có thể dùng để tạo phức chất với cation kim loại.
b) Không. Có phức chất mà trong đó ethylenediamine chỉ sử dụng một cặp electron hoá trị riêng để tạo một liên kết cho - nhận, số cặp electron hoá trị riêng của các phân tử hoặc anion thường chỉ cho biết liên kết cho - nhận mà phân tử hoặc anion đó có khả năng tạo thành, còn số liên kết trong thực tế phải được xác định từ thực nghiệm. 0
21.13
Xét phân tử H2O, phân tử hydrazine H2N–CH2-NH2 và anion F- . Cho biết:
a) Mỗi phân tử hoặc anion trên có bao nhiêu cặp electron hoá trị riêng?
b) Vì sao 1 phân tử H2O hoặc 1 phân tử H2N–CH2-NH2, hay 1 anion F- chỉ sử dụng được một cặp electron hoá trị riêng để tạo liên kết với cation kim loại trong quá trình hình thành phức chất?
c) Khi tạo phức chất, cation Co3+ nhận được 6 cặp electron hoá trị riêng từ các phối tử. Hãy cho biết giá trị x và n trong công thức [CoFx]n- là bao nhiêu. Giải thích.
Phương pháp giải:
Dựa vào liên kết của phức chất
Lời giải chi tiết:
a) Vẽ công thức electron của mỗi phân tử và anion, từ đó xác định được số cặp electron hoá trị riêng của chúng. Cụ thể là:
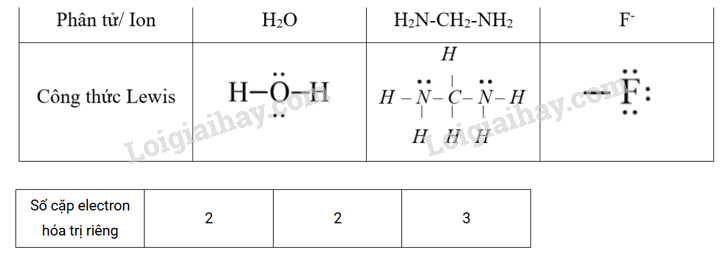
b) Trong một phân tử hoặc một anion, các cặp electron hoá trị càng gần nhau có xu hướng đẩy nhau. Vì vậy, thường chỉ 1 cặp electron hoá trị riêng trong chúng tạo được 1 liên kết bền với cation kim loại tham gia tạo phức chất.
c) [CoF6]3-. Mỗi anion F- chỉ sử dụng 1 cặp electron hoá trị riêng để tạo liên kết cho – nhận với Co3+, nên cần 6 F-.
21.14
Các phức chất được tạo thành từ sự tương tác giữa cation Co3+ với đồng thời cả anion C2O42- (kí hiệu là ox) và phân tử H2O, có dạng [Co(OH2)x(ox)y ]p+ và [Co(OH2)a(ox)b]q-
Biết rằng trong các phức chất này:
_ Cation Co3+ tạo được 6 liên kết sigma kiểu cho – nhận với các phối tử.
– Mỗi anion C2O42- sử dụng 2 cặp electron hoá trị riêng để tạo liên kết cho — nhận với cation kim loại.
– Mỗi phân tử H2O sử dụng 1 cặp electron hoá trị riêng để tạo liên kết cho — nhận với cation kim loại.
Hãy đề xuất công thức của các phức chất phù hợp với những dữ liệu trên.
Phương pháp giải:
Dựa vào liên kết trong phức chất.
Lời giải chi tiết:
[Co(OH2)4(ox) ]+ và [Co(OH2)2(ox)2]-
21.15
Khi hoà tan hỗn hợp gồm muối cobalt(III) chloride và sodium chloride vào
nước thì một số quá trình cơ bản sau sẽ diễn ra:
NaCl → Na+ + ? (1)
CoCl3 → Co3+ + 3C1- (2)
Co3+ + ? → [Co(OH2)6]3+ (3)
Na+ + ? → Na+(H2O)x (4)
C1- + ? → Cl-(H2O)y (5)
a) Điền thông tin phù hợp vào các dấu ? ở các quá trình trên.
b) Với các quá trình trên, chỉ ra quá trình hydrate hoá, quá trình tạo phức chất và quá trình phân li.
c) Nêu các đặc điểm về liên kết hoặc tương tác trong mỗi sản phẩm ghi ở (3), (4) và (5).
d) Theo em, vì sao ở (4) và (5) không hình thành phức chất?
Phương pháp giải:
Dựa vào kiến thức về phức chất
Lời giải chi tiết:
a) NaCl → Na+ + Cl- (1)
CoCl3 → Co3+ + 3C1- (2)
Co3+ + 3H2O → [Co(OH2)6]3+ (3)
Na+ + x H2O → Na+(H2O)x (4)
C1- + yH2O → Cl-(H2O)y (5)
b) (1) và (2) là quá trình phân li, (3) là quá trình tạo phức chất, (4) và (5) là quá trình hydrate hoá.
c) Các liên kết trong sản phẩm phức chất ở (3) là liên kết cho – nhận giữa các phân tử H2O và Co3+.
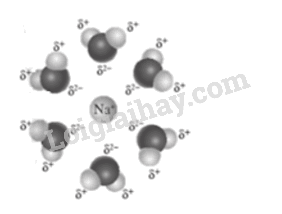
Tương tác trong sản phẩm ở (4) và (5) là tương tác tĩnh điện giữa:
điện tích dương của Na với điện tích âm của O trong phân tử H2O bị phân cực.
điện tích âm của Cl với điện tích dương của H trong phân tử H2O bị phân cực.
Có thể minh hoạ mô hình tương tác tĩnh điện giữa Na+ và H2O như sau:
d) Trong trường hợp này, năng lượng của loại tương tác tĩnh điện ở (4) và (5) yếu hơn năng lượng của liên kết cho — nhận để có thể hình thành phức chất.
21.16
a) Vì sao AgCl không phải là phức chất trong khi cation [H3N–Ag–NH3]+ là phức chất?
b) Vì sao sodium chloride (NaCl) không phải là một phức chất?
Phương pháp giải:
Dựa vào kiến thức về phức chất.
Lời giải chi tiết:
(a) Trong phức chất thì liên kết giữa nguyên tử trung tâm và phối tử là liên kết cho nhận AgCl không có liên kết cho – nhận nên không phải phức chất còn cation [H3N–Ag–NH3]+ có liên kết cho – nhận nên là phức chất.
(b) Trong phức chất thì liên kết giữa nguyên tử trung tâm và phối tử là liên kết cho nhận NaCl không có liên kết cho – nhận nên không phải phức chất
Các bài khác cùng chuyên mục
- Bài 22. Sơ lược về sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch trang 74, 75, 76 SBT Hóa 12 Cánh diều
- Bài 21. Sơ lược về phức chất trang 69, 70, 71 SBT Hóa 12 Cánh diều
- Bài 20. Sơ lược về kim loại chuyển tiếp dãy thứ nhất trang 65, 66 SBT Hóa 12 Cánh diều
- Bài 19. Nước cứng và làm mềm nước cứng trang 63,64 SBT Hóa 12 Cánh diều
- Bài 18. Nguyên tố nhóm IIA trang 58, 59, 60 SBT Hóa 12 Cánh diều
- Bài 22. Sơ lược về sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch trang 74, 75, 76 SBT Hóa 12 Cánh diều
- Bài 21. Sơ lược về phức chất trang 69, 70, 71 SBT Hóa 12 Cánh diều
- Bài 20. Sơ lược về kim loại chuyển tiếp dãy thứ nhất trang 65, 66 SBT Hóa 12 Cánh diều
- Bài 19. Nước cứng và làm mềm nước cứng trang 63,64 SBT Hóa 12 Cánh diều
- Bài 18. Nguyên tố nhóm IIA trang 58, 59, 60 SBT Hóa 12 Cánh diều












Danh sách bình luận