Bài 17. Nguyên tố nhóm IA trang 54, 55, 56 SBT Hóa 12 Cánh diều
Trong tự nhiên, các nguyên tố nhóm IA chỉ tồn tại ở dạng hợp chất là do
17.1
Trong tự nhiên, các nguyên tố nhóm IA chỉ tồn tại ở dạng hợp chất là do
A. các nguyên tố nhóm IA chỉ có thể tìm được trong nước ngầm, nước biển.
B. các nguyên tố nhóm IA đều là những kim loại hoạt động hóa học mạnh nên không tồn tại dạng đơn chất.
C. các nguyên tố nhóm IA thường kết hợp với nhau dể tạo thành các hợp kim bền.
D. các nguyên tố nhóm IA có độ âm điện lớn nên dễ dàng kết hợp với các nguyên tố khác.
Phương pháp giải:
Dựa vào trạng thái tự nhiên của nguyên tố nhóm IA.
Lời giải chi tiết:
Các nguyên tố nhóm IA đều là những kim loại hoạt động hóa học mạnh nên không tồn tại dạng đơn chất mà chỉ tồn tại dạng hợp chất trong tự nhiên.
Đáp án B
17.2
Những phát biểu nào sai đây là đúng về các nguyên tố nhóm IA.
(a) Có cấu hình electron lớp ngoài cùng là ns1 (n > 1).
(b) Có số oxi hóa là +1 hoặc +2 trong các hợp chất.
(c) Có tính khử mạnh.
(d) Có bán kính nguyên tử nhỏ.
(e) Còn được gọi là kim loại kiềm.
Phương pháp giải:
Dựa vào cấu tạo của nguyên tố nhóm IA.
Lời giải chi tiết:
a, c, e đúng
b sai vì nguyên tố nhóm IA chỉ có 1 số oxi hóa là +1.
d sai vì bán kính nguyên tử nhóm IA lớn nhất trong bảng tuần hoàn.
17.3
Những đặc điểm chung nào của các kim loại kiềm (M) sau đây có thể giúp dự đoán chúng đều có tính khử mạnh?
(a) Kim loại M trong cặp oxi hóa – khử M+/M có thế điện cực chuẩn (\(E_{{M^{n + }}/M}^o\)) rất âm.
(b) Mềm và dễ nóng chảy.
(c) Có nhiều electron hóa trị nên dễ dàng nhường electron.
(d) Lực hút của hạt nhân đối với elctron hóa trị trong kim loại kiềm yếu hơn so với lực hút tương ứng ở các kim loại nhóm khác.
(e) Có cấu trúc tinh thể rỗng.
Phương pháp giải:
Dựa vào cấu tạo của nguyên tố nhóm IA.
Lời giải chi tiết:
a, d đúng
b sai vì mềm và dễ nóng chảy là tính chất vật lí của nhóm IA.
c sai vì nguyên tố nhóm IA chỉ có 1 electron hóa trị.
e sai vì cấu trúc tinh thể rỗng không giúp dự đoán chúng có tính khử mạnh.
17.4
Những lĩnh vực nào sau đây ứng dụng nhiều kim loại nhóm IA và các hợp chất của chúng?
(a) xây dựng, công nghiệp ô tô, luyện kim. (b) sản xuất pháo hoa.
(c) sản xuất phân bón. (d) chế biến thực phẩm.
(e) pin, đồng hồ nguyên tử.
Phương pháp giải:
Dựa vào ứng dụng của kim loại nhóm IA.
Lời giải chi tiết:
Các lĩnh vực: (a); (b); (c); (d); (e).
17.5
Giá trị biến thiên tạo thành chuẩn (kJ mol-1) của NaHCO3(s), Na2CO3(s), CO2(g) và H2O(g) lần lượt là -950,81; -1130,70; -393,51 và -241,8.
a) Tính giá trị biến thiên enthalpy chuẩn của phản ứng sau:
2NaHCO3(s)\( \to \) Na2CO3(s) + H2O(g) + CO2(g)
b) Phản ứng trên có thuận lợi về mặt năng lượng không?
c) Theo em, vì sao baking soda không bị phân hủy theo phản ứng ở ý a) khi được bảo quản ở nơi thoáng mát.
Phương pháp giải:
Dựa vào tính chất hóa học của nguyên tố nhóm IA.
Lời giải chi tiết:
a) Giá trị biến thiên enthalpy: \(\begin{array}{l}{\Delta _r}H_{298}^0 = {\Delta _f}H_{298}^o(N{a_2}C{O_3}) + {\Delta _f}H_{298}^o({H_2}{\rm{O}}) + {\Delta _f}H_{298}^o(C{O_2}) - 2.{\Delta _f}H_{298}^o(NaHC{O_3})\\ = ( - 1130,7) + ( - 393,51) + ( - 241,8) - 2.( - 950,81) = 135,61kJ\end{array}\)
b) Phản ứng trên không thuận lợi về mặt năng lượng vì \({\Delta _r}H_{298}^0 = 155,61(kJ)\) > 0 phản ứng thu nhiệt.
c) Do phản ứng trên là phản ứng thu nhiệt nên để phản ứng xảy ra cần phải cung cấp năng lượng.
17.6
Các kim loại kiềm có khối lượng riêng nhỏ và độ cứng thấp hơn nhiều so với các kim loại khác. Nguyên nhân là do:
(1) Tinh thể có kiểm mạng lập phương tâm khối.
(2) Khối lượng nguyên tử nhỏ hơn các kim loại khác.
(3) Có lực liên kết kim loại yếu.
A. (1), (2) và (3). B. (2) và (3).
C. (1) và (3). D. (1) và (3).
Phương pháp giải:
Dựa vào tính chất vật lí của kim loại nhóm IA.
Lời giải chi tiết:
(1), (3) là nguyên nhân gây nên khối lượng riêng nhỏ và độ cứng thấp hơn nhiều so với các kim loại khác.
Đáp án C
17.7
Dãy nào sau đây sấp xếp đúng các kim loại theo chiều tăng dần nhiệt độ nóng chảy?
A. Hg, Cs, K, Na, Fe, W. B. Hg, Na, K, Cs, W, Fe.
C. Cs, K, Na, Hg, Fe, W. D. Hg, Cs, Na, K, Fe, W.
Phương pháp giải:
Dựa vào tính chất vật lí của kim loại.
Lời giải chi tiết:
Đáp án A
17.8
Cho một mẫu sodium nhỏ vào cốc nước có chứa vài giọt phenolphthalein.
Mỗi phát biểu sau đây là đúng hay sai?
(a) Sodium bị hòa tan nhanh chóng là do hiện tượng ăn mòn điện hóa.
(b) Cốc nước chuyển từ không màu sang màu hồng.
(c) Khí thoát ra trong thí nghiệm là một khí dễ cháy.
(d) Nếu thay mẫu sodium bằng mẫu lithium cùng kích thước thì phản ứng diễn ra chậm hơn.
(e) Có cấu trúc tinh thể rỗng.
Phương pháp giải:
Dựa vào tính chất hóa học của nguyên tố nhóm IA.
Lời giải chi tiết:
(a) Sai, hòa tan do phản ứng ăn mòn hóa học và không sinh ra dòng điện.
(b) Đúng, dung dịch tạo thành có môi trường kiềm.
(c) Đúng, khí H2.
(d) Đúng.
(e) Đúng.
17.9
Dùng panh lấy các mẫu kim loại (Li, Na hoặc K) có kích cỡ xấp xỉ nhau đã thấm khô dầu và cho vào các chậu thủy tinh đã chứa khoảng 1/3 thể tích nước. Thêm 2 – 3 giọt dung dịch phenolphthalein vào chậu sau khi kim loại tan hết.
Mỗi phát biểu sau đây là đúng hay sai?
(a) Các dung dịch thu được sau phản ứng đề có màu hồng.
(b) Trong nước, potassium tan nhanh hơn so với sodium, sodium tan nhanh hơn so với lithium.
(c) Các cặp oxi hóa – khử M+/M (M: Li, Na, K) đều có giá trị thế điện cực chuẩn lớn hơn giá trị thế điện cực chuẩn của cặp oxi hóa – khử 2H2O/H2 + 2OH–.
(d) Kết quả thí nghiệm cho kết luận tính khử của các kim loại tăng dần theo dãy K, Na, Li.
Phương pháp
Phương pháp giải:
Dựa vào tính khử của kim loại IA.
Lời giải chi tiết:
(a) Đúng.
(b) Đúng.
(c) Sai, giá trị thế điện cực của cặp oxi hóa – khử M+/M nhỏ hơn.
(d) Sai, giảm dần.
17.10
Trong các phản ứng sau đây, phản ứng nào diễn ra mãnh liệt nhất?
A. Lithium và bromine. B. Potassium và chlorine
C. Lithium và chlorine. D. Sodium và bromine.
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại IA.
Lời giải chi tiết:
Potassium là kim loại IA mạnh nhất nên phản ứng giữa potassium và chlorine diễn ra mãnh liệt nhất.
Đáp án B
17.11
Nhúng queo platinum sạch vào dung dịch chất X, sau đó đưa lên ngọn lửa đèn khí, đèn khí cháy với ngọn lửa màu vàng. Mặt khác, thêm vài giọt dung dịch chất X vào dung dịch silver nitrate thất xuất hiện kết tủa vàng. X có thể là chất nào sau đây?
(1) Potassium iodide. (2) Sodium iodide.
(3) Sodium phosphate. (4) Potassium phosphate.
A. (1) hoặc (4). B. (2) hoặc (3).
C. (2). D. (3) hoặc (4).
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại IA.
Lời giải chi tiết:
Khi đốt cháy dung dịch chất X thu được ngọn lửa màu vàng nên kim loại trong X là sodium.
Vì dung dịch tạo kết tủa vàng với Ag+ nên X có thể là NaI hoặc Na3PO4.
Đáp án B
17.12
Viết phương trình hóa học của phản ứng xảy ra khi thực hiện phản ứng giữa sodium lần lượt với lượng dư chlorine, oxygen và lưu huỳnh. Giả sử sodium bị oxi hóa hết trong mỗi phản ứng.
Cho một lượng nước thích hợp vào mỗi sản phẩm thu được ở trên để thu được các dung dịch có nồng độ khoảng 0,1 M. Dự đoán pH của mỗi dung dịch thu được và giải thích.
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại IA.
Lời giải chi tiết:
Phương trình phản ứng:
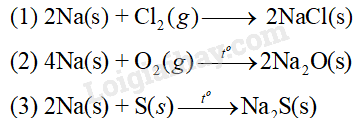
Dự đoán pH dung dich:
+ Phản ứng (1): pH = 7 do NaCl tạo môi trường trung tính.
+ Phản ứng (2): pH >7 do Na2O tác dụng H2O tạo NaOH có môi trường kiềm.
+ Phản ứng (3): pH >7 do Na2S hoàn tan vào H2O, Na2S thủy phân tạo môi trường kiềm.
17.13
Công đoạn chính của công nghiệp chlorine – kiềm là điện phân dung dịch sodium chlorine bão hòa trong bể điện phân có màng ngăn xốp. Phương trình hóa học của quá trình điện là: 2NaCl + 2H2O \( \to \) 2NaOH + H2 + Cl2.
Mỗi phát biểu sau đây là đúng hay sai?
(a) Anion Cl – bị khử thành khí chlorine tại anode.
(b) Tại cathode, thu được đồng thời dung dịch bão hòa và tinh thể sodium hydroxide.
(c) Nếu không có màng ngăn xốp, nước Javel được hình thành trong bể điện phân.
(d) Hydrogen cũng là một sản phẩm có giá trị của công nghiệp chlorine – kiềm.
Phương pháp giải:
Dựa vào nguyên tắc điện phân dung dịch.
Lời giải chi tiết:
(a) Sai, Cl- bị oxi hóa.
(b) Sai, thu được dung dịch NaOH và tinh thể NaCl trước.
(c) Đúng.
(d) Đúng.
17.14
Trong thực tế, trong quá trình điện phân dung dịch sodium chloride bão hòa, sau một thời gian, dung dịch NaCl tại anode được gọi là “nước muối nghèo” và được đưa ra khỏi bể điện phân; đồng thời dung dịch NaCl bão hòa mới được bổ sung vào để tiếp tục quá trình điện phần (như Hình 17.1). Hãy giải thích việc làm này, viết phương trình hóa học (nếu có). Biết rằng, dung dịch tại bể anode có pH = 3; \(E_{C{l_2}/2Cl - }^o\)= 1,36 V; \(E_{{O_2},4{H^ + }/2{H_2}O\;}^o\)= 1,23 V.
Nước muối bão hòa có nồng độ 300 g L–1 , trong khi đó “nước muối nghèo” có nồng độ 220 g L-1. Với mỗi lít nước muối bão hòa ban đầu thì thu được bao nhiêu gam sodium hydroxide, nếu hiệu suất của quá trình là 80%.
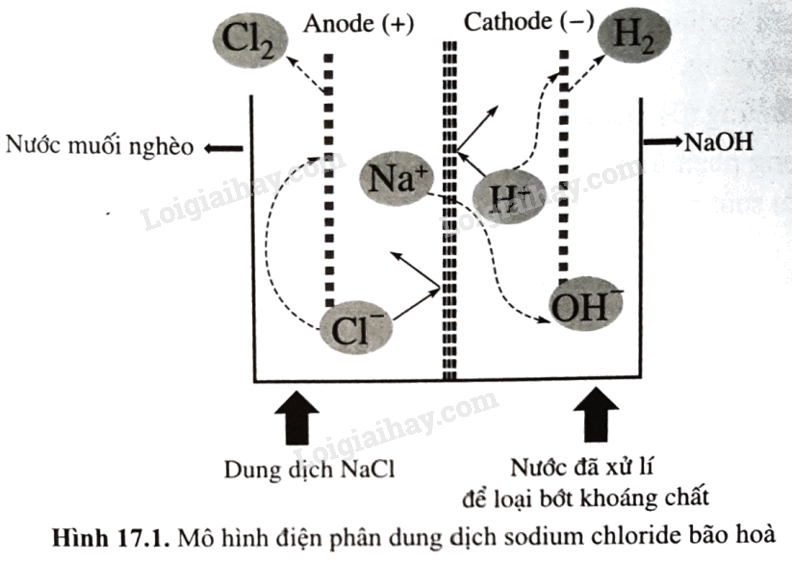
Phương pháp giải:
Dựa vào mô hình điện phân sodium chloride.
Lời giải chi tiết:
Do thế khử khuẩn của nước (trong môi trường acid) xấp xỉ thế khử chuẩn của chlorine, nên khi nồng độ chloride giảm (trong nước muối nghèo) xảy ra phản ứng oxi hóa nước tại anode:
Các quá trình diễn ra tại anode:
\(\begin{array}{l}2C{l^ - } \to C{l_2} + 2{\rm{e}}\\{\rm{2}}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {O_2} + 4{H^ + } + 4e\end{array}\)
Do đó, chlorine thu được sẽ bị lẫn khí oxygen, làm giảm hiệu suất điện phân. Dung dịch sodium chloride tại anode cần được làm giàu liên tục nhằm duy trì nồng độ bão hòa NaCl.
Khối lượng NaCl đã bị điện phân là: 300 – 220 = 80g
n NaCl = 80 : 58,5 = \(\frac{{160}}{{117}}mol\)
2NaCl + H2O \( \to \)2NaOH + Cl2 + H2
\(\frac{{160}}{{117}}mol\)\( \to \)
m NaOH = \(\frac{{160}}{{117}}mol\).80% .40 = 43,8g
17.15
Những phát biểu nào sau đây là đúng về hợp chất sodium hydrogencarbonate?
(1) Còn gọi là sodium bicarbonate hay baking soda.
(2) Được dùng để điều trị chứng dư acid trong dạ dày, làm mềm thực phẩm.
(3) Là chất dạng bột màu trắng, dễ bị oxi hóa bởi oxygen trong không khí
A. (1) và (2) B. (1), (2) và (3) C. (1) và (3) D. (2)
Phương pháp giải:
Dựa vào hợp chất của nguyên tố nhóm IA.
Lời giải chi tiết:
(1) đúng
(2) đúng
(3) sai, không bị oxi hóa bởi oxygen trong không khí, chỉ không bền với nhiệt độ.
Đáp án A
17.16
Những phát biểu nào sau đây là đúng?
(a) Soda là chất bột màu trắng, tan trong nước tạo môi trường trung tính.
(b) Soda có thể được dùng để làm mền nước cứng.
(c) Soda bền với nhiệt hơn so với baking soda.
(d) Chất béo có thể bị thủy phân trong dung dịch soda tạo thành xà phòng.
(e) Có thể dùng baking soda thay cho soda trong việc tẩy rửa lớp dầu, mỡ bám vào bồn rửa.
Phương pháp giải:
Dựa vào hợp chất của nguyên tố nhóm IA.
Lời giải chi tiết:
Phát biểu đúng: (b); (c); (d); (e).
a sai, soda tan trong nước tạo môi trường base.
17.17
Soda được sản xuất theo phương pháp Solxay theo các phương trình hóa học sau:
NaCl(aq) + CO2(g) + H2O(l) + NH3(aq) →NaHCO3(s) + NH4Cl(aq) (1)
2NaHCO3(s) →Na2CO3(s) + CO2(g) + H2O(g) (2)
2NH4Cl(aq) + CaO(s)→ 2NH3(g) + CaCl2(aq) + H2O(l) (3)
Những phát biểu nào sau đây là không đúng?
(a) Phản ứng (1) cho thấy H2CO3 (CO2 + H2O) có tính acid mạnh hơn dung dịch HCl.
(b) Muối sodium hydrogencarbonate ít tan trong nước và kém bền khi bị nung nóng.
(c) Phản ứng (3) nhằm thu hồi và tái sử dụng NH3.
(d) Trong phản ứng (2) khối lượng chất rắn giảm 45% sau khi nung (giả sử hiệu suất nung là 100%).
Phương pháp giải:
Dựa vào một số hợp chất của nguyên tố nhóm IA.
Lời giải chi tiết:
a sai vì H2CO3 có tính acid yếu hơn dung dịch HCl.
d sai vì:
giả sử ban đầu có 1 mol NaHCO3 \( \to \)m NaHCO3 = 1.84 = 84g
Từ (2) ta có: n Na2CO3 = 0,5 mol \( \to \)m Na2CO3 = 0,5.106 = 53g
Vậy khối lượng chất rắn giảm = m NaHCO3 – m Na2CO3 = 84 – 53 = 31g
Vậy khối lượng chất rắn giảm \(\frac{{31}}{{84}}.100\% = \)37% sau khi nung.
17.18
Nhiệt tạo thành của một số chất được cho trong bảng sau:
|
Chất |
Na2CO3(s) |
NaHCO3(s) |
Na2O(s) |
CO2(g) |
H2O(l) |
|
\({\Delta _f}H_{298}^0\) (kJ.mol – 1) |
-1130,70 |
-950,81 |
-414,20 |
-393,51 |
-285,83 |
Một phát biểu sau đây là đúng hay sai?
Những phát biểu nào sau đây là không đúng?
(a) Quá trình hình thành muối NaHCO3 từ các đơn chất thuận lợi về năng lượng hơn so với quá trình hình thành muối Na2CO3 từ các đơn chất.
(b) Giá trị biến thiên enthalpy chuẩn bị của phản ứng
2NaHCO3(s) \( \to \) Na2CO3(s) + H2O(l) + CO2(g) là -91,28kJ.
(c) Phản ứng Na2CO3(s) \( \to \) Na2O(s) + CO2(g) không diễn ra ở điều kiện thường, phù hợp với giá trị biến thiên enthalpy chuẩn của phản ứng khá dương.
(d) Na2CO3 bền với nhiệt hơn NaHCO3.
Phương pháp giải:
Dựa vào tính chất hóa học của nguyên tố nhóm IA.
Lời giải chi tiết:
Phát biểu (b) sai vì \(\begin{array}{l}{\Delta _r}H_{298}^o = {\Delta _f}H_{298}^o(N{a_2}C{O_3}) + {\Delta _f}H_{298}^o(C{O_2}) + {\Delta _f}H_{298}^o({H_2}{\rm{O}}) - 2{\Delta _f}H_{298}^o(NaHC{O_3})\\ = - 1130,7 + ( - 393,51) + ( - 285,83) - 2.( - 1130,70) = 91,58kJ\end{array}\)
Các bài khác cùng chuyên mục
- Bài 22. Sơ lược về sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch trang 74, 75, 76 SBT Hóa 12 Cánh diều
- Bài 21. Sơ lược về phức chất trang 69, 70, 71 SBT Hóa 12 Cánh diều
- Bài 20. Sơ lược về kim loại chuyển tiếp dãy thứ nhất trang 65, 66 SBT Hóa 12 Cánh diều
- Bài 19. Nước cứng và làm mềm nước cứng trang 63,64 SBT Hóa 12 Cánh diều
- Bài 18. Nguyên tố nhóm IIA trang 58, 59, 60 SBT Hóa 12 Cánh diều
- Bài 22. Sơ lược về sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch trang 74, 75, 76 SBT Hóa 12 Cánh diều
- Bài 21. Sơ lược về phức chất trang 69, 70, 71 SBT Hóa 12 Cánh diều
- Bài 20. Sơ lược về kim loại chuyển tiếp dãy thứ nhất trang 65, 66 SBT Hóa 12 Cánh diều
- Bài 19. Nước cứng và làm mềm nước cứng trang 63,64 SBT Hóa 12 Cánh diều
- Bài 18. Nguyên tố nhóm IIA trang 58, 59, 60 SBT Hóa 12 Cánh diều













Danh sách bình luận