Đề thi giữa kì 2 Hóa 10 - Cánh diều - Đề số 5
Tính số oxi hóa của S trong các hợp chất sau (viết đúng thứ tự hợp chất):
Đề bài
Tính số oxi hóa của S trong các hợp chất sau (viết đúng thứ tự hợp chất): Cu2S, FeS2, NaHSO4, (NH4)2S2O8, Na2SO3
-
A.
-4; -2; +6: +7; +4
-
B.
-4: -1; +6; +7; +4
-
C.
-2; -1; +6;+6; +4
-
D.
-2; -1; +6; +7; +4
Cho biết trong phản ứng sau: 4HNO3đặc nóng + Cu → Cu(NO3)2 + 2NO2 + 2H2O. HNO3 đóng vai trò là:
-
A.
chất oxi hóa
-
B.
Acid.
-
C.
môi trường.
-
D.
Cả A và C.
Cho phương trình phản ứng hoá học sau:
1. 4HClO3 + 3H2S → 4HCl + 3H2SO4
2. 8Fe + 30 HNO3 → 8Fe(NO3)3 + 3N2O + 15H2O
3. 16HCl + 2KMnO4 → 2KCl + 2MaCl2 + 8H2O + 5Cl2
4. Mg + CuSO4 → MgSO4 + Cu
5. 2NH3 + 3Cl2 → N2 + 6HCl
Trong các phản ứng trên các chất khử là:
-
A.
H2S, Fe, KMnO4, Mg, NH3
-
B.
H2S, Fe, HCl, Mg, NH3
-
C.
HClO3, Fe, HCl, Mg, Cl2
-
D.
H2S, HNO3, HCl, CuSO4, Cl2
Phát biểu nào dưới đây không đúng?
-
A.
Phản ứng oxi hoá - khử là phản ứng luôn xảy ra đồng thời sự oxi hoá và sự khử.
-
B.
Phản ứng oxi hoá - khử là phản ứng trong đó có sự thay đổi số oxi hoá của tất cả các nguyên tố.
-
C.
Phản ứng oxi hoá - khử là phản ứng trong đó xảy ra sự trao đổi electron giữa các chất.
-
D.
Phản ứng oxi hoá - khử là phản ứng trong đó có sự thay đổi số oxi hoá của một số nguyên tố
KMnO4 + FeSO4 + H2SO4 → Fe2(SO4)3 + K2SO4 + MnSO4 + H2O. Hệ số của chất oxi hóa và chất khử trong phản ứng trên lần lượt là
-
A.
10 và 2.
-
B.
1 và 5.
-
C.
2 và 10.
-
D.
5 và 1.
Cho 20,4 gam hỗn hợp A gồm Al, Zn và Fe tác dụng với dung dịch HCl dư, thu được 11,15 lít H2. Mặt khác 0,2 mol A tác dụng vừa đủ với 6,817 lít Cl2. Tính khối lượng của Al trong hỗn hợp A (biết khí đo được ở đktc)
-
A.
1,35 gam.
-
B.
4,05 gam.
-
C.
5,4 gam.
-
D.
2,7 gam.
Phản ứng tỏa nhiệt có
-
A.
\(\Delta H \ne 0\)
-
B.
\(\Delta H = 0\)
-
C.
\(\Delta H < 0\)
-
D.
\(\Delta H > 0\)
Cho phương trình nhiệt hóa học sau: \({H_2}(g) + {I_2}(g) \to 2HI(g){\rm{ }}\Delta {\rm{H = 11,3kJ}}\)
Phát biểu nào sau đây về sự trao đổi năng lượng của phản ứng trên là đúng?
-
A.
Phản ứng giải phóng nhiệt lượng 11,3 kJ khi 2 mol HI được tạo thành.
-
B.
Tổng nhiệt phá vỡ liên kết của chất phản ứng lớn hơn nhiệt tỏa ra khi tạo thành sản phẩm
-
C.
Năng lượng chứa trong H2 và I2 cao hơn trong HI
-
D.
Phản ứng xảy ra với tốc độ chậm
Phản ứng nào sau đây là phản ứng tỏa nhiệt
-
A.
Phản ứng nhiệt phân muối KNO3
-
B.
Phản ứng phân hủy khí NH3
-
C.
Phản ứng oxi hóa glucose trong cơ thể
-
D.
Phản ứng hòa tan NH4Cl trong nước
Cho phản ứng hydrogen hóa ethylene sau: \({H_2}C = C{H_2}(g) + {H_2}(g) \to {H_3}C - C{H_3}(g)\). Biết năng lượng liên kết trong các chất cho trong bảng sau:
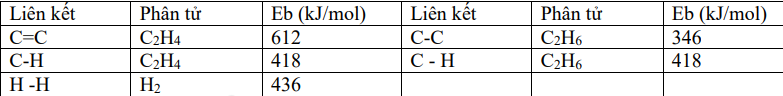
Biến thiên enthalpy (kJ) của phản ứng có giá trị là:
-
A.
134
-
B.
-134
-
C.
478
-
D.
284
Khí hydrogen và khí oxygen sẽ gây nổ theo tỉ lệ mol tương ứng là 2:1 khi xảy ra phản ứng như sau: 2H2(g) + O2(g) \( \to \)2H2O(l) \({\Delta _r}H_{298}^0\) của phản ứng năng lượng liên kết là:
-
A.
\({\Delta _r}H_{298}^0 = {E_b}({H_2}) + {E_b}({O_2}) - {E_b}({H_2}{\rm{O}})\)
-
B.
\({\Delta _r}H_{298}^0 = 2.{E_b}({H_2}) + {E_b}({O_2}) - 2.{E_b}({H_2}{\rm{O}})\)
-
C.
\({\Delta _r}H_{298}^0 = {E_b}({H_2}) - {E_b}({O_2}) - .{E_b}({H_2}{\rm{O}})\)
-
D.
\({\Delta _r}H_{298}^0 = 2.{E_b}({H_2}O) - 2.{E_b}({H_2}) - 2.{E_b}({{\rm{O}}_{\rm{2}}})\)
Cho phương trình nhiệt hóa học sau:
P(s, đỏ) \( \to \)P(s, trắng) \({\Delta _r}H_{298}^0 = 17,6kJ\)
Phát biểu nào sau đây về sự trao đổi năng lượng của phản ứng trên là không đúng?
-
A.
Năng lượng chứa trong P trắng cao hơn trong P đỏ
-
B.
Nhiệt tạo thành chuẩn của P đỏ cao hơn P trắng
-
C.
Phản ứng hấp thụ giải phóng nhiệt lượng 17,6 kJ khi chuyển hóa từ P đỏ sang P trắng
-
D.
P đỏ bền hơn P trắng
Phản ứng tổng hợp ammonia: \({N_2}(g) + 3{H_2}(g) \to 2N{H_3}(g){\rm{ }}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = - 92kJ\)
Biết năng lượng liên kết (kJ/mol) của \(N \equiv N\)và H – H lần lượt là 946 và 436. Năng lượng liên kết của N – H trong ammonia là:
-
A.
391 kJ/mol
-
B.
361 kJ/mol
-
C.
245 kJ/mol
-
D.
490 kJ/mol
: Cho phương trình nhiệt hóa học của phản ứng ứng: \(2{H_2}(g) + {O_2}(g) \to 2{H_2}{\rm{O}}(l){\rm{ }}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = - 571,68kJ\)
Lượng nhiệt tỏa ra hay thu vào khi dùng 5g H2(g) để tạo thành H2O(l) là:
-
A.
Thu vào 1429,2 kJ
-
B.
Tỏa ra 714,6 kJ
-
C.
Thu vào 714,6 kJ
-
D.
Tỏa ra 1429,2 kJ
Cho 16,5g Zn vào 500g dung dịch HCl 1M, dung dịch thu được có nhiệt độ tăng thêm 5oC. Giả thiết không có sự thất thoát nhiệt ra ngoài môi trường, nhiệt dung của dung dịch loãng bằng nhiệt dung của nước (4,2 J/g.K). Nhiệt lượng của phản ứng (KJ) của phản ứng giữa Zn và HCl trong dung dịch có giá trị là
-
A.
84
-
B.
21
-
C.
42
-
D.
24
Lời giải và đáp án
Tính số oxi hóa của S trong các hợp chất sau (viết đúng thứ tự hợp chất): Cu2S, FeS2, NaHSO4, (NH4)2S2O8, Na2SO3
-
A.
-4; -2; +6: +7; +4
-
B.
-4: -1; +6; +7; +4
-
C.
-2; -1; +6;+6; +4
-
D.
-2; -1; +6; +7; +4
Đáp án : D
Dựa vào quy tắc xác định số oxi hóa
Số oxi hóa của S trong Cu2S là: 2.(+1) + x = 0 => x = -2
Số oxi hóa của S trong FeS2 là: (+2).1 + 2.x = 0 => x = -1
Số oxi hóa của S trong NaHSO4 là: (+1) + (+1) + x + 4.(-2) = 0 => x = +6
Số oxi hóa của S trong (NH4)2S2O8 là: (+1).2 + 2.x + 8.(-2) = 0 => x = +7
Số oxi hóa của S trong Na2SO3 là: 2.(+1) + x + 3.(-2) = 0 => x = +4
Đáp án D
Cho biết trong phản ứng sau: 4HNO3đặc nóng + Cu → Cu(NO3)2 + 2NO2 + 2H2O. HNO3 đóng vai trò là:
-
A.
chất oxi hóa
-
B.
Acid.
-
C.
môi trường.
-
D.
Cả A và C.
Đáp án : D
Dựa vào sự thay đổi số oxi hóa của HNO3
Trong phản ứng, HNO3 đóng vai trò là chất oxi hóa và là môi trường để thực hiện phản ứng
Đáp án D
Cho phương trình phản ứng hoá học sau:
1. 4HClO3 + 3H2S → 4HCl + 3H2SO4
2. 8Fe + 30 HNO3 → 8Fe(NO3)3 + 3N2O + 15H2O
3. 16HCl + 2KMnO4 → 2KCl + 2MaCl2 + 8H2O + 5Cl2
4. Mg + CuSO4 → MgSO4 + Cu
5. 2NH3 + 3Cl2 → N2 + 6HCl
Trong các phản ứng trên các chất khử là:
-
A.
H2S, Fe, KMnO4, Mg, NH3
-
B.
H2S, Fe, HCl, Mg, NH3
-
C.
HClO3, Fe, HCl, Mg, Cl2
-
D.
H2S, HNO3, HCl, CuSO4, Cl2
Đáp án : B
Chất khử là chất nhường electron
1. \({H_2}\mathop S\limits^{ - 2} \to {H_2}\mathop S\limits^{ + 6} {O_4} + 4e\)
2. \(F{e^0} \to F{e^{ + 3}} + 3{\rm{e}}\)
3. \(H\mathop {Cl}\limits^{ - 1} \to C{l^0} + 1{\rm{e}}\)
4. \(M{g^0} \to M{g^{ + 2}} + 2{\rm{e}}\)
5. \(\mathop N\limits^{ - 3} {H_3} \to {N^0} + 3e\)
Đáp án B
Phát biểu nào dưới đây không đúng?
-
A.
Phản ứng oxi hoá - khử là phản ứng luôn xảy ra đồng thời sự oxi hoá và sự khử.
-
B.
Phản ứng oxi hoá - khử là phản ứng trong đó có sự thay đổi số oxi hoá của tất cả các nguyên tố.
-
C.
Phản ứng oxi hoá - khử là phản ứng trong đó xảy ra sự trao đổi electron giữa các chất.
-
D.
Phản ứng oxi hoá - khử là phản ứng trong đó có sự thay đổi số oxi hoá của một số nguyên tố
Đáp án : B
Phản ứng oxi hóa khử là phản ứng có sự thay đổi số oxi hóa của một số nguyên tố hoặc sự trao đổi electron giữa các chất
Đáp án B
KMnO4 + FeSO4 + H2SO4 → Fe2(SO4)3 + K2SO4 + MnSO4 + H2O. Hệ số của chất oxi hóa và chất khử trong phản ứng trên lần lượt là
-
A.
10 và 2.
-
B.
1 và 5.
-
C.
2 và 10.
-
D.
5 và 1.
Đáp án : C
Cân bằng phương trình theo phương pháp thăng bằng electron
\(\begin{array}{l}F{e^{ + 2}} \to F{e^{ + 3}} + 1{\rm{e|x5}}\\M{n^{ + 7}} + 5{\rm{e}} \to M{n^{ + 2}}|x1\end{array}\)
2KMnO4 + 10FeSO4 + 18H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 18H2O
Hệ số của chất oxi hóa 2 và hệ số chất khử là 10
Đáp án C
Cho 20,4 gam hỗn hợp A gồm Al, Zn và Fe tác dụng với dung dịch HCl dư, thu được 11,15 lít H2. Mặt khác 0,2 mol A tác dụng vừa đủ với 6,817 lít Cl2. Tính khối lượng của Al trong hỗn hợp A (biết khí đo được ở đktc)
-
A.
1,35 gam.
-
B.
4,05 gam.
-
C.
5,4 gam.
-
D.
2,7 gam.
Đáp án : D
Dựa vào phương pháp bảo toàn electron
Đặt số mol của Fe, Zn, Al lần lượt là x, y, z
Ta có: 56x + 65y + 27z = 20,4 (1)
Fe + 2HCl \( \to \) FeCl2 + H2
x \( \to \) x
Zn + 2HCl \( \to \)ZnCl2 + H2
y \( \to \) y
2Al + 6HCl \( \to \)2AlCl3 + 3H2
z \( \to \) 3z/2
n H2 = 11,15 : 24,79 = 0,45 = x + y + 3z/2 (2)
Mặt khác: số mol của X là: kx + ky + kz = 0,2 (3)
2Fe + 3Cl2 \( \to \)2FeCl3
kx\( \to \) 1,5kx
Zn + Cl2 \( \to \)ZnCl2
ky \( \to \)ky
2Al + 3Cl2\( \to \)2AlCl3
kz \( \to \)1,5kz
n Cl2 = 6,817 : 24,79 = 0,275 = 1,5kx + ky + 1,5kz (4)
Từ (1), (2), (3), (4) ta có: \(\left\{ \begin{array}{l}x = 0,2\\y = 0,1\\z = 0,1\end{array} \right.\)
m Al = 0,1 . 27 = 2,7g
Đáp án D
Phản ứng tỏa nhiệt có
-
A.
\(\Delta H \ne 0\)
-
B.
\(\Delta H = 0\)
-
C.
\(\Delta H < 0\)
-
D.
\(\Delta H > 0\)
Đáp án : C
Phản ứng tỏa nhiệt có \(\Delta H < 0\)
Đáp án C
Cho phương trình nhiệt hóa học sau: \({H_2}(g) + {I_2}(g) \to 2HI(g){\rm{ }}\Delta {\rm{H = 11,3kJ}}\)
Phát biểu nào sau đây về sự trao đổi năng lượng của phản ứng trên là đúng?
-
A.
Phản ứng giải phóng nhiệt lượng 11,3 kJ khi 2 mol HI được tạo thành.
-
B.
Tổng nhiệt phá vỡ liên kết của chất phản ứng lớn hơn nhiệt tỏa ra khi tạo thành sản phẩm
-
C.
Năng lượng chứa trong H2 và I2 cao hơn trong HI
-
D.
Phản ứng xảy ra với tốc độ chậm
Đáp án : B
Dựa vào năng lượng hóa học của phản ứng
Phản ứng trên là phản ứng thu nhiệt, nên năng lượng chứa trong HI lớn hơn hỗn hợp H2 và I2 và tổng nhiệt phá vỡ liên kết của chất phản ứng lớn hơn nhiệt tỏa ra khi tạo thành sản phẩm
Đáp án B
Phản ứng nào sau đây là phản ứng tỏa nhiệt
-
A.
Phản ứng nhiệt phân muối KNO3
-
B.
Phản ứng phân hủy khí NH3
-
C.
Phản ứng oxi hóa glucose trong cơ thể
-
D.
Phản ứng hòa tan NH4Cl trong nước
Đáp án : C
Phản ứng tỏa nhiệt là phản ứng tỏa ra năng lượng dưới dạng nhiệt
Phản ứng oxi hóa glucose trong cơ thể là phản ứng tỏa nhiệt
Đáp án C
Cho phản ứng hydrogen hóa ethylene sau: \({H_2}C = C{H_2}(g) + {H_2}(g) \to {H_3}C - C{H_3}(g)\). Biết năng lượng liên kết trong các chất cho trong bảng sau:

Biến thiên enthalpy (kJ) của phản ứng có giá trị là:
-
A.
134
-
B.
-134
-
C.
478
-
D.
284
Đáp án : B
Dựa vào năng lượng liên kết của các chất để tính biến thiên enthalpy của phản ứng
\({\Delta _r}H_{298}^0 = {E_{H2C = CH2}} + {E_{H2}} - {E_{H3C - CH3}}\)= E C=C + 4. E C – H + E H – H – E C – C – 6. E C – H
= 612 + 4. 418 + 436 – 346 – 6. 418 = - 134 kJ
Đáp án B
Khí hydrogen và khí oxygen sẽ gây nổ theo tỉ lệ mol tương ứng là 2:1 khi xảy ra phản ứng như sau: 2H2(g) + O2(g) \( \to \)2H2O(l) \({\Delta _r}H_{298}^0\) của phản ứng năng lượng liên kết là:
-
A.
\({\Delta _r}H_{298}^0 = {E_b}({H_2}) + {E_b}({O_2}) - {E_b}({H_2}{\rm{O}})\)
-
B.
\({\Delta _r}H_{298}^0 = 2.{E_b}({H_2}) + {E_b}({O_2}) - 2.{E_b}({H_2}{\rm{O}})\)
-
C.
\({\Delta _r}H_{298}^0 = {E_b}({H_2}) - {E_b}({O_2}) - .{E_b}({H_2}{\rm{O}})\)
-
D.
\({\Delta _r}H_{298}^0 = 2.{E_b}({H_2}O) - 2.{E_b}({H_2}) - 2.{E_b}({{\rm{O}}_{\rm{2}}})\)
Đáp án : B
Dựa vào công thức tính \({\Delta _r}H_{298}^0\)theo năng lượng liên kết
\({\Delta _r}H_{298}^0 = 2.{E_b}({H_2}) + {E_b}({O_2}) - 2.{E_b}({H_2}{\rm{O}})\)
Đáp án B
Cho phương trình nhiệt hóa học sau:
P(s, đỏ) \( \to \)P(s, trắng) \({\Delta _r}H_{298}^0 = 17,6kJ\)
Phát biểu nào sau đây về sự trao đổi năng lượng của phản ứng trên là không đúng?
-
A.
Năng lượng chứa trong P trắng cao hơn trong P đỏ
-
B.
Nhiệt tạo thành chuẩn của P đỏ cao hơn P trắng
-
C.
Phản ứng hấp thụ giải phóng nhiệt lượng 17,6 kJ khi chuyển hóa từ P đỏ sang P trắng
-
D.
P đỏ bền hơn P trắng
Đáp án : B
Dựa vào kiến thức về năng lượng hóa học của phản ứng
Phản ứng trên là phản ứng thu nhiệt nên năng lượng chứa trong P trắng lớn hơn P đỏ => P đỏ bền hơn P trắng.
Vì cả P đỏ và P trắng đều là đơn chất nên nhiệt tạo thành chuẩn = 0
Đáp án B
Phản ứng tổng hợp ammonia: \({N_2}(g) + 3{H_2}(g) \to 2N{H_3}(g){\rm{ }}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = - 92kJ\)
Biết năng lượng liên kết (kJ/mol) của \(N \equiv N\)và H – H lần lượt là 946 và 436. Năng lượng liên kết của N – H trong ammonia là:
-
A.
391 kJ/mol
-
B.
361 kJ/mol
-
C.
245 kJ/mol
-
D.
490 kJ/mol
Đáp án : B
Dựa vào công thức tính \({\Delta _r}H_{298}^0\)theo năng lượng liên kết của các chất
\({\Delta _r}H_{298}^0\)= E N2 + 3. E H2 – 2. ENH3 = E N2 + 3. E H-H – 2.3. E N-H = 92
=> 6E N – H = 946 + 3.436 – 92 = 2162 => E N-H = 2162 : 6 = 361 KJ/mol
Đáp án B
: Cho phương trình nhiệt hóa học của phản ứng ứng: \(2{H_2}(g) + {O_2}(g) \to 2{H_2}{\rm{O}}(l){\rm{ }}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = - 571,68kJ\)
Lượng nhiệt tỏa ra hay thu vào khi dùng 5g H2(g) để tạo thành H2O(l) là:
-
A.
Thu vào 1429,2 kJ
-
B.
Tỏa ra 714,6 kJ
-
C.
Thu vào 714,6 kJ
-
D.
Tỏa ra 1429,2 kJ
Đáp án : D
Dựa vào \({\Delta _r}H_{298}^0\)của phản ứng
n H2 = 5: 2 = 2,5 mol
Lượng nhiệt tỏa ra khi dùng 2,5 mol H2(g) để tạo thành 2,5 mol H2O(l) là: 2,5 . 571,68 = 1429,2 kJ
Đáp án D
Cho 16,5g Zn vào 500g dung dịch HCl 1M, dung dịch thu được có nhiệt độ tăng thêm 5oC. Giả thiết không có sự thất thoát nhiệt ra ngoài môi trường, nhiệt dung của dung dịch loãng bằng nhiệt dung của nước (4,2 J/g.K). Nhiệt lượng của phản ứng (KJ) của phản ứng giữa Zn và HCl trong dung dịch có giá trị là
-
A.
84
-
B.
21
-
C.
42
-
D.
24
Đáp án : C
Dựa vào công thức Q = m.C.\(\Delta T\)
n Zn = 16,5 : 65 = 0,254 mol
n HCl = 0,5 mol
Zn + 2HCl \( \to \)ZnCl2 + H2
0,254 0,5
n HCl < n Zn
Q = 500.4,2.5 = 10500 J
\(\Delta H = \frac{{10500}}{{0,25}} = 42000J = 42kJ\)
Đáp án C
a) Vì SO2 đóng vai trò chất oxi hóa trong phản ứng trên nên gọi là phản ứng khử sulfur
b) \({\Delta _r}H_{298}^0 = {\Delta _f}H_{298}^0(CaS{O_3}) + {\Delta _f}H_{298}^0(C{O_2}) - {\Delta _f}H_{298}^0(CaC{O_3}) - {\Delta _f}H_{298}^0(S{O_2})\)
= -1634,9 + (-393,5) – (-1207,6) – (-296,8) = -524 kJ. Phản ứng tỏa nhiệt nên thuận lợi về mặt năng lượng
c) Là phản ứng oxi hóa khử vì làm tăng số oxi hóa của sulfur từ +4 lên +6
- a) Theo định luật bảo toàn khối lượng: m hỗn hợp Mg và Al + m X = m chất rắn
=> m X = 8,84 – 2,52 = 6,32g
Đặt số mol của O2 và Cl2 là x và y
n X = 2,479 : 24,79 = 0,1 mol => x + y = 0,1 mol (1)
m X = 32x + 71y = 6,32 (2)
Từ (1) và (2) => \(\left\{ \begin{array}{l}x = 0,02\\y = 0,08\end{array} \right.\)
%VO2 = \(\frac{{0,02}}{{0,1}}.100 = 20\% \); V Cl2 = 80%
b) gọi số mol Mg và Al lần lượt là a và b mol
Theo quá trình cho – nhận electron ta có:
\(\begin{array}{l}M{g^0} \to M{g^{ + 2}} + 2{\rm{e}}\\A{l^o} \to A{l^{ + 3}} + 3e\end{array}\) \(\begin{array}{l}O_2^o + 4e \to {O^{ - 2}}\\Cl_2^0 + 2e \to C{l^{ - 1}}\end{array}\)
Ta có: m hỗn hợp = 24a + 27b = 2,52g
Theo bảo toàn electron: 2a + 3b = 0,02.4 + 0,08.2 = 0,24
=> a = 0,06; b = 0,04 mol
Phản ứng oxi hóa – khử là phản ứng có sự nhường và nhận
Số oxi hóa của các nguyên tử trong đơn chất bằng
Phát biểu nào sau đây là đúng?
Trong phản ứng oxi hóa – khử, chất nhường electron được gọi là:
Cho dãy gồm các phân tử và ion: Zn, S, FeO, SO2, Fe2+, Cu2+, HCl.
. Số oxi hóa của N trong NH3, HNO2, NO3- lần lượt là:
Số oxi hóa của S trong SO2 và SO42- lần lượt là:
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |










Bình luận