1. Tính chất vật lí
- Ở điều kiện thường, NH3 là chất khí không màu, nhẹ hơn không khí, mùi khai và xốc.
- Khí NH3 tan tốt trong nước do tạo được liên kết hydrogen với nước.
2. Khả năng phản ứng của NH3
NH3 nhận proton H+ của H2O → Dung dịch NH3 có môi trường base yếu, làm quỳ tím hoá xanh, làm phenolphtalein hoá hồng.\({\rm{N}}{{\rm{H}}_{\rm{3}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{NH}}_{\rm{4}}^{\rm{ + }}{\rm{ + O}}{{\rm{H}}^ - }\)
3. Tính base
Tác dụng với nước → dung dịch ammonia
- Khi tan vào nước NH3 nhận H+ của nước thể hiện tính base tạo thành ion ammonium (NH4+):
NH3 + H2O \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)NH4+ + OH-
- Dung dịch NH3 có môi trường base yếu, làm quì tím chuyển xanh, phenolphtalein chuyển hồng.
Tác dụng với acid → muối ammonium
- Ở trạng thái khí hoặc dung dịch ammonia có khả năng nhận H+ của acid tạo thành muối ammonium (NH4+): NH3 + H+ → NH4+
NH3 + HCl → NH4Cl (nếu NH3 dạng khí, HCl đặc thì NH4Cl tạo thành dạng khói trắng)
NH3 + HNO3 → NH4NO3
2NH3 + H2SO4 → (NH4)2SO4
Tác dụng với dung dịch muối → muối ammonium (NH4+) + hydroxide của kim loại
MgCl2 + 2NH3 + H2O → Mg(OH)2↓ + 2NH4Cl
Fe(NO3)3 + 3NH3 + H2O → Fe(OH)3↓ + 3NH4NO3
4. Tính khử
- Trong phân tử NH3, N có số oxi hoá -3 là thấp nhất nên NH3 thể hiện tính khử khi tác dụng với chất oxi hoá như oxygen:
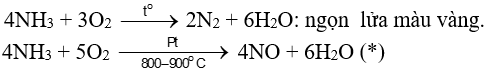
- Phản ứng (*) là giai đoạn trung gian trong quá trình điều chế nitric acid từ ammonia trong CN.

 Nitrogen - Sulfur - Từ điển Hoá 11
Nitrogen - Sulfur - Từ điển Hoá 11 






Danh sách bình luận