1. Tính chất vật lí
- Là chất khí, không màu, mùi hắc, nặng hơn không khí, tan nhiều trong nước.
- Là khí độc, hít phải khí SO2 vượt ngưỡng cho phép sẽ gây viêm đường hô hấp.
- \({d_{\frac{{S{O_2}}}{{kk}}}} = \frac{{64}}{{29}} = 2,2 > 1\) → SO2 nặng hơn không khí.
2. Tính chất hoá học
SO2 là oxide acid (acidic oxide) + chất oxi hoá. + chất khử
3. SO2 là acidic oxide
SO2 + H2O\( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)H2SO3 : sulfurous acid.
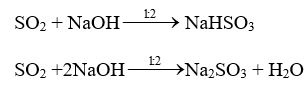
4. SO2 là chất oxi hoá
- Sulfur dioxide tác dụng với hydrogen sulfide tạo sulfur và nước: phản ứng được dùng để chuyển hoá hydrogen sulfide trong khí thiên nhiên thành sulfur.
\(\mathop {{\rm{S}}{{\rm{O}}_{\rm{2}}}}\limits^{{\rm{ + 4}}\,\,\,\,\,\,} {\rm{ + 2}}{{\rm{H}}_{\rm{2}}}\mathop {\rm{S}}\limits^{{\rm{ - 2}}} \to {\rm{3}}\mathop {\rm{S}}\limits^{\rm{0}} {\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O}}\)
5. SO2 là chất khử
- Sulfur dioxide tác dụng với nitrogen dioxide (NO2) khi có xúc tác nitrogen oxide tạo sulfur trioxide: phản ứng giải thích quá trình tạo mưa acid khi không khí bị ô nhiễm bởi sulfur dioxide.
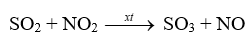
- Tác dụng các chất oxi hoá mạnh : halogen (Br2), postassium permanganate (KMnO4)
\(\mathop {{\rm{S}}{{\rm{O}}_{\rm{2}}}}\limits^{{\rm{ + 4}}\,\,\,\,\,\,} {\rm{ + }}\mathop {{\rm{B}}{{\rm{r}}_{\rm{2}}}}\limits^{\rm{0}} {\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{2H}}\mathop {{\rm{Br}}}\limits^{{\rm{ - 1}}} {\rm{ + }}{{\rm{H}}_{\rm{2}}}\mathop {{\rm{S}}{{\rm{O}}_{\rm{4}}}}\limits^{{\rm{ + 6}}\,\,\,\,\,\,\,\,} \)=> mất màu dung dịch Br2, (SO2 khác CO2).
\({\rm{5S}}{{\rm{O}}_{\rm{2}}}{\rm{ + 2KMn}}{{\rm{O}}_{\rm{4}}}{\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{2}}{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ + 2MnS}}{{\rm{O}}_{\rm{4}}}{\rm{ + }}{{\rm{K}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}\)
=>mất màu thuốc tím : KMnO4 (SO2 khác CO2).

 Nitrogen - Sulfur - Từ điển Hoá 11
Nitrogen - Sulfur - Từ điển Hoá 11 






Danh sách bình luận