1. Tính acid
Dung dịch H2SO4 loãng: Có đầy đủ tính chất của 1 acid mạnh, tương tự acid HCl
H2SO4 + Fe → FeSO4 + H2
H2SO4 + MgO → MgSO4 + H2O
4H2SO4loãng + Fe3O4 → FeSO4 +Fe2(SO4)3 + 4H2O
H2SO4loãng + Fe(OH)2 → FeSO4 + 2H2O
H2SO4 + Na2CO3 → Na2SO4 + H2O + CO2
H2SO4 + BaCl2 → BaSO4 + 2HCl
* Tạo môi trường acid cho nhiều phản ứng trong công nghiệp và nghiên cứu:
- Sản xuất copper (II) sulfate : 2Cu + O2 + 2H2SO4 loãng → 2CuSO4 + 2H2O
- Chuẩn độ permanganate:
5HOOC-COOH + 2KMnO4 +3H2SO4 loãng →10CO2 +K2SO4 + 2MnSO4 + 8H2O
- Sản xuất acquy chì: Pb + PbO2 +2H2SO4loãng → 2PbSO4 +2 H2O
2. Dung dịch H2SO4 đặc
- Tính acid mạnh: Dùng để điều chế một số acid dễ bay hơi
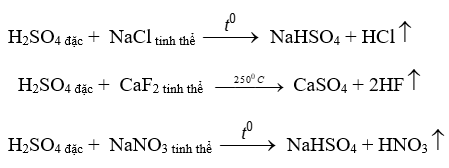
- Tính oxi hoá mạnh
Tác dụng với kim loại: oxi hoá hầu hết kim loại (trừ Au, Pt)
Kim loại (trừ Au,Pt) tạo muối SULFATE hoá trị cao +sản phẩm khử (SO2 , S, H2S) + H2O
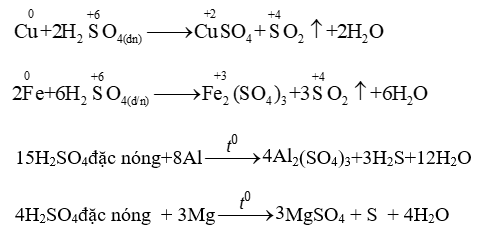
* CHÚ Ý: Al, Fe, Cr bị thụ động hoá (không tác dụng) với H2SO4 đặc nguội.
Tác dụng với phi kim: oxi hoá nhiều phi kim: C → CO2; S → SO2; P → H3PO4
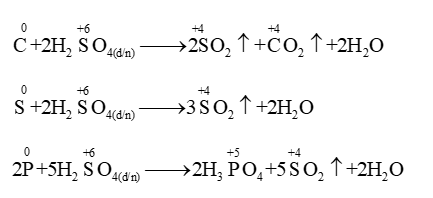
- Tác dụng với hợp chất: đưa nguyên tố trong hợp chất lên số oxi hoá cao nhất.
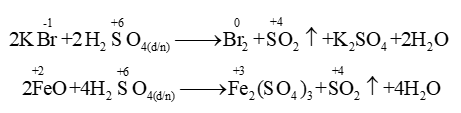
- Tính háo nước:
Dung dịch sulfuric acid đặc có khả năng lấy nước từ hợp chất carbohydrate và khiến chúng hoá đen (hiện tượng than hoa)
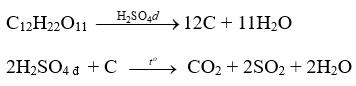

 Nitrogen - Sulfur - Từ điển Hoá 11
Nitrogen - Sulfur - Từ điển Hoá 11 






Danh sách bình luận