1. Hydrocarbon không no là gì?
Hydrocarbon không no là những hydrocarbon trong phân tử có chứa liên kết đôi, liên kết ba ( gọi chung là liên kết bội ) hoặc đồng thời cả liên kết đôi và liên kết ba.
2. Tính chất vật lí
- Ở điều kiện thường, các alkene, alkyne là những chất không mùi và nhẹ hơn nước, từ C2 đến C4 ở thể khí (trừ but – 2 – yne ở thể lỏng); các alkene, alkyne có số C lớn hơn ở thể lỏng hoặc rắn.
- Nhiệt độ nóng chảy, nhiệt độ sôi, khối lượng riêng tăng theo chiều tăng của số nguyên tử C.
- Các alkene, alkyne đều nhẹ hơn nước, hầu như không tan trong nước, tan tốt trong dung môi hữu cơ không phân cực như chloroform, diethyl ether, … do phân tử kém phân cực.
3. Tính chất hoá học
- Do phân tử đều chứa liên kết π kém bền dễ bị phá vỡ trong các phản ứng hoá học nên phản ứng đặc trưng alkene và alkyne là phản ứng cộng, phản ứng trùng hợp và phản ứng oxi hoá.
4. Phản ứng cộng
- Bản chất của phản ứng cộng là phá vỡ liên kết π, chuyển liên kết C=C, C≡C về liên kết C–C.
(a) Phản ứng cộng A2 (H2, X2)
Cộng H2 (hydrogen hoá)
Tổng quát:

Cộng halogen (halogen hoá)
Tổng quát:
CnH2n + Br2 → CnH2nBr2
CnH2n-2 + 2Br2 → CnH2n-2Br4
vàng nâu không màu Alkene, alkyne làm mất màu dung dịch Br2
Phản ứng cộng HA (HX, H – OH)
- Cộng hydrogen halide (HX: HCl, HBr, HI)
Tổng quát: CnH2n + HX → CnH2n+1X
CnH2n-2 + HX → CnH2n-1X
CnH2n-2 + 2HX → CnH2nX2
Qui tắc cộng Markovnikov: Khi cộng HX vào liên kết bội (C=C, C≡C) bất đối xứng, H cộng ưu tiên vào C có nhiều H hơn, X cộng vào C còn lại.
- Cộng nước (hydrate hoá)
TQ: CnH2n + H2O 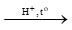 CnH2n+1OH (alcohol), H+ thường là H3PO4 hoặc H2SO4.
CnH2n+1OH (alcohol), H+ thường là H3PO4 hoặc H2SO4.
- Với alkyne: CH ≡ CH + H2O 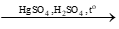 [CH2=CH-OH] → CH3CHO
[CH2=CH-OH] → CH3CHO
(không bền)
CH ≡ C – CH3 + H2O 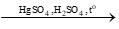 [CH2 = C(OH) – CH3] → CH3 – CO – CH3
[CH2 = C(OH) – CH3] → CH3 – CO – CH3
(không bền)
- Phản ứng cộng nước vào alkene và alkyne cũng tuân theo qui tắc Markovnikov.
- Gốc hydrocarbon không no: CH2 = CH -: vinyl; CH2=CH2 – CH2 -: allyl.
5. Phản ứng trùng hợp của alkene
Phản ứng trùng hợp là quá trình cộng hợp liên tiếp nhiều phân tử nhỏ giống nhau hoặc tương tự nhau (gọi là monomer) để tạo thành chất có phân tử khối lớn (gọi là polimer).
- Các chất có liên kết đôi C = C có khả năng tham gia phản ứng trùng hợp.
VD: nCH2=CH2 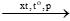 ( CH2 – CH2 )n
( CH2 – CH2 )n
ethylene polyethylene (PE)
6. Phản ứng của alk – 1 – yne với AgNO3 trong NH3
AgNO3 + 3NH3 + H2O → [Ag(NH3)2]OH + NH4NO3
TQ: RC≡CH + [Ag(NH3)2]OH → RC≡CAg↓vàng nhạt + 2NH3 + H2O
THĐB: CH≡CH + 2[Ag(NH3)2]OH → CAg≡CAg↓vàng nhạt + 4NH3 + 2H2O
Phản ứng tạo kết tủa vàng dùng để nhận biết alk – 1 – yne. AgNO3 trong NH3 là thuốc thử Tollens.
7. Phản ứng oxi hoá
(a) Phản ứng oxi hoá không hoàn toàn
- Các alkene và alkyne bị oxi hoá không hoàn toàn làm mất màu dung dịch thuốc tím KMnO4.
VD: 3C2H4 + 2KMnO4 + 4H2O → 3C2H4(OH)2 + 2KOH + 2MnO2↓
3C2H2 + 8KMnO4 → 3(COOK)2 + 2KOH + 8MnO2↓ + 2H2O
Phản ứng dùng để nhận biết alkene, alkyne.
(b) Phản ứng cháy
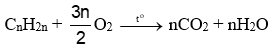
(Đốt cháy alkene \( \Rightarrow \,{n_{C{O_2}}} = {n_{{H_2}O}}\))
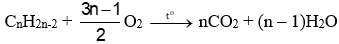
(Đốt cháy alkyne →\({n_{C{O_2}}} > {n_{{H_2}O}}\))
- Alkene và alkyne cháy toả nhiều nhiệt.

 Hydrocarbon - Từ điển Hoá 11
Hydrocarbon - Từ điển Hoá 11 






Danh sách bình luận