1. Tính chất vật lí
- Ở điều kiện thường, nitrogen là chất khí không màu, không mùi, không vị, tan rất ít trong nước, hoá lỏng ở -196oC.
- \({d_{{N_2}/kk}} = \frac{{28}}{{29}} < 1\)\( \Rightarrow \) khí N2 nhẹ hơn không khí.
- Khí nitrogen không duy trì sự cháy và sự hô hấp.
2. Khả năng phản ứng của nitrogen
- Phân tử N2 chứa liên kết ba N ≡ N có năng lượng liên kết lớn nên rất khó bị phá vỡ Ở điều kiện thường N2 khá trơ về mặt hoá học.
- Ở nhiệt độ cao, nitrogen trở nên hoạt động hơn và có khả năng phản ứng với hydrogen (thể hiện tính oxi hoá), oxygen (thể hiện tính khử).
3. Tác dụng với hydrogen (tính oxi hoá)
- Ở nhiệt độ cao, áp suất cao và có xúc tác (Fe) khí nitrogen có phản ứng với khí hydrogen tạo thành khí ammonia (NH3):
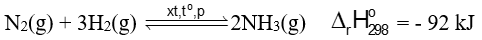
- Quá trình tổng hợp ammonia trên thường được gọi là quá trình Haber – Bosch (Ha-bơ Bớt).
- Phản ứng tổng hợp amonia là quá trình trung gian quan trọng để sản xuất nitric acid, thuốc nổ, đạm nitrate, urea, …
4. Tác dụng với oxygen (tính khử)
- Ở nhiệt độ cao trên 3000 oC hoặc có tia lửa điện, nitrogen kết hợp với oxygen tạo thành nitrogen monoxide (NO):
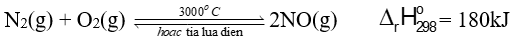
- Trong tự nhiên, phản ứng trên xảy ra trong những cơn mưa dông kèm
theo sấm sét, khởi đầu cho quá trình chuyển hoá từ nitrogen thành
nitric acid (HNO3), sau đó HNO3 tan trong nước phân li ra ion nitrate
(NO3-) là một dạng phân đạm cần thiết cho cây trồng.
- Sơ đồ: 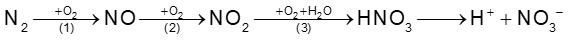
(2) NO(g) + O2 (g) → NO2(g) (phản ứng xảy ra ngay điều kiện thường tạo khí nâu đỏ)
(3) 4NO2(g) + O2(g) + 2H2O(l) → 4HNO3(aq)

 Nitrogen - Sulfur - Từ điển Hoá 11
Nitrogen - Sulfur - Từ điển Hoá 11 






Danh sách bình luận