Trắc nghiệm Bài 18. Kim loại tác dụng với axit không có tính oxi hóa - Hóa 12
Đề bài
Hòa tan hoàn toàn 8,96 gam Fe trong dung dịch H2SO4 dư. Khối lượng muối sinh ra là
-
A.
24,32 gam.
-
B.
22,80 gam.
-
C.
32,00 gam.
-
D.
16,00 gam.
Hoà tan hoàn toàn 15,4 gam hỗn hợp Mg và Zn trong dung dịch HCl dư thấy có 6,72 lít khí thoát ra (ở đktc) và dung dịch X. Cô cạn dung dịch X được bao nhiêu gam muối khan ?
-
A.
26,05 gam.
-
B.
26,35 gam.
-
C.
36,7 gam.
-
D.
37,3 gam.
Cho 13,5 gam hỗn hợp các kim loại Al, Cr, Fe tác dụng với lượng dư dung dịch H2SO4 loãng nóng (trong điều kiện không có không khí), thu được dung dịch X và 7,84 lít khí H2 (đktc). Cô cạn dung dịch X (trong điều kiện không có không khí) được m gam muối khan. Giá trị của m là
-
A.
42,6.
-
B.
45,5.
-
C.
48,8.
-
D.
47,1.
Hoà tan hoàn toàn 16 gam hỗn hợp Mg và Fe bằng dung dịch H2SO4 loãng vừa đủ. Sau phản ứng thấy khối lượng dung dịch tăng thêm 15,2 gam so với ban đầu. Khối lượng muối khan thu được khi cô cạn dung dịch sau phản ứng là
-
A.
53,6 gam.
-
B.
54,4 gam.
-
C.
92 gam.
-
D.
92,8 gam
Hòa tan m gam hỗn hợp X (gồm Al, Fe, Zn và Mg) bằng dung dịch HCl dư. Sau phản ứng, khối lượng dung dịch axit tăng thêm (m - 2) gam. Khối lượng (gam) của muối tạo thành trong dung dịch sau phản ứng là
-
A.
m + 34,5.
-
B.
m + 35,5.
-
C.
m + 69.
-
D.
m + 71.
Cho 33,4 gam hỗn hợp bột mịn X (gồm Al, Cr, Fe, Cu và Ag) vào dung dịch H2SO4 loãng, nóng. Sau khi các phản ứng xảy ra hoàn toàn, có 17,2 gam chất rắn tách ra, đồng thời thu được 11,2 lít khí (đktc). Độ tăng khối lượng của dung dịch sau phản ứng so với khối lượng dung dịch H2SO4 ban đầu là
-
A.
15,2 gam.
-
B.
15,7 gam.
-
C.
32,4 gam.
-
D.
32,9 gam.
Cho 3,68 gam hỗn hợp gồm Al và Zn tác dụng với một lượng vừa đủ dung dịch H2SO4 10%, thu được 2,24 lít khí H2 (ở đktc). Khối lượng dung dịch thu được sau phản ứng là
-
A.
101,68 gam.
-
B.
88,20 gam.
-
C.
101,48 gam.
-
D.
97,80 gam.
Hoà tan hết 7,74 gam hỗn hợp bột Mg, Al bằng 500 ml dung dịch hỗn hợp HCl 1M và H2SO4 0,28M thu được dung dịch X và 8,736 lít khí H2 (đktc). Cô cạn dung dịch X thu được lượng muối khan là
-
A.
38,93 gam.
-
B.
103,85 gam.
-
C.
25,95 gam.
-
D.
77,86 gam.
Cho m gam hỗn hợp Mg, Al vào 250 ml dung dịch X chứa hỗn hợp axit HCl 1M và axit H2SO4 0,5M, thu được 5,32 lít H2 (ở đktc) và dung dịch Y (coi thể tích dung dịch không đổi). Dung dịch Y có pH là
-
A.
1.
-
B.
6.
-
C.
7.
-
D.
2.
Hoà tan hoàn toàn hỗn hợp X gồm Fe và Mg bằng một lượng vừa đủ dung dịch HCl 20%, thu được dung dịch Y. Nồng độ của FeCl2 trong dung dịch Y là 15,76%. Nồng độ phần trăm của MgCl2 trong dung dịch Y là
-
A.
24,24%.
-
B.
15,76%.
-
C.
28,21%.
-
D.
11,79%.
Cho m gam Na tan hết vào 100 ml dung dịch gồm (H2SO4 0,5M và HCl 1M) thu được 4,48 lít khí H2 (ở đktc). Cô cạn dung dịch sau phản ứng khối lượng chất rắn thu được là
-
A.
18,55 gam.
-
B.
17,55 gam.
-
C.
20,95 gam.
-
D.
12,95 gam.
Cho 1,67 gam hỗn hợp gồm hai kim loại ở 2 chu kỳ liên tiếp thuộc nhóm IIA tác dụng hết với dung dịch HCl (dư), thoát ra 0,672 lít khí H2 (ở đktc). Hai kim loại đó là
-
A.
Be và Mg.
-
B.
Ca và Sr.
-
C.
Sr và Ba.
-
D.
Mg và Ca.
X là kim loại thuộc nhóm IIA. Cho 1,7 gam hỗn hợp gồm kim loại X và Zn tác dụng với lượng dư dung dịch HCl, sinh ra 0,672 lít khí H2 (ở đktc). Mặt khác, khi cho 1,9 gam X tác dụng với lượng dư dung dịch H2SO4 loãng, thì thể tích khí hiđro sinh ra chưa đến 1,12 lít (ở đktc). Kim loại X là
-
A.
Ba.
-
B.
Ca.
-
C.
Sr.
-
D.
Mg.
Để hoà tan hoàn toàn 6,4 gam hỗn hợp gồm kim loại R (chỉ có hoá trị II) và oxit của nó cần vừa đủ 400 ml dung dịch HCl 1M. Kim loại R là
-
A.
Ba.
-
B.
Ca.
-
C.
Be.
-
D.
Mg.
Hòa tan hoàn toàn 1,1 gam hỗn hợp gồm một kim loại kiềm X và một kim loại kiềm thổ Y (MX < MY) trong dung dịch HCl dư, thu được 1,12 lít khí H2 (đktc). Kim loại X là
-
A.
K.
-
B.
Na.
-
C.
Rb.
-
D.
Li.
Hoà tan hoàn toàn 2,45 gam hỗn hợp X gồm hai kim loại kiềm thổ vào 200 ml dung dịch HCl 1,25M, thu được dung dịch Y chứa các chất tan có nồng độ mol bằng nhau. Hai kim loại trong X là
-
A.
Mg và Ca.
-
B.
Be và Mg.
-
C.
Mg và Sr.
-
D.
Be và Ca.
Hoà tan hoàn toàn 5,85 gam bột kim loại M vào dung dịch HCl, thu được 7,28 lít khí H2 đktc. Kim loại M là
-
A.
Mg
-
B.
Al
-
C.
Zn
-
D.
Fe
Cho m (gam) hỗn hợp Al, Mg tác dụng với dung dịch HCl dư thu được 12,32 lít khí (đktc). Mặt khác, cũng m (gam) hỗn hợp trên cho tác dụng với dung dịch NaOH dư thu được 6,72 lít khí (đktc). Tính giá trị của m?
-
A.
28,2 gam.
-
B.
22,8 gam.
-
C.
14,1 gam.
-
D.
11,4 gam.
Hòa tan hoàn toàn 5,95 gam hỗn hợp hai kim loại Al và Zn bằng dung dịch H2SO4 loãng thì khối lượng dung dịch tăng 5,55 gam. Khối lượng Al và Zn (tính theo gam) trong hỗn hợp lần lượt là
-
A.
4,05 và 1,9.
-
B.
3,95 và 2,0.
-
C.
2,7 và 3,25.
-
D.
2,95 và 3,0.
Cho 5 gam hỗn hợp X gồm Ag và Al vào dung dịch HCl dư. Sau khi phản ứng xảy ra hoàn toàn, thu được 3,36 lít khí (đktc). Phần trăm khối lượng Ag trong X là
-
A.
46%
-
B.
50,2%
-
C.
54,0%
-
D.
49,8%
Hòa tan hoàn toàn 1,9 gam hỗn hợp gồm Fe, Mg và Al bằng dung dịch H2SO4 loãng vừa đủ, thu được 1,344 lít H2 (đktc). Khối lượng muối khan thu được khi cô cạn dung dịch sau phản ứng là
-
A.
7,66 gam.
-
B.
7,78 gam.
-
C.
8,25 gam.
-
D.
7,72 gam.
Ngâm một lá kim loại có khối lượng 50 gam trong dung dịch HCl, sau khi thu được 336 ml H2 (đktc) thì khối lượng lá kim loại giảm 1,68%. Xác định kim loại đã dùng.
-
A.
Fe
-
B.
Mg
-
C.
Zn
-
D.
Al
Cho hỗn hợp Fe và Zn tác dụng với dung dịch hỗn hợp chứa 0,01 mol HCl và 0,05 mol H2SO4. Sau phản ứng thu được chất rắn X, dung dịch Y và khí Z. Cho khí Z đi qua CuO dư, đun nóng thu được m gam Cu. Giá trị của m là
-
A.
5,32.
-
B.
3,52.
-
C.
2,35.
-
D.
2,53.
Cho 8,85 g hỗn hợp Mg, Cu và Zn vào lượng dư dung dịch HCl thu được 3,36 lít H2 (đktc). Phần chất rắn không phản ứng với axit được rửa sạch rồi đốt cháy trong oxi tạo ta 4 g chất bột màu đen. Phần trăm khối lượng của Mg, Cu, Zn lần lượt là
-
A.
27,12%; 36,72%; 36,16%.
-
B.
36,16%; 36,72%; 27,12%.
-
C.
27,12%; 36,16%; 36,72%.
-
D.
36,16%; 27,12%; 36,72%.
Nung nóng 2,13 gam hỗn hợp X gồm 3 kim loại Mg, Zn và Al ở dạng bột với oxi thu được hỗn hợp Y gồm các oxit có khối lượng 3,33 gam. Thể tích dung dịch HCl 1M vừa đủ để phản ứng hết với Y là
-
A.
150 ml.
-
B.
225 ml.
-
C.
100 ml.
-
D.
75 ml.
Lời giải và đáp án
Hòa tan hoàn toàn 8,96 gam Fe trong dung dịch H2SO4 dư. Khối lượng muối sinh ra là
-
A.
24,32 gam.
-
B.
22,80 gam.
-
C.
32,00 gam.
-
D.
16,00 gam.
Đáp án : A
Bảo toàn nguyên tố : nFeSO4 = nFe
nFe = 0,16 mol
Bảo toàn nguyên tố : nFeSO4 = nFe = 0,16 mol
=> mFeSO4 = 0,16.152 = 24,32 gam
Hoà tan hoàn toàn 15,4 gam hỗn hợp Mg và Zn trong dung dịch HCl dư thấy có 6,72 lít khí thoát ra (ở đktc) và dung dịch X. Cô cạn dung dịch X được bao nhiêu gam muối khan ?
-
A.
26,05 gam.
-
B.
26,35 gam.
-
C.
36,7 gam.
-
D.
37,3 gam.
Đáp án : C
- Bảo toàn nguyên tố: nCl = nHCl = 2nH2
- Bảo toàn khối lượng: mmuối = mkim loại + mgốc Cl
\(\left\{ \begin{gathered}
Mg \hfill \\
Zn \hfill \\
\end{gathered} \right. + HCl \to \left\{ \begin{gathered}
X:M{g^{2 + }};Z{n^{2 + }};C{l^ - } \hfill \\
{H_2} \hfill \\
\end{gathered} \right.\)
- nH2 = 0,3 mol
=> nHCl = 2nH2 = 2.0,3 = 0,6 mol
Bảo toàn nguyên tố: nCl- = 0,6 mol
Bảo toàn khối lượng: mmuối = mkim loại + mCl- = 15,4 + 0,6.35,5 = 36,7 gam
Cho 13,5 gam hỗn hợp các kim loại Al, Cr, Fe tác dụng với lượng dư dung dịch H2SO4 loãng nóng (trong điều kiện không có không khí), thu được dung dịch X và 7,84 lít khí H2 (đktc). Cô cạn dung dịch X (trong điều kiện không có không khí) được m gam muối khan. Giá trị của m là
-
A.
42,6.
-
B.
45,5.
-
C.
48,8.
-
D.
47,1.
Đáp án : D
Bảo toàn nguyên tố: nSO4 = nH2SO4 = nH2
Bảo toàn khối lượng: mmuối = mkim loại + mgốc SO4
nH2 = 0,35 mol
Bảo toàn nguyên tố: nSO4 = nH2SO4 = nH2 = 0,35 = 0,35 mol
Bảo toàn khối lượng: mmuối = mkim loại + mgốc SO4 = 13,5 + 0,35.96 = 47,1 gam
Hoà tan hoàn toàn 16 gam hỗn hợp Mg và Fe bằng dung dịch H2SO4 loãng vừa đủ. Sau phản ứng thấy khối lượng dung dịch tăng thêm 15,2 gam so với ban đầu. Khối lượng muối khan thu được khi cô cạn dung dịch sau phản ứng là
-
A.
53,6 gam.
-
B.
54,4 gam.
-
C.
92 gam.
-
D.
92,8 gam
Đáp án : B
+) mdung dịch tăng = mkim loại – mH2
+) nSO4 = nH2SO4 = nH2 = 0,4 mol
+) Bảo toàn khối lượng: mmuối = mkim loại + mH2
mdung dịch tăng = mkim loại – mH2 = 15,2
=> mH2 = mkim loại – 15,2 = 16 – 15,2 = 0,8 gam
=> nH2 = 0,4 mol => nSO4 = nH2SO4 = nH2 = 0,4 mol
Bảo toàn khối lượng: mmuối = mkim loại + mSO4 = 16 + 0,4.96 = 54,4 gam
Hòa tan m gam hỗn hợp X (gồm Al, Fe, Zn và Mg) bằng dung dịch HCl dư. Sau phản ứng, khối lượng dung dịch axit tăng thêm (m - 2) gam. Khối lượng (gam) của muối tạo thành trong dung dịch sau phản ứng là
-
A.
m + 34,5.
-
B.
m + 35,5.
-
C.
m + 69.
-
D.
m + 71.
Đáp án : D
+) mdung dịch tăng = mkim loại – mH2
+) Bảo toàn nguyên tố: nCl = nHCl = 2nH2 = 2 mol
+) mmuối = mkim loại + mgốc Cl
mdung dịch tăng = mkim loại – mH2 = m – 2
→ mH2 = 2 gam → nH2 = 1 mol
Bảo toàn nguyên tố: nCl = nHCl = 2nH2 = 2 mol
=> khối lượng muối thu được là: mmuối = mkim loại + mgốc Cl = m + 2,35,5 = m + 71 gam
Cho 33,4 gam hỗn hợp bột mịn X (gồm Al, Cr, Fe, Cu và Ag) vào dung dịch H2SO4 loãng, nóng. Sau khi các phản ứng xảy ra hoàn toàn, có 17,2 gam chất rắn tách ra, đồng thời thu được 11,2 lít khí (đktc). Độ tăng khối lượng của dung dịch sau phản ứng so với khối lượng dung dịch H2SO4 ban đầu là
-
A.
15,2 gam.
-
B.
15,7 gam.
-
C.
32,4 gam.
-
D.
32,9 gam.
Đáp án : A
Chất rắn tách ra gồm Cu và Ag không phản ứng
+) độ tăng khối lượng dung dịch là: mdung dịch tăng = mkim loại – mH2
Chất rắn tách ra gồm Cu và Ag không phản ứng
=> mkim loại phản ứng = 33,4 – 17,2 = 16,2 gam
nH2 = 0,5 mol
=> độ tăng khối lượng dung dịch là: mdung dịch tăng = mkim loại – mH2 = 16,2 – 0,5.2 = 15,2 gam
Cho 3,68 gam hỗn hợp gồm Al và Zn tác dụng với một lượng vừa đủ dung dịch H2SO4 10%, thu được 2,24 lít khí H2 (ở đktc). Khối lượng dung dịch thu được sau phản ứng là
-
A.
101,68 gam.
-
B.
88,20 gam.
-
C.
101,48 gam.
-
D.
97,80 gam.
Đáp án : C
nH2 = 0,1 mol
Bảo toàn nguyên tố H: nH2 = nH2SO4 = 0,1 mol
→ mH2SO4 = 0,1.98 = 9,8 gam → mdung dịch H2SO4 = 9,8 / 10% = 98 gam
=> mdung dịch sau phản ứng = mkim loại + mdung dịch H2SO4 – mH2 = 3,68 + 98 – 0,1.2 = 101,48 gam
+ không trừ khối lượng H2 => chọn nhầm A
Hoà tan hết 7,74 gam hỗn hợp bột Mg, Al bằng 500 ml dung dịch hỗn hợp HCl 1M và H2SO4 0,28M thu được dung dịch X và 8,736 lít khí H2 (đktc). Cô cạn dung dịch X thu được lượng muối khan là
-
A.
38,93 gam.
-
B.
103,85 gam.
-
C.
25,95 gam.
-
D.
77,86 gam.
Đáp án : A
+) ${{n}_{{{H}^{+}}}}$= 0,5 + 0,14.2 = 0,78 = $2{{n}_{{{H}_{2}}}}$ => axit phản ứng vừa đủ
+) Bảo toàn khối lượng: mkim loại + mHCl + mH2SO4 = mmuối khan + mH2
nH2 = 0,39 mol; nHCl = 0,5 mol; nH2SO4 = 0,14 mol
+) ${{n}_{{{H}^{+}}}}$= 0,5 + 0,14.2 = 0,78 = $2{{n}_{{{H}_{2}}}}$ => axit phản ứng vừa đủ
Bảo toàn khối lượng: mkim loại + mHCl + mH2SO4 = mmuối khan + mH2
=> mmuối khan = 7,74 + 0,5.36,5 + 0,14.98 – 0,39.2 = 38,93 gam
Cho m gam hỗn hợp Mg, Al vào 250 ml dung dịch X chứa hỗn hợp axit HCl 1M và axit H2SO4 0,5M, thu được 5,32 lít H2 (ở đktc) và dung dịch Y (coi thể tích dung dịch không đổi). Dung dịch Y có pH là
-
A.
1.
-
B.
6.
-
C.
7.
-
D.
2.
Đáp án : A
+) ${{n}_{{{H}^{+}}}}$> 2nH2 => axit dư, dung dịch Y chứa H+
+) ${{n}_{{{H}^{+}}}}$dư = 0,5 – 0,475 = 0,025 mol
=> [H+dư] = 0,1 M => pH = 1
nH2 = 0,2375 mol; nHCl = 0,25 mol; nH2SO4 = 0,125 mol
=> ${{n}_{{{H}^{+}}}}$= 0,25 + 0,125.2 = 0,5 > 2nH2 = 0,475 => axit dư, dung dịch Y chứa H+
${{n}_{{{H}^{+}}}}$dư = 0,5 – 0,475 = 0,025 mol
=> [H+dư] = 0,025 / 0,25 = 0,1 M => pH = 1
Hoà tan hoàn toàn hỗn hợp X gồm Fe và Mg bằng một lượng vừa đủ dung dịch HCl 20%, thu được dung dịch Y. Nồng độ của FeCl2 trong dung dịch Y là 15,76%. Nồng độ phần trăm của MgCl2 trong dung dịch Y là
-
A.
24,24%.
-
B.
15,76%.
-
C.
28,21%.
-
D.
11,79%.
Đáp án : D
Mg + 2HCl → MgCl2 + H2 ̣(1)
a → 2a → a → a
Fe + 2HCl → FeCl2 + H2 (2)
1 → 2 → 1 → 1
+) Từ (1) , (2) => mdung dịch HCl
=> mdung dịch Y = mX + mdung dịch HCl – mH2
Giả sử nMg = a mol và nFe = 1 mol
Mg + 2HCl → MgCl2 + H2
a → 2a → a → a
Fe + 2HCl → FeCl2 + H2
1 → 2 → 1 → 1
=> mHCl = (2a + 2).36,5 => mdung dịch HCl = (2a + 2).36,5 / 20% = 365a + 365
=> mdung dịch Y = mX + mdung dịch HCl – mH2 = 24a + 56 + 365a + 365 – (a + 1).2 = 387a + 419
$ \to \,\,C{\% _{FeC{l_2}}} = \dfrac{{127}}{{387a + 419}}.100\% = 15,76\% \,\,\, \to \,\,a\, = 1$
$ \to \,\,C{\% _{MgC{l_2}}} = \dfrac{{95}}{{387 + 419}}.100\% = 11,79\% $
Cho m gam Na tan hết vào 100 ml dung dịch gồm (H2SO4 0,5M và HCl 1M) thu được 4,48 lít khí H2 (ở đktc). Cô cạn dung dịch sau phản ứng khối lượng chất rắn thu được là
-
A.
18,55 gam.
-
B.
17,55 gam.
-
C.
20,95 gam.
-
D.
12,95 gam.
Đáp án : C
+) nH2 = 0,2 mol > $\frac{1}{2}{n_{{H^ + }}}$=> sau khi phản ứng với axit, Na phản ứng với nước sinh ra H2
2Na + 2H+ → 2Na+ + H2
2Na + H2O → 2NaOH + H2
+) mcrắn khan = ${{m}_{N{{a}^{+}}}}$trong muối + ${{m}_{C{{l}^{-}}}}+{{m}_{SO_{4}^{2-}}}+{{m}_{NaOH}}$
nH2SO4 = 0,05 mol; nHCl = 0,1 mol => = 0,05.2 + 0,1 = 0,2
nH2 = 0,2 mol > $\frac{1}{2}{n_{{H^ + }}}$=> sau khi phản ứng với axit, Na phản ứng với nước sinh ra H2
2Na + 2H+ → 2Na+ + H2
0,2 ← 0,2 → 0,2 → 0,1
2Na + H2O → 2NaOH + H2
0,2 ← 0,2 ← 0,1
+) mcrắn khan = ${{m}_{N{{a}^{+}}}}$trong muối + ${{m}_{C{{l}^{-}}}}+{{m}_{SO_{4}^{2-}}}+{{m}_{NaOH}}$ = 0,2.23 + 0,05.96 + 0,1.35,5 + 0,2.40 = 20,95 gam
Cho 1,67 gam hỗn hợp gồm hai kim loại ở 2 chu kỳ liên tiếp thuộc nhóm IIA tác dụng hết với dung dịch HCl (dư), thoát ra 0,672 lít khí H2 (ở đktc). Hai kim loại đó là
-
A.
Be và Mg.
-
B.
Ca và Sr.
-
C.
Sr và Ba.
-
D.
Mg và Ca.
Đáp án : B
+) Kim loại nhóm IIA có mức oxi hóa +2 trong hợp chất
+)X + 2HCl → XCl2 + H2
0,03 ← 0,03
$ \to \bar M = \frac{{1,67}}{{0,03}} = 55,67$
Ta thấy MCa = 40 < 55,67 < MSr = 88
Kim loại nhóm IIA có mức oxi hóa +2 trong hợp chất
nH2 = 0,03 mol
Gọi X là kim loại chung cho 2 kim loại trên
X + 2HCl → XCl2 + H2
0,03 ← 0,03
$ \to \bar M = \frac{{1,67}}{{0,03}} = 55,67$
Ta thấy MCa = 40 < 55,67 < MSr = 88
=> 2 kim loại là Ca và Sr
X là kim loại thuộc nhóm IIA. Cho 1,7 gam hỗn hợp gồm kim loại X và Zn tác dụng với lượng dư dung dịch HCl, sinh ra 0,672 lít khí H2 (ở đktc). Mặt khác, khi cho 1,9 gam X tác dụng với lượng dư dung dịch H2SO4 loãng, thì thể tích khí hiđro sinh ra chưa đến 1,12 lít (ở đktc). Kim loại X là
-
A.
Ba.
-
B.
Ca.
-
C.
Sr.
-
D.
Mg.
Đáp án : B
+) Gọi M là kí hiệu chung của 2 kim loại X và Zn
+) M + 2HCl → MCl2 + H2
$ \to {\bar M_M} = \frac{{1,7}}{{0,03}} = 56,67$
Vì MZn = 65 > 56,67 => MX < 56,67
+) X + H2SO4 → XSO4 + H2
$ \to {n_X} = \frac{{1,9}}{{{M_X}}} = {n_{{H_2}}}\;\, \to \,\,\frac{{1,9}}{{{M_X}}} < 0,05$
=> MX > 38 => kim loại X là Ca
Gọi M là kí hiệu chung của 2 kim loại X và Zn
a là số mol của M
M + 2HCl → MCl2 + H2
=> nH2 = 0,03 mol = a
$ \to {\bar M_M} = \frac{{1,7}}{{0,03}} = 56,67$
Vì MZn = 65 > 56,67 => MX < 56,67
X + H2SO4 → XSO4 + H2
$\to {{n}_{X}}=\frac{1,9}{{{M}_{X}}}={{n}_{{{H}_{2}}}}\ \,\to \,\,\frac{1,9}{{{M}_{X}}}<0,05$
=> MX > 38
Ta có: 38 < MX < 56,67 => kim loại X là Ca
Để hoà tan hoàn toàn 6,4 gam hỗn hợp gồm kim loại R (chỉ có hoá trị II) và oxit của nó cần vừa đủ 400 ml dung dịch HCl 1M. Kim loại R là
-
A.
Ba.
-
B.
Ca.
-
C.
Be.
-
D.
Mg.
Đáp án : D
+) nR + nRO = nHCl / 2
$\to \,\,{{\bar{M}}_{R,RO}}=\frac{6,4}{0,2}=32$
=> R < 32 < R + 16
Oxit kim loại R là RO
nHCl = 0,4 mol
R + 2HCl → RCl2 + H2
RO + 2HCl → RCl2 + H2O
=> nR + nRO = nHCl / 2 = 0,4 / 2 = 0,2 mol
$\to \,\,{{\bar{M}}_{R,RO}}=\frac{6,4}{0,2}=32$
=> R < 32 < R + 16 => 16 < R < 32
=> R là kim loại Mg
Hòa tan hoàn toàn 1,1 gam hỗn hợp gồm một kim loại kiềm X và một kim loại kiềm thổ Y (MX < MY) trong dung dịch HCl dư, thu được 1,12 lít khí H2 (đktc). Kim loại X là
-
A.
K.
-
B.
Na.
-
C.
Rb.
-
D.
Li.
Đáp án : D
Đặt kim loại chung là R, hóa trị trung bình là x
2R + 2xHCl → 2RClx + xH2
=> nR = nH2 / x => R = 1,1 / nR
Do 1 < x < 2 nêm 11 < R < 22
Vì MX < MY nên MX < 22 => X là Li
nH2 = 0,05 mol
Đặt kim loại chung là R, hóa trị trung bình là x
2R + 2xHCl → 2RClx + xH2
=> nR = 0,1 / x
=> R = 1,1.x / 0,1 = 11x
Do 1 < x < 2 nêm 11 < R < 22
Vì MX < MY nên MX < 22 => X là Li
Hoà tan hoàn toàn 2,45 gam hỗn hợp X gồm hai kim loại kiềm thổ vào 200 ml dung dịch HCl 1,25M, thu được dung dịch Y chứa các chất tan có nồng độ mol bằng nhau. Hai kim loại trong X là
-
A.
Mg và Ca.
-
B.
Be và Mg.
-
C.
Mg và Sr.
-
D.
Be và Ca.
Đáp án : D
+) Do dung dịch sau phản ứng có nồng độ mol bằng nhau nên : nACl2 = nBCl2 = a
TH1: Nếu dung dịch chỉ chứa 2 muối
A + 2HCl → ACl2 + H2
B + 2HCl → BCl2 + H2
+) nHCl = 2a + 2a = 0,25
=> MBe = 9 < 19,6 < MB
$19,6 = \frac{{9a + a.{M_B}}}{{2a}}\,\, \to \,\,{M_B} = 30,2$ (loại)
TH2: Dung dịch sau phản ứng chứa HCl dư
nHCl = nACl2 = nBCl2 = a
=> nHCl (ban đầu) = 0,25 = 4a + a
${{\bar{M}}_{(A,B)}}=\frac{2,45}{2a}=24,5\,\,\,\to \,\,9,24<\bar{M}\,<24,5$
Nếu A là Be => MA = 9
=> $24,5=\frac{9a+a.{{M}_{B}}}{2a}\,\,\to \,\,{{M}_{B}}=40\,\,(Ca)$
Gọi A và B là kí hiệu của 2 kim loại
X là kí hiệu chung của 2 kim loại
Do dung dịch sau phản ứng có nồng độ mol bằng nhau nên : nACl2 = nBCl2 = a
TH1: Nếu dung dịch chỉ chứa 2 muối
A + 2HCl → ACl2 + H2
a → 2a → a
B + 2HCl → BCl2 + H2
a → 2a → a
nHCl = 0,2.1,25 = 0,25 mol
=> 4a = 0,25 => a = 0,0625 mol
${{\bar{M}}_{(A,B)}}=\frac{2,45}{2a}=19,6$ => MBe = 9 < 19,6 < MB
$19,6=\frac{9a+a.{{M}_{B}}}{2a}\,\,\to \,\,{{M}_{B}}=30,2$ (loại)
TH2: Dung dịch sau phản ứng chứa HCl dư
nHCl = nACl2 = nBCl2 = a
=> nHCl (ban đầu) = 0,25 = 4a + a = 5a => a = 0,05
${{\bar{M}}_{(A,B)}}=\frac{2,45}{2a}=24,5$
Nếu A là Be => MA = 9
Ta có: $24,5=\frac{9a+a.{{M}_{B}}}{2a}\,\,\to \,\,{{M}_{B}}=40\,\,(Ca)$
Vậy 2 kim loại là Be và Ca
Hoà tan hoàn toàn 5,85 gam bột kim loại M vào dung dịch HCl, thu được 7,28 lít khí H2 đktc. Kim loại M là
-
A.
Mg
-
B.
Al
-
C.
Zn
-
D.
Fe
Đáp án : B
Bảo toàn e
Ta có M → M+n + n e
2H+1 + 2e → H2
Bảo toàn e có
Chọn n= 3 và M= 27(Al)
Cho m (gam) hỗn hợp Al, Mg tác dụng với dung dịch HCl dư thu được 12,32 lít khí (đktc). Mặt khác, cũng m (gam) hỗn hợp trên cho tác dụng với dung dịch NaOH dư thu được 6,72 lít khí (đktc). Tính giá trị của m?
-
A.
28,2 gam.
-
B.
22,8 gam.
-
C.
14,1 gam.
-
D.
11,4 gam.
Đáp án : D
- Khi cho hỗn hợp trên tác dụng với NaOH dư thì chỉ có Al phản ứng. Từ số mol H2 suy ra số mol Al.
- Khi cho hỗn hợp trên tác dụng với HCl thì có Al và Mg đều phản ứng. Từ số mol H2 suy ra số mol Mg.
- Tính khối lượng của hỗn hợp.
- Khi cho hỗn hợp trên tác dụng với NaOH dư thì chỉ có Al phản ứng:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Ta có: \({n_{{H_2}}} = \frac{{6,72}}{{22,4}} = 0,3\left( {mol} \right)\)
→ nAl = 0,2 mol => mAl = 0,2 * 27 = 5,4 (gam)
- Khi cho hỗn hợp trên tác dụng với HCl thì có Al và Mg đều phản ứng:
Ta có: \({n_{{H_2}}} = \frac{{12,32}}{{22,4}} = 0,55\left( {mol} \right)\)
PTHH: Mg + 2HCl → MgCl2 + H2
0,25 ← 0,55 - 0,3 = 0,25 (mol)
→ mMg = 0,25. 24 = 6 (g)
Vậy m = mAl + mMg = 5,4 + 6 = 11,4 (g)
Hòa tan hoàn toàn 5,95 gam hỗn hợp hai kim loại Al và Zn bằng dung dịch H2SO4 loãng thì khối lượng dung dịch tăng 5,55 gam. Khối lượng Al và Zn (tính theo gam) trong hỗn hợp lần lượt là
-
A.
4,05 và 1,9.
-
B.
3,95 và 2,0.
-
C.
2,7 và 3,25.
-
D.
2,95 và 3,0.
Đáp án : C
Khối lượng dung dịch tăng là mdd tăng = mkim loại - mH2, từ đó tính được khối lượng H2.
Lập hệ phương trình về khối lượng hỗn hợp kim loại và khối lượng H2 để tính số mol mỗi kim loại trong hỗn hợp.
Khối lượng dung dịch tăng là mdd tăng = mkim loại - mH2 → mH2 =5,95 - 5,55 = 0,4 (g) → nH2 = 0,2 mol
Đặt số mol Al là x mol; số mol Zn là y mol. Ta có: mhh = 27x + 65y = 5,95 (g) (1)
Ta có: 2nH2 = 3nAl + 2nZn = 1,5x + y = 0,2 (mol) (2)
Giải hệ (1) và (2) ta có: x = 0,1 và y = 0,05
Vậy mAl = 0,1.27 = 2,7 gam và mZn = 0,05.65 = 3,25 (g)
Cho 5 gam hỗn hợp X gồm Ag và Al vào dung dịch HCl dư. Sau khi phản ứng xảy ra hoàn toàn, thu được 3,36 lít khí (đktc). Phần trăm khối lượng Ag trong X là
-
A.
46%
-
B.
50,2%
-
C.
54,0%
-
D.
49,8%
Đáp án : A
- Khi cho hỗn hợp Ag và Al vào HCl dư thì chỉ có Al phản ứng:
- Viết và tính theo PTHH: 2Al + 6HCl → 2AlCl3 + 3H2
\({n_{{H_2}}} = \frac{{3,36}}{{22,4}} = 0,15(mol)\)
Khi cho hỗn hợp Ag và Al vào HCl dư thì chỉ có Al phản ứng:
nAl = 2/3 nH2 = 0,1 mol
→ mAl = 0,1.27 = 2,7 gam
→ mAg = 5 - 2,7 = 2,3 gam
\( \to \% {m_{Ag}} = \frac{{2,3}}{5}.100\% = 46\% \)
Hòa tan hoàn toàn 1,9 gam hỗn hợp gồm Fe, Mg và Al bằng dung dịch H2SO4 loãng vừa đủ, thu được 1,344 lít H2 (đktc). Khối lượng muối khan thu được khi cô cạn dung dịch sau phản ứng là
-
A.
7,66 gam.
-
B.
7,78 gam.
-
C.
8,25 gam.
-
D.
7,72 gam.
Đáp án : A
Sơ đồ: KL + H2SO4 → Muối + H2
Bảo toàn nguyên tố H tính được số mol của H2SO4: nH2SO4 = nH2
Bảo toàn khối lượng tính được khối lượng của muối: mmuối = mKL + mH2SO4 - mH2
Sơ đồ: KL + H2SO4 → Muối + H2
Bảo toàn H → nH2SO4 = nH2 = 1,344/22,4 = 0,06 mol
Bảo toàn khối lượng → mmuối = mKL + mH2SO4 - mH2 = 1,9 + 0,06.98 - 0,06.2 = 7,66 gam
Ngâm một lá kim loại có khối lượng 50 gam trong dung dịch HCl, sau khi thu được 336 ml H2 (đktc) thì khối lượng lá kim loại giảm 1,68%. Xác định kim loại đã dùng.
-
A.
Fe
-
B.
Mg
-
C.
Zn
-
D.
Al
Đáp án : A
- Khối kim loại giảm là khối lượng kim loại phản ứng
- Gọi kim loại cần tìm là M có hóa trị x
- Số mol kim loại theo số mol hiđro → phương trình giữa M và x → Lập bảng tìm M và x.
Khối lượng kim loại giảm bằng khối lượng kim loại đã phản ứng bằng:
50.0,0168 = 0,84 (gam)
Đặt kim loại là M (hoá trị n), ta có PTHH:
2M + 2nH+ → 2Mn+ + nH2
\(\dfrac{{0,03}}{n}\) ← 0,015 (mol)
\(\to {M_M} = \dfrac{{0,84}}{ {0,03}}n = 28n\)
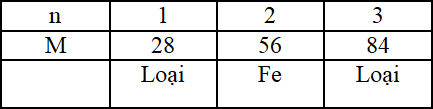
Lập bảng biện luận:
Cho hỗn hợp Fe và Zn tác dụng với dung dịch hỗn hợp chứa 0,01 mol HCl và 0,05 mol H2SO4. Sau phản ứng thu được chất rắn X, dung dịch Y và khí Z. Cho khí Z đi qua CuO dư, đun nóng thu được m gam Cu. Giá trị của m là
-
A.
5,32.
-
B.
3,52.
-
C.
2,35.
-
D.
2,53.
Đáp án : B
- Sau phản ứng thu được chất rắn → axit phản ứng hết
- BTNT "H" → số mol hiđro → số mol Cu
Sau phản ứng thu được chất rắn → axit phản ứng hết
BTNT "H" \(n_{H^+}=n_{HCl}+2n_{H_2SO_4}=2n_{H_2}=0,01+2\times0,05=0.11mol\)
→ \(n_{H_2}=0,055mol\)
\( CuO +H_2 \to Cu + H_2O\)
\(n_{Cu}=n_{H_2}=0,055mol\)
→ \(m_{Cu}=3,52g\)
Cho 8,85 g hỗn hợp Mg, Cu và Zn vào lượng dư dung dịch HCl thu được 3,36 lít H2 (đktc). Phần chất rắn không phản ứng với axit được rửa sạch rồi đốt cháy trong oxi tạo ta 4 g chất bột màu đen. Phần trăm khối lượng của Mg, Cu, Zn lần lượt là
-
A.
27,12%; 36,72%; 36,16%.
-
B.
36,16%; 36,72%; 27,12%.
-
C.
27,12%; 36,16%; 36,72%.
-
D.
36,16%; 27,12%; 36,72%.
Đáp án : C
- Chất rắn không phản ứng với axit là Cu, từ khối lượng oxit → khối lượng Cu → khối lượng Mg và Zn
- Từ số mol khí H2 và khối lượng Mg, Zn lập hệ phương trình số mol và khối lượng của Mg, Zn → số mol từng chất
- Tính % khối lượng từng chất.
\({n_{Cu}} = {n_{CuO}} = \frac{4}{{80}} = 0,05(mol) \to {m_{Cu}} = 0,05.64 = 3,2(g)\)
Đặt nMg = x và nZn = y mol
Ta có hệ phương trình: \(\left\{ \begin{array}{l}{m_{hh}} = 24x + 65y + 3,2 = 8,85\\{n_{{H_2}}} = x + y = 0,15\end{array} \right. \to \left\{ \begin{array}{l}x = 0,1\\y = 0,05\end{array} \right.\)
Vậy:
\(\% {m_{Mg}} = \frac{{0,1.24}}{{8,85}}.100\% = 27,12\% \)
\(\% {m_{Cu}} = \frac{{3,2}}{{8,85}}.100\% = 36,16\% \)
\(\% {m_{Zn}} = 100\% - 27,12\% - 36,16\% = 36,72\% \)
Nung nóng 2,13 gam hỗn hợp X gồm 3 kim loại Mg, Zn và Al ở dạng bột với oxi thu được hỗn hợp Y gồm các oxit có khối lượng 3,33 gam. Thể tích dung dịch HCl 1M vừa đủ để phản ứng hết với Y là
-
A.
150 ml.
-
B.
225 ml.
-
C.
100 ml.
-
D.
75 ml.
Đáp án : A
BTKL ta có: mX + mO2 = mOXIT → nO(oxit)=?
nHCl = nH+ = 2nO(oxit) = ?
BTKL ta có: mX + mO2 = mOXIT
→ 2,13 + mO2 = 3,33 → mO2 = 1,2 (g) → nO = 1,2 : 16 = 0,075 (mol)
Cho Y phản ứng với HCl bản chất xảy ra phản ứng:
O2- + 2H+ → H2O
0,075 →0,15 (mol)
→ nHCl = nH+ = 0,15 (mol) → VHCl = n : V = 0,15 : 1 = 0,15 (lít) = 150 (ml)
Luyện tập và củng cố kiến thức Bài 18. Kim loại tác dụng với axit có tính oxi hóa (phần 1) Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 18. Kim loại tác dụng với axit có tính oxi hóa (phần 2) Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 18. Dãy điện hóa kim loại Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 20. Ăn mòn kim loại Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Điều chế kim loại Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 22. Kim loại tác dụng với dung dịch muối (phần 1) Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 22. Kim loại tác dụng với dung dịch muối (phần 2) Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 22. Sự điện phân Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập sự điện phân 1 muối Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập điện phân hỗn hợp muối Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập nhiệt luyện Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập điện phân hay và khó Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập kim loại tác dụng với dung dịch muối hay và khó Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Ôn tập chương 5 Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 17. Lý thuyết chung về kim loại Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết









