Lý thuyết Cân bằng trong dung dịch nước - Hóa học 11 - Chân trời sáng tạo
- Sự điện li là quá trình phân li các chất trong nước tạo thành ion. - Chất điện li là những chất khi tan trong nước phân li ra các ion.
I. Sự điện li, chất điện li, chất không điện li
1. Hiện tượng điện li
- Sự điện li là quá trình phân li các chất trong nước tạo thành ion.
- Chất điện li là những chất khi tan trong nước phân li ra các ion.
2. Chất điện li
a, Chất điện li và không điện li
- Chất điện li là những chất tan trong nước phân li ra các ion. VD: hydrochloric acid, sodium hydroxide, ..
- Chất không điện li là chất không phân li ra các ion. VD: saccarose, ethanol….
b, Chất điện li mạnh và chất điện li yếu
- Chất điện li mạnh là chất khi tan trong nước, hầu hết các phân tử chất tan đều phân li ra ion. Thường gặp là:
+ Các acid mạnh: HCl, H2SO4, HNO3…
+ Các base mạnh: NaOH, KOH, Ca(OH)2, Ba(OH)2…
+ Hầu hết các muối.
Phản ứng: Một chiều.
Biểu diễn: Mũi tên một chiều (→).
VD: HNO3 → H+ + NO3-.
- Chất điện li yếu là chất khi tan trong nước chỉ có một phần phân tử chất tan phân li ra ion. Thường gặp là:
+ Các acid yếu: CH3COOH, HClO, HF, H2SO3…
+ Base yếu: Cu(OH)2, Fe(OH)2…
Phản ứng: Thuận nghịch.
Biểu diễn: Hai nửa mũi tên ngược nhau ()
VD: CH3COOH CH3COO- + H+.
II. Thuyết Bronsted – Lowry về acid-base.
1. Khái niệm acid – base theo thuyết Bronsted – Lowry.
- Acid là chất cho proton (H+).
- Base là chất nhận proton (H+).
2. Ưu điểm của thuyết Bronsted – Lowry.
Tổng quát hơn thuyết Arhenius. (Phân tử không có nhóm –OH như NH3 hay CO3- cũng là base).
III. Khái niệm pH , chất chỉ thị acid-base.
1. Khái niệm pH
|
pH = -lg[H+] hoặc [H+] = 10-pH
|
với [H+] là nồng độ mol của ion H+.
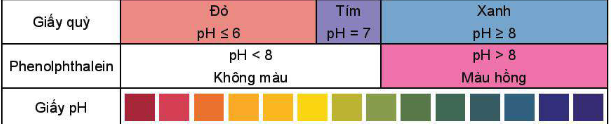
- Môi trường acid có pH < 7.
- Môi trường base có pH > 7.
- Môi trường trung tính có pH = 7.

2. Xác định pH
- Sử dụng máy đo pH.
- Màu giấy pH, giấy quỳ và phenolphtalein:
IV. Chuẩn độ acid – base
Nguyên tắc: Chuẩn độ là phương pháp xác định nồng độ của một chất bằng một dung dịch chuẩn đã biết nồng độ.
V. Sự thủy phân của các ion
- Phản ứng thủy phân là phản ứng giữa ion với nước tạo ra các dung dịch có môi trường khác nhau.
VD: Dung dịch Na2CO3: Na+ không bị thủy phân, CO32- thủy phân trong nước tạo OH-:
CO32- + H2O HCO3- + OH-
Vì vậy Na2CO3 có môi trường base.
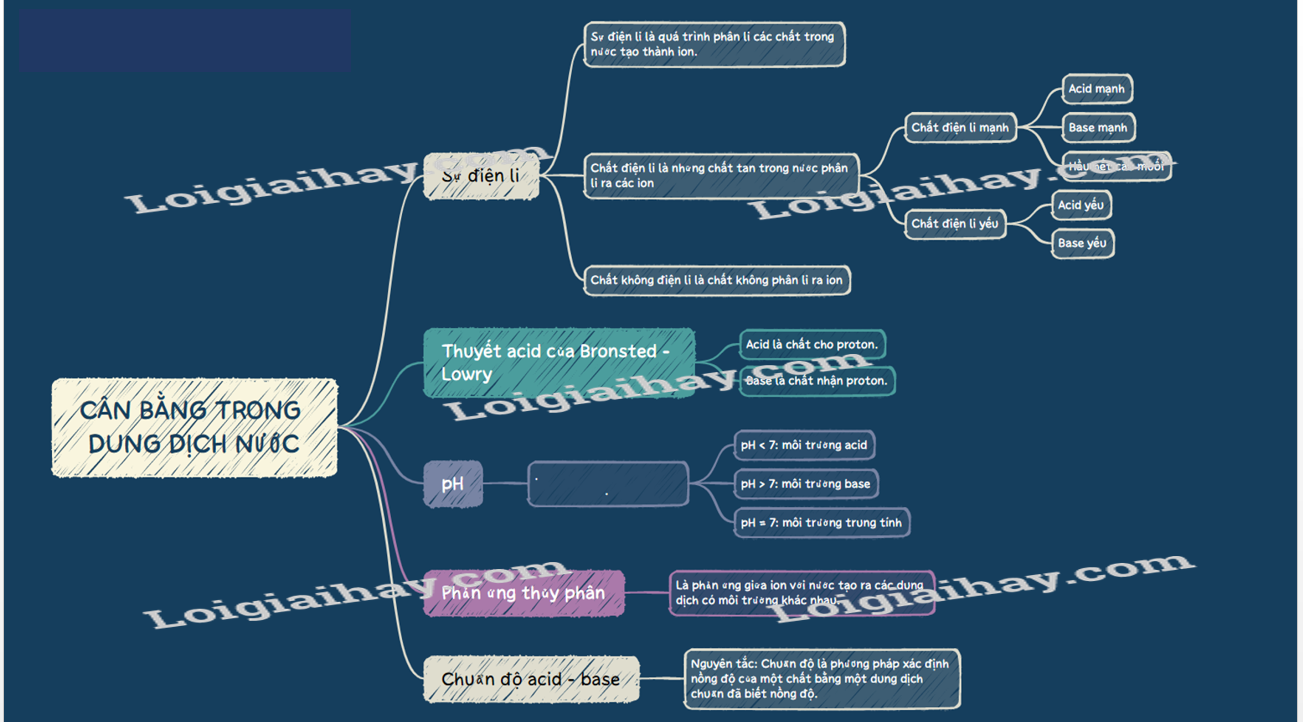
SƠ ĐỒ TƯ DUY
Luyện Bài Tập Trắc nghiệm Hóa 11 - Chân trời sáng tạo - Xem ngay
Các bài khác cùng chuyên mục
- Bài 19: Carboxylic acid trang 124, 125, 126, 127, 128, 129, 130, 131, 132 Hóa học 11 Chân trời sáng tạo
- Bài 18: Hợp chất carbonyl trang 115, 116, 117, 118, 119, 120, 121, 122, 123 Hóa học 11 Chân trời sáng tạo
- Bài 17: Phenol trang 108, 109, 110, 111, 112, 113, 114 Hóa học 11 Chân trời sáng tạo
- Bài 16: Alcohol trang 99, 100, 101, 102, 103, 104, 105, 106, 107 Hóa học 11 Chân trời sáng tạo
- Bài 15: Dẫn xuất halogen trang 92, 93, 94, 95, 96, 97, 98 Hóa học 11 Chân trời sáng tạo
- Bài 19: Carboxylic acid trang 124, 125, 126, 127, 128, 129, 130, 131, 132 Hóa học 11 Chân trời sáng tạo
- Bài 18: Hợp chất carbonyl trang 115, 116, 117, 118, 119, 120, 121, 122, 123 Hóa học 11 Chân trời sáng tạo
- Bài 17: Phenol trang 108, 109, 110, 111, 112, 113, 114 Hóa học 11 Chân trời sáng tạo
- Bài 16: Alcohol trang 99, 100, 101, 102, 103, 104, 105, 106, 107 Hóa học 11 Chân trời sáng tạo
- Bài 15: Dẫn xuất halogen trang 92, 93, 94, 95, 96, 97, 98 Hóa học 11 Chân trời sáng tạo












Danh sách bình luận