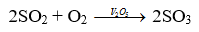Bài 20. Ôn tập chương 6 trang 60, 61, 62 SBT Hóa 10 Kết nối tri thức với cuộc sống
Yếu sau đây không ảnh hưởng đến tốc độ phản ứng trên? Cho Zn phản ứng với HCl để điều chế hydrogen. Hãy nêu cách để tăng tốc độ phản ứng này.
Tổng hợp đề thi học kì 1 lớp 10 tất cả các môn - Kết nối tri thức
Toán - Văn - Anh - Lí - Hóa - Sinh - Sử - Địa...
Nhận biết 20.1
Cho phản ứng hóa học sau:
C(s) + O2(g) → CO2(g)
Yếu sau đây không ảnh hưởng đến tốc độ phản ứng trên?
A. Nhiệt độ.
B. Áp suất O2.
C. Hàm lượng carbon.
D. Diện tích bề mặt carbon.
Lời giải chi tiết:
- Đáp án: C
- Giải thích:
+ Hàm lượng carbon chỉ ảnh hưởng đến lượng chất sản phẩm sinh ra chứ không ảnh hưởng đến tốc độ phản ứng
+ Hàm lượng carbon lớn nhưng diện tích tiếp xúc không đủ nhiều thì cũng không ảnh hưởng đến tốc độ phản ứng
Nhận biết 20.2
Cho Zn phản ứng với HCl để điều chế hydrogen. Hãy nêu cách để tăng tốc độ phản ứng này.
Phương pháp giải:
Dựa vào sự ảnh hưởng của các yếu tố đến tốc độ phản ứng:
- Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng
- Khi tăng nhiệt độ, tốc độ phản ứng tăng
- Khi tăng áp suất (đối với phản ứng có chất khí), tốc độ phản ứng tăng
- Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng
- Chất xúc tác làm tăng tốc độ của phản ứng hóa học (cụ thể là làm giảm năng lượng hoạt hóa của phản ứng) nhưng vẫn bảo toàn về chất và lượng khi phản ứng kết thúc
Lời giải chi tiết:
- Cách 1: Tăng nhiệt độ bằng cách đun nóng bình phản ứng
- Cách 2: Tăng nồng độ (dùng dung dịch HCl đặc)
- Cách 3: Tăng diện tích bề mặt của miếng kẽm (zinc)
Nhận biết 20.3
Khí oxygen được điều chế trong phòng thí nghiệm bằng cách nhiệt phân potassium chlorate. Để thí nghiệm thành công và rút ngắn thời gian tiến hành có thể dùng một số biện pháp sau:
(1) Dùng chất xúc tác manganese dioxide.
(2) Nung ở nhiệt độ cao.
(3) Dùng phương pháp dời nước để thu khí oxygen.
(4) Đập nhỏ potassium chlorate.
(5) Trộn đều bột potassium chlorate và xúc tác.
Số biện pháp dùng để tăng tốc độ phản ứng
A. 2.
B. 3.
C. 4.
D. 5.
Phương pháp giải:
Dựa vào sự ảnh hưởng của các yếu tố đến tốc độ phản ứng:
- Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng
- Khi tăng nhiệt độ, tốc độ phản ứng tăng
- Khi tăng áp suất (đối với phản ứng có chất khí), tốc độ phản ứng tăng
- Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng
- Chất xúc tác làm tăng tốc độ của phản ứng hóa học (cụ thể là làm giảm năng lượng hoạt hóa của phản ứng) nhưng vẫn bảo toàn về chất và lượng khi phản ứng kết thúc
Lời giải chi tiết:
- Các biện pháp làm tăng tốc độ phản ứng là (1), (2), (4) và (5) → Đáp án: C
- Biện pháp (3) chỉ mô tả cách thu khí oxygen
Nhận biết 20.4
Phát biểu nào sau đây không đúng?
A. Nhiên liệu cháy ở trên vùng cao nhanh hơn khi cháy ở vùng thấp.
B. Thực phẩm được bảo quản ở nhiệt độ thấp hơn sẽ giữ được lâu hơn.
C. Dùng men làm chất xúc tác để chuyển hoá cơm nếp thành rượu.
D. Nếu không cho nước dưa chua khi muối dưa thì dưa vẫn sẽ chua nhưng chậm hơn.
Phương pháp giải:
Dựa vào sự ảnh hưởng của các yếu tố đến tốc độ phản ứng:
- Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng
- Khi tăng nhiệt độ, tốc độ phản ứng tăng
- Khi tăng áp suất (đối với phản ứng có chất khí), tốc độ phản ứng tăng
- Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng
- Chất xúc tác làm tăng tốc độ của phản ứng hóa học (cụ thể là làm giảm năng lượng hoạt hóa của phản ứng) nhưng vẫn bảo toàn về chất và lượng khi phản ứng kết thúc
Lời giải chi tiết:
- Đáp án: A
- Giải thích: Nhiệt độ vùng cao thấp hơn nhiệt độ ở vùng thấp → Nhiên liệu ở vùng cao cháy chậm hơn
Nhận biết 20.5
Trong quy trình sản xuất sulfuric acid, xảy ra phản ứng hóa học sau:
Phát biểu nào sau đây không đúng?
A. Khi tăng áp suất khí SO2 hay O2 thì tốc độ phản ứng đều tăng lên.
B. Tăng diện tích bề mặt của xúc tác V2O5 sẽ làm tăng tốc độ phản ứng.
C. Xúc tác sẽ dần chuyển hoá thành chất khác nhưng khối lượng không đổi.
D. Cần làm nóng bình phản ứng để đẩy nhanh tốc độ phản ứng.
Phương pháp giải:
Dựa vào sự ảnh hưởng của các yếu tố đến tốc độ phản ứng:
- Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng
- Khi tăng nhiệt độ, tốc độ phản ứng tăng
- Khi tăng áp suất (đối với phản ứng có chất khí), tốc độ phản ứng tăng
- Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng
- Chất xúc tác làm tăng tốc độ của phản ứng hóa học (cụ thể là làm giảm năng lượng hoạt hóa của phản ứng) nhưng vẫn bảo toàn về chất và lượng khi phản ứng kết thúc
Lời giải chi tiết:
- Đáp án: C
- Giải thích: Chất xúc tác làm tăng tốc độ của phản ứng hóa học (cụ thể là làm giảm năng lượng hoạt hóa của phản ứng) nhưng vẫn bảo toàn về chất và lượng khi phản ứng kết thúc
Thông hiểu 20.6
Khi để ở nhiệt độ 30 °C, một quả táo bị hư sau 3 ngày. Khi được bảo quản ở 0 °C (trong tủ lạnh), quả táo đỏ bị hư sau 24 ngày.
a) Hãy tính hệ số nhiệt độ của phản ứng xảy ra khi quả táo bị hư.
b) Nếu bảo quản ở 20 °C, quả táo sẽ bị hư sau bao nhiêu ngày?
Phương pháp giải:
Dựa vào biểu thức tính hệ số nhiệt độ γ của phản ứng
\(\gamma = \frac{{{V_{T + 10}}}}{{{V_T}}}\)hoặc\({\gamma ^{\frac{{\Delta T}}{{10}}}} = \frac{{{V_1}}}{{{V_2}}} = \frac{{{t_2}}}{{{t_1}}}\)
Trong đó:
+ VT là tốc độ phản ứng tại nhiệt độ T
+ VT + 10 là tốc độ phản ứng tại nhiệt độ T + 10
- Tốc độ phản ứng tỉ lệ nghịch với thời gian
Lời giải chi tiết:
a) Vì tốc độ phản ứng tỉ lệ nghịch với thời gian
→ Tốc độ phản ứng tăng gấp \(\frac{{24}}{3} = 8\)lần → \({\gamma ^{\frac{{30 - 0}}{{10}}}} = \frac{{24}}{3} = 8\)→ \(\gamma = 2\)
b) Có \({2^{\frac{{30 - 20}}{{10}}}} = \frac{{{t_2}}}{3}\)→ \({t_2} = 2.3 = 6\)ngày
Thông hiểu 20.7
Cho biết những phát biểu sau đây là đúng hay sai. Giải thích.
(1) Để phản ứng hoá học xảy ra, các hạt (phân tử, nguyên tử, ion) của chất phản ứng phải va chạm với nhau.
(2) Khi áp suất khí CO tăng, tốc độ phản ứng 4CO + Fe3O4 → 4CO2 + 3Fe tăng lên.
(3) Khi tăng nhiệt độ lên 10 oC, tốc độ của các phản ứng hoá học đều tăng gấp đôi.
(4) Nếu năng lượng va chạm giữa hai phân tử chất phản ứng nhỏ hơn năng lượng hoạt hóa thì sẽ gây ra phản ứng hoá học.
(5) Phản ứng có năng lượng hoạt hoá càng thấp thì xảy ra càng nhanh.
Lời giải chi tiết:
(1) Sai vì các hạt (phân tử, nguyên tử, ion) của chất phản ứng phải va chạm hiệu quả với nhau mới xảy ra phản ứng
(2) Đúng vì phản ứng có chất khí là CO
(3) Sai vì tốc độ phản ứng tăng hay giảm bao nhiêu lần phụ thuộc vào hệ số nhiệt độ γ
(4) Sai vì năng lượng va chạm giữa hai phân tử chất phản ứng phải cao hơn năng lượng hoạt hóa mới gây ra phản ứng hoá học.
(5) Đúng
Thông hiểu 20.8
Ở 225 °C, khí NO2 và O2 có phản ứng sau:
2NO + O2 → 2NO2
Biểu thức tốc độ phản ứng có dạng: \(v = k.C_{NO}^2.C_{{O_2}}^{}\)
Cho biết tốc độ phản ứng sẽ thay đổi như thế nào nếu:
(i) Tăng nồng độ NO lên 2 lần.
(ii) Giảm nồng độ O2 đi 3 lần.
(iii) Tăng nồng độ NO2 lên 2 lần.
Lời giải chi tiết:
Dựa theo biểu thức tốc độ tức thời ta có: \(v = k.C_{NO}^2.C_{{O_2}}^{}\)
- Khi nồng độ NO tăng 2 lần ta có: \(v' = k.{(2.C_{NO}^{})^2}.C_{{O_2}}^{}\) → \(v' = 4v\)
→ Tốc độ phản ứng tăng 4 lần
- Khi nồng độ O2 giảm 3 lần ta có: \(v' = k.C{_{NO}^2^{}}.{(\frac{1}{3}.C_{{O_2}}^{})^1}\) → \(v' = \frac{1}{3}v\)
→ Tốc độ phản ứng giảm 3 lần
- Khi nồng độ NO2 tăng 2 lần → Tốc độ phản ứng không thay đổi
Vận dụng 20.9
Phản ứng phân huỷ ethyl iodide trong pha khí xảy ra như sau:
C2H5I → C2H4 + HI
Ở 127 °C, hằng số tốc độ của phản ứng là 1,60.10-7s-1; ở 227°C là 4,25.10-4s-1
a) Hãy tính hệ số nhiệt độ của phản ứng trên.
b) Tính hằng số tốc độ của phản ứng ở 167 °C.
Phương pháp giải:
Dựa vào biểu thức tính hệ số nhiệt độ γ của phản ứng
\(\gamma = \frac{{{V_{T + 10}}}}{{{V_T}}}\)hoặc\({\gamma ^{\frac{{\Delta T}}{{10}}}} = \frac{{{V_1}}}{{{V_2}}} = \frac{{{t_2}}}{{{t_1}}}\)
Trong đó:
+ VT là tốc độ phản ứng tại nhiệt độ T
+ VT + 10 là tốc độ phản ứng tại nhiệt độ T + 10
Lời giải chi tiết:
a) Hằng số nhiệt độ là\({\gamma ^{\frac{{227 - 127}}{{10}}}} = \frac{{4,{{25.10}^{ - 4}}}}{{1,{{60.10}^{ - 7}}}}\) → \(\gamma = 2,2\)
b) Ở nhiệt độ 167 °C có: \(2,{2^{\frac{{167 - 127}}{{10}}}} = \frac{{{V_1}}}{{1,{{60.10}^{ - 7}}}}\)
→ Hằng số tốc độ của phản ứng ở 167 °C là \({V_1} = 2,{2^{\frac{{167 - 127}}{{10}}}}.1,{60.10^{ - 7}} = 3,{75.10^{ - 6}}\)
Vận dụng 20.10
Ở vùng đồng bằng (độ cao gần mực nước biển), nước sôi ở 100 °C. Trên đỉnh núi Fansipan (cao 3200 m so với mực nước biển), nước sôi ở 90 °C. Khi luộc chín một miếng thịt trong nước sôi, ở vùng đồng bằng mất 3,2 phút, trong khi đó trên đỉnh Fansipan mất 3,8 phút.
a) Tính hệ số nhiệt độ của phản ứng làm chín miếng thịt trên.
b) Nếu luộc miếng thịt trên đỉnh núi cao hơn, tại đó nước sôi ở 80 °C thì mất bao lâu để luộc chín miếng thịt?
Phương pháp giải:
: Dựa vào biểu thức tính hệ số nhiệt độ γ của phản ứng
\(\gamma = \frac{{{V_{T + 10}}}}{{{V_T}}}\)hoặc\({\gamma ^{\frac{{\Delta T}}{{10}}}} = \frac{{{V_1}}}{{{V_2}}} = \frac{{{t_2}}}{{{t_1}}}\)
Trong đó:
+ VT là tốc độ phản ứng tại nhiệt độ T
+ VT + 10 là tốc độ phản ứng tại nhiệt độ T + 10
Lời giải chi tiết:
a) Hằng số nhiệt độ là\({\gamma ^{\frac{{100 - 90}}{{10}}}} = \frac{{3,8}}{{3,2}}\) → \(\gamma = 1,1875\)
b) Ở nhiệt độ 80 °C có là \(1,{1875^{\frac{{90 - 80}}{{10}}}} = \frac{{{V_1}}}{{3,8}}\)
→ Thời gian cần luộc chín miếng thịt ở 80 °C là \({V_1} = 1,{1875^{\frac{{90 - 80}}{{10}}}}.3,8 = 4,5125\)(min)
Vận dụng 20.11
Chất độc màu da cam dioxin gây tác hại vô cùng nghiêm trọng đối với môi trường và sức khoẻ con người. Nó phân huỷ vô cũng chậm trong đất. Nghiên cứu cho thấy phải mất tám năm để lượng dioxin trong đất giảm đi một nửa. Nếu một mảnh đất có chứa 0,128 mg dioxin thì sau bao lâu lượng dioxin còn lại là 10-6g dioxin?
Lời giải chi tiết:
- Từ 0,128.10-3g dioxin phân hủy còn 10-6g dioxin đã giảm đi: \(\frac{{0,{{128.10}^{ - 3}}}}{{{{10}^{ - 6}}}} = 128 = {2^7}\)lần
→ Thời gian cần thiết để phân hủy 0,128.10-3g dioxin phân hủy còn 10-6g dioxin là:
8.7 = 56 năm
Vận dụng 20.12
Phản ứng phân huỷ một loại hoạt chất kháng sinh có hệ số nhiệt độ là 2,5. Ở 27 °C, sau 10 giờ thì lượng hoạt chất giảm đi một nửa.
a) Khi đưa vào cơ thể người (37 °C) thì lượng hoạt chất giảm đi một nửa sau bao lâu?
b) Sau bao lâu thì hoạt chất kháng sinh này trong cơ thể người còn lại 12,5% so với ban đầu?
Phương pháp giải:
Dựa vào biểu thức tính hệ số nhiệt độ γ của phản ứng
\(\gamma = \frac{{{V_{T + 10}}}}{{{V_T}}}\)hoặc\({\gamma ^{\frac{{\Delta T}}{{10}}}} = \frac{{{V_1}}}{{{V_2}}} = \frac{{{t_2}}}{{{t_1}}}\)
Trong đó:
+ VT là tốc độ phản ứng tại nhiệt độ T
+ VT + 10 là tốc độ phản ứng tại nhiệt độ T + 10
Lời giải chi tiết:
a) - Có \(2,{5^{\frac{{37 - 27}}{{10}}}} = \frac{{10}}{{{t_1}}}\)
→ Ở 37 oC, lượng hoạt chất giảm đi một nửa sau: \({t_1} = \frac{{10}}{{2,5}} = 4\)giờ
b) Chất kháng sinh còn lại 12,5% tức là đã giảm đi: \(\frac{{100}}{{12,5}} = 8 = {2^3}\)lần
→ Thời gian cần thiết để chất kháng sinh còn lại 12,5% trong cơ thể người là:
4.3 = 12 giờ
Luyện Bài Tập Trắc nghiệm Hóa 10 - Kết nối tri thức - Xem ngay
Các bài khác cùng chuyên mục
- Bài 23. Ôn tập chương 7 trang 71, 72, 73 SBT Hóa 10 Kết nối tri thức với cuộc sống
- Bài 22. Hydrogen Halide. Muối halide trang 68, 69, 70 SBT Hóa 10 Kết nối tri thức với cuộc sống
- Bài 21. Nhóm Halogen trang 65, 66, 67 SBT Hóa 10 Kết nối tri thức với cuộc sống
- Bài 20. Ôn tập chương 6 trang 60, 61, 62 SBT Hóa 10 Kết nối tri thức với cuộc sống
- Bài 19. Tốc độ phản ứng trang 53, 54, 55 SBT Hóa 10 Kết nối tri thức với cuộc sống
- Bài 23. Ôn tập chương 7 trang 71, 72, 73 SBT Hóa 10 Kết nối tri thức với cuộc sống
- Bài 22. Hydrogen Halide. Muối halide trang 68, 69, 70 SBT Hóa 10 Kết nối tri thức với cuộc sống
- Bài 21. Nhóm Halogen trang 65, 66, 67 SBT Hóa 10 Kết nối tri thức với cuộc sống
- Bài 20. Ôn tập chương 6 trang 60, 61, 62 SBT Hóa 10 Kết nối tri thức với cuộc sống
- Bài 19. Tốc độ phản ứng trang 53, 54, 55 SBT Hóa 10 Kết nối tri thức với cuộc sống