Bài 11. Liên kết cộng hóa trị trang 30, 31, 32 SBT Hóa 10 Cánh diều
Trong nguyên tử C, những electron có khả năng tham gia hình thành liên kết cộng hoá trị thuộc phân lớp nào sau đây? Liên kết cộng hoá trị thường được hình thành giữa
CH tr 30 11.1
Trong nguyên tử C, những electron có khả năng tham gia hình thành liên kết cộng hoá trị thuộc phân lớp nào sau đây?
A. 1s. B. 2s. C. 2s, 2p. D. 1s, 2s, 2p.
Phương pháp giải:
Dựa vào các electron ở lớp ngoài cùng có khả năng tham gia hình thành liên kết cộng hóa trị
Lời giải chi tiết:
- Cấu hình electron của C là: 1s22s22p2
→ Đáp án: C
CH tr 30 11.2
Những phát biểu nào sau đây là không đúng?
A. Các nguyên tử liên kết với nhau theo xu hướng tạo hệ bền vững hơn.
B. Các nguyên tử liên kết với nhau theo xu hướng tạo hệ có năng lượng thấp hơn.
C. Các nguyên tử liên kết với nhau theo xu hướng tạo lớp vỏ electron được octet.
D. Các nguyên tử liên kết với nhau theo xu hướng tạo hệ có năng lượng cao hơn.
E. Các nguyên tử nguyên tố phi kim chỉ liên kết với các nguyên tử nguyên tố kim loại.
Lời giải chi tiết:
- Đáp án: D và E
Ch tr 30 11.3
Liên kết cộng hoá trị thường được hình thành giữa
A. các nguyên tử nguyên tố kim loại với nhau.
B. các nguyên tử nguyên tố phi kim với nhau.
C. các nguyên tử nguyên tố kim loại với các nguyên tử nguyên tố phi kim.
D. các nguyên tử khí hiếm với nhau.
Phương pháp giải:
Dựa vào liên kết cộng hóa trị xảy ra giữa các nguyên tố giống hoặc gần giống nhau về mặt bản chất hóa học
Lời giải chi tiết:
- Đáp án: B
CH tr 30 11.4
Số lượng cặp electron dùng chung trong các phân tử H2, O2, N2, F2 lần lượt là:
A. 1, 2, 3, 4.
B. 1, 2, 3, 1.
C. 2, 2, 2, 2.
D. 1, 2, 2, 1.
Phương pháp giải:
Dựa vào nguyên tử có bao nhiêu electron độc thân → tạo thành số lượng cặp electron dùng chung bấy nhiêu
Lời giải chi tiết:
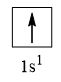
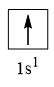
- Nguyên tử hydrogen có 1 electron
→ Cấu hình electron của nguyên tử H là: 1s1
→ Cấu hình electron lớp ngoài cùng của nguyên tử H theo ô lượng tử là:
→ Số electron độc thân: 1e
→ Số lượng cặp electron dùng chung trong các phân tử H2 là 1
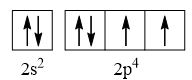
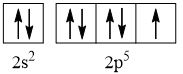
- Nguyên tử oxygen có 8 electron
→ Cấu hình electron của nguyên tử O là: 1s22s22p4
→ Cấu hình electron lớp ngoài cùng của nguyên tử O theo ô lượng tử là:
→ Số electron độc thân: 2e
→ Số lượng cặp electron dùng chung trong các phân tử O2 là 2
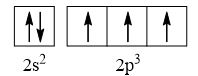
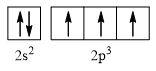
- Nguyên tử nitrogen có 7 electron
→ Cấu hình electron của nguyên tử N là: 1s22s22p3
→ Cấu hình electron lớp ngoài cùng của nguyên tử N theo ô lượng tử là:
→ Số electron độc thân: 3e
→ Số lượng cặp electron dùng chung trong các phân tử N2 là 3
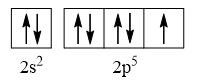
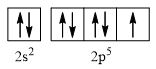
- Nguyên tử fluorine có 9 electron
→ Cấu hình electron của nguyên tử F là: 1s22s22p5
→ Cấu hình electron lớp ngoài cùng của nguyên tử F theo ô lượng tử là:
→ Số electron độc thân: 1e
→ Số lượng cặp electron dùng chung trong các phân tử F2 là 1
→ Đáp án: B
CH tr 30 11.5
Trong phân tử HF, số cặp electron dùng chung và cặp electron hoá trị riêng của nguyên tử F lần lượt là:
A. 1 và 3.
B. 2 và 2.
C. 3 và 1.
D. 1 và 4
Phương pháp giải:
Dựa vào
- Nguyên tử có bao nhiêu electron độc thân → tạo thành số lượng cặp electron dùng chung bấy nhiêu
- Cặp electron hóa trị là đôi electron ở lớp ngoài cùng chưa tham gia liên kết của nguyên tử
Lời giải chi tiết:
- Nguyên tử hydrogen có 1 electron
→ Cấu hình electron của nguyên tử H là: 1s1
→ Cấu hình electron lớp ngoài cùng của nguyên tử H theo ô lượng tử là:
→ Số electron độc thân: 1e
- Nguyên tử fluorine có 9 electron
→ Cấu hình electron của nguyên tử F là: 1s22s22p5
→ Cấu hình electron lớp ngoài cùng của nguyên tử F theo ô lượng tử là:
→ Số electron độc thân: 1e
→ Hydrogen và fluorine sẽ góp chung 1 electron để tạo thành cặp electron dùng chung trong phân tử HF
→ Số lượng cặp electron chưa liên kết trong nguyên tử F là 3
→ Đáp án: A
CH tr 30 11.6
Cho công thức Lewis của các phân tử sau:
Số phân tử mà nguyên tử trung tâm không thỏa mãn quy tắc octet là
A. 1. B. 2. C. 3. D. 4.
Phương pháp giải:
Dựa vào số lượng các electron hóa trị chưa liên kết và số liên kết các nguyên tử đang có, mỗi liên kết tương ứng với 2 electron
Lời giải chi tiết:
- Đáp án: B
- Giải thích:
+ Nguyên tố B chỉ có 3 liên kết cộng hóa trị → Có 6 electron lớp ngoài cùng
+ Nguyên tố Be chỉ có 2 liên kết cộng hóa trị → Có 4 electron lớp ngoài cùng
CH tr 31 11.7
Công thức nào sau đây ứng với công thức Lewis của phân tử PCl3
A. Công thức (1). B. Công thức (2).
C. Công thức (3). D. Công thức (4).
E. Công thức (2) và (4).
Phương pháp giải:
Dựa vào số lượng các electron hóa trị chưa liên kết và số liên kết các nguyên tử đang có, mỗi liên kết tương ứng với 2 electron
Lời giải chi tiết:
- Đáp án: B
- Giải thích: Nguyên tử P trong đáp án B có 3 liên kết và 1 cặp electron chưa liên kết → Có 2.3 + 2 = 8 electron ở lớp ngoài cùng
CH tr 31 11.8
Dựa vào hiệu độ âm điện giữa hai nguyên tố, cho biết liên kết trong phân tử nào sau đây là phân cực nhất.
A. HF. B. HCl. C. HBr. D. HI.
Phương pháp giải:
Dựa vào
- Hiệu độ âm điện càng lớn → liên kết trong phân tử càng phân cực
- Do đều liên kết với hydrogen →so sánh độ âm điện của các nguyên tố còn lại để rút ra kết luận
Lời giải chi tiết:
- Chiều tăng dần độ âm điện của các nguyên tố liên kết với hydrogen trong các đáp án trên là: I < Br < Cl < F
→ Đáp án: A
CH tr 31 11.9
Hãy điền từ/ công thức thích hợp vào chỗ trống trong đoạn thông tin sau:
Trong số các hợp chất: Cl2, H2O, O2, CsF, NaF, SO2, có ...(1)... chất ion và ...(2)... chất cộng hoá trị. Trong điều kiện thường, ...(3)... hợp chất tồn tại thể rắn là ...(4)... và ...(5)...; ...(6)… hợp chất tồn tại ở thể lỏng là ...(7)..., còn lại là các chất khí. Chất có nhiệt độ sôi, nhiệt độ nóng chảy cao nhất là ...(8)... Trong số các chất cộng hoá trị, ...(9)..., ...(10)... là các chất cộng hoá trị phân cực; ...(11)... và ...(12)... là các chất cộng hoá trị không phân cực.
Lời giải chi tiết:
(1) hai (2) bốn (3) hai (4) CsF (5) NaF (6) một
(7) H2O (8) NaF (9) H2O (10) SO2 (11) Cl2 (12) O2
CH tr 31 11.10
Dựa vào hiệu độ âm điện, hãy nối các liên kết hình thành giữa các nguyên tử cột A với loại liên kết tương ứng ở cột B.
|
Cột A |
Cột B |
|
a) Sr và F |
1. liên kết cộng hóa trị phân cực |
|
b) N và Cl |
2. liên kết cộng hóa trị không phân cực |
|
c) N và O |
3. liên kết ion |
Phương pháp giải:
|
Hiệu độ âm điện (\(\Delta \chi \)) |
Loại liên kết |
|
\(0 \le \Delta \chi < 0,4\) |
Cộng hóa trị không phân cực |
|
\(0,4 \le \Delta \chi < 1,7\) |
Cộng hóa trị phân cực |
|
\(\Delta \chi \ge 1,7\) |
Ion |
Lời giải chi tiết:
|
|
Liên kết giữa Sr và F |
Liên kết giữa N và Cl |
|
Hiệu độ âm điện (\(\Delta \chi \)) |
- Liên kết Sr và F có \(\Delta \chi \) = 3,98 - 0,95= 3,03 → Liên kết ion |
- Liên kết N và Cl có \(\Delta \chi \) = 3,16 - 3,04 = 0,12 → Liên kết cộng hóa trị không phân cực |
|
|
Liên kết giữa N và O |
|
|
Hiệu độ âm điện (\(\Delta \chi \)) |
- Liên kết N và O có \(\Delta \chi \) = 3,44 - 3,04 = 0,4 → Liên kết cộng hóa trị phân cực |
|
→ Đáp án: a - 3, b - 2, c - 1
CH tr 31 11.11
Khi tham gia hình thành liên kết trong các phân tử HF, F2; orbital tham gia xen phủ tạo liên kết của nguyên tử F thuộc về phân lớp nào, có hình dạng gì?
A. Phân lớp 2s, hình cầu.
B. Phân lớp 2s, hình số tám nổi.
C. Phân lớp 2p, hình số tám nổi.
D. Phân lớp 2p, hình cánh hoa.
Phương pháp giải:
- Bước 1: Viết cấu hình electron của nguyên tử nitrogen
- Bước 2: Viết cấu hình electron lớp ngoài cùng theo ô lượng tử
- Bước 3: Xác định các electron độc thân sẽ tham gia xen phủ thuộc orbital nào
Lời giải chi tiết:
- Nguyên tử fluorine có 9 electron
→ Cấu hình electron của nguyên tử F là: 1s22s22p5
→ Cấu hình electron lớp ngoài cùng của nguyên tử F theo ô lượng tử là:
→ Như vậy 1 orbital p tham gia xen phủ để tạo 1 cặp electron dùng chung trong công thức phân tử HF hoặc F2. Orbital p có hình số tám nổi
→ Đáp án: C
Ch tr 31 11.12
Số orbital của cả hai nguyên tử N tham gia xen phủ tạo liên kết trong phân tử N2 là
A. 3. B. 4. C. 5. D. 6.
Phương pháp giải:
- Bước 1: Viết cấu hình electron của nguyên tử nitrogen
- Bước 2: Viết cấu hình electron lớp ngoài cùng theo ô lượng tử
- Bước 3: Xác định các electron độc thân sẽ tham gia xen phủ thuộc orbital nào
Lời giải chi tiết:
- Nguyên tử nitrogen có 7 electron
→ Cấu hình electron của nguyên tử N là: 1s22s22p3
→Cấu hình electron lớp ngoài cùng của nguyên tử N theo ô lượng tử là:
→ Như vậy 6 orbital p của 2 nguyên tử nitrogen tham gia xen phủ để tạo 3 cặp electron dùng chung trong công thức phân tử N2: N≡N
→ Đáp án: D
CH tr 31 11.13
Liên kết trong phân tử nào dưới đây không được hình thành do sự xen phủ giữa các orbital cùng loại (ví dụ cùng là orbital s, hoặc cùng là orbital p)?
A. Cl2. B. H2. C. NH3. D. Br2.
Phương pháp giải:
Dựa vào các nguyên tố tham gia liên kết thuộc nguyên tố họ s (electron cuối cùng điền vào phân lớp s) hay p (electron cuối cùng điền vào phân lớp s). Trong phân tử nếu gồm 2 nguyên tử giống nhau " các orbital chắc chắn cùng loại
Lời giải chi tiết:
- Đáp án: C
CH tr 32 11.14
Phát biểu nào sau đây không đúng?
A. Chỉ có các AO có hình dạng giống nhau mới xen phủ với nhau để tạo liên kết.
B. Khi hình thành liên kết cộng hoá trị giữa hai nguyên tử, luôn có một liên kết σ.
C. Liên kết σ bền vững hơn liên kết π.
D. Có hai kiểu xen phủ hình thành liên kết là xen phủ trục và xen phủ bên.
Lời giải chi tiết:
- Đáp án: A
- Giải thích: Trong phân tử HF, AO s của nguyên tử H xen phủ với AO p của nguyên tử F
CH tr 32 11.15
Số lượng electron tham gia hình thành liên kết đơn, đôi và ba lần lượt là:
A. 1, 2 và 3.
B. 2, 4 và 6.
C. 1, 3 và 5.
D. 2, 3 và 4.
Phương pháp giải:
Dựa vào mỗi liên kết tương ứng với 2 electron
Lời giải chi tiết:
- Đáp án: B
CH tr 32 11.16
Ghép mỗi nguyên tử hoặc phân tử sau với một hoặc các đặc điểm tương ứng của nó: N2, Ar, CO, H2.
(1) Liên kết trong phân tử là liên kết cộng hoá trị không phân cực.
(2) Liên kết trong phân tử là liên kết cộng hoá trị phân cực.
(3) Các nguyên tử trong phân tử đều tuân theo quy tắc octet.
(4) Là khí trơ.
(5) Có hai cặp electron hoá trị riêng.
(6) Liên kết trong phân tử là liên kết đơn.
Lời giải chi tiết:
- N2: (1), (3), (5)
+ Hiệu độ âm điện = 0 → (1)
+ Công thức lewis: → (3) và (5)
- Ar: là nguyên tố khí hiếm →(4)
- CO:
+ Hiệu độ âm điện = 3,44 - 2,55 = 0,89 → (2)
+ Công thức lewis: →(3), (5)
- H2: (1), (6)
+ Hiệu độ âm điện = 0 → (1)
+ Công thức cấu tạo: H-H → (6)
CH tr 32 11.17
Xét phân tử H2O, những phát biểu nào sau đây là đúng?
A. Liên kết H - O là liên kết cộng hoá trị không phân cực.
B. Liên kết H - O là liên kết cộng hoá trị phân cực.
C. Cặp electron dùng chung trong liên kết H - O lệch về phía nguyên tử O.
D. Cặp electron dùng chung trong liên kết H - O lệch về phía nguyên tử H.
E. Cặp electron dùng chung trong liên kết H - O phân bố đều giữa hai nguyên tử.
G. Nguyên tử O còn hai cặp electron hoá trị riêng.
Lời giải chi tiết:
- Đáp án:
+ B do hiệu độ âm điện của liên kết giữa H và O = 3,44 - 2,20 = 1,24
+ C do oxygen có độ âm điện cao hơn nên cặp electron dùng chung lệch về phía O
+ G do trong công thức lewis của H2O là:
-> oxygen còn 2 cặp electron hóa trị riêng
Ch tr 32 11.18
Xét phân tử CO2, những phát biểu nào sau đây là không đúng?
A. Liên kết giữa hai nguyên tử C và O là liên kết cộng hoá trị không phân cực.
B. Liên kết giữa hai nguyên tử C và O là liên kết cộng hoá trị phân cực.
C. Phân tử CO2 có 4 electron hoá trị riêng.
D. Phân tử CO2 có 4 cặp electron hoá trị riêng.
E. Trong phân tử CO2 có 3 liên kết σ và 1 liên kết π.
G. Trong phân tử CO2 có 2 liên kết σ và 2 liên kết π.
H. Trong phân tử CO2 có 1 liên kết σ và 3 liên kết π
Phương pháp giải:
- Đáp án: A, C, E và H
+ Liên kết C=O có = 3,44 - 2,55 = 0,89 → Liên kết cộng hóa trị phân cực
→ A sai, B đúng
+ Công thức Lewis của CO2:
→ C sai, D đúng; E và H sai, G đúng
(Trong 1 liên kết đôi có 1 liên kết σ và 1 liên kết π)
CH tr 33 11.19
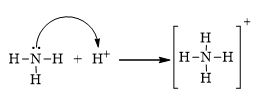
Cho biết hóa trị của một nguyên tố trong phân tử bằng tổng số liên kết σ và π mà nguyên tử nguyên tố đó tạo thành khi liên kết với các nguyên tử xung quanh. Hóa trị của N trong NH4+ là
A. 1. B. 2. C. 3. D. 4.
Phương pháp giải:
- Bước 1: Viết cấu hình electron của các nguyên tử
- Bước 2: Xác định số electron lớp ngoài cùng
- Bước 3: Viết công thức electron của phân tử -> công thức Lewis
- Bước 4: Viết sự hình thành liên kết cho - nhận trong ion ammonium từ ammonia và proton (H+)
Lời giải chi tiết:
- Cấu hình electron của H: 1s1 → H có 1 electron lớp ngoài cùng
- Cấu hình electron của N: 1s22s22p3 → N có 5 electron lớp ngoài cùng
→ Công thức electron:
→ Công thức Lewis:
- Sự hình thành liên kết cho - nhận trong ion ammonium từ ammonia và proton (H+)
→ Hóa trị của N trong NH4+ là IV
→ Đáp án: D
CH tr 33 11.20
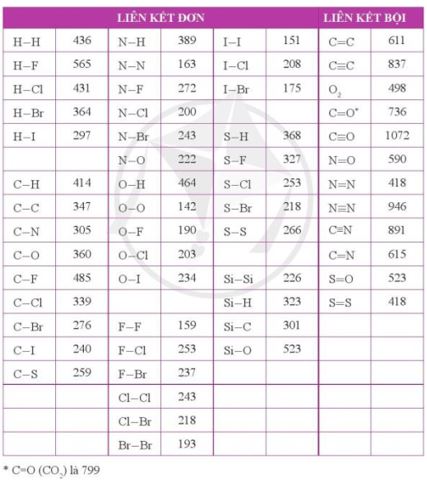
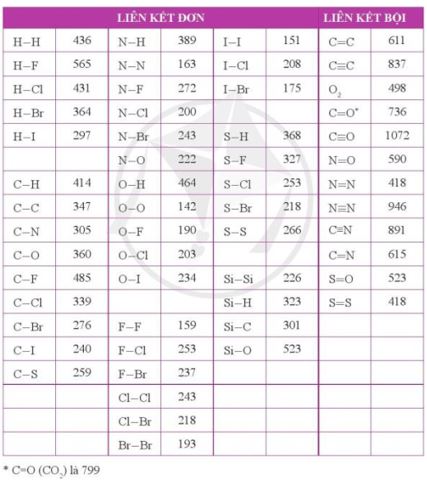
Cho biết năng lượng liên kết H - I và H - Br lần lượt là 297 kJ mol-1 và 364 kJ mol-1. Những phát biểu nào sau đây là không đúng?
A. Khi đun nóng, HI bị phân hủy (thành H2 và I2) ở nhiệt độ thấp hơn so với HBr (thành H2 và Br2).
B. Liên kết H - Br là bền vững hơn so với liên kết H - I.
C. Khi đun nóng, HI bị phân hủy (thành H2 và I2) ở nhiệt độ cao hơn so với HBr (thành H2 và Br2).
D. Liên kết H - I là bền vững hơn so với liên kết H - Br.
Phương pháp giải:
Dựa vào:
- Độ bền liên kết và năng lượng liên kết tỉ lệ thuận với nhau: năng lượng liên kết càng thấp → Liên kết càng kém bền và dễ bị phá vỡ
Lời giải chi tiết:
- Có năng lượng liên kết H - I là 297 kJ mol-1 < năng lượng liên kết H - Br là 364 kJ mol-1→ Liên kết H - Br bền hơn và bị phân hủy ở nhiệt độ cao hơn so với liên kết H - I
→ Đáp án: C và D
CH tr 33 11.21
Cho biết năng lượng liên kết H-H là 436 kJ mol-1. Hãy tính năng lượng cần thiết (theo eV) để phá vỡ liên kết trong một phân tử H2, cho biết 1 eV = 1,602×10-19 J.
Lời giải chi tiết:
- Năng lượng phá vỡ liên kết trong 1 phân tử = năng lượng liên kết của 1 mol phân tử đó / (số Avogadro.1 eV)
→ \(E = \frac{{{{436.10}^3}}}{{{N_A}.1,{{602.10}^{ - 19}}}} = \frac{{{{436.10}^3}}}{{6,{{02.10}^{23}}.1,{{602.10}^{ - 19}}}} = 4,52(eV)\)
CH tr 33 11.22
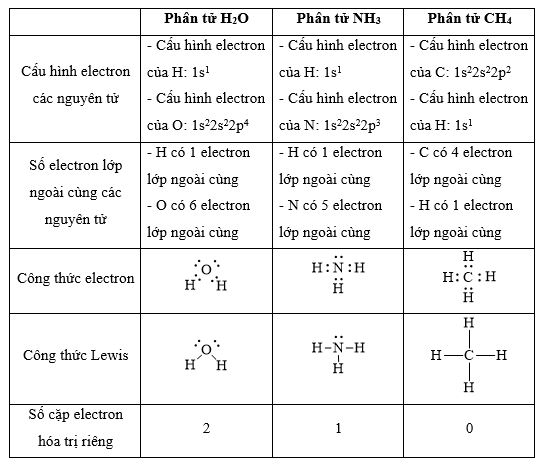
Thiết lập công thức Lewis cho các phân tử H2O, NH3 và CH4. Mỗi phân tử này có bao nhiêu cặp electron hóa trị riêng?
Phương pháp giải:
- Bước 1: Viết cấu hình electron của các nguyên tử
- Bước 2: Xác định số electron lớp ngoài cùng
- Bước 3: Viết công thức electron của phân tử -> công thức Lewis -> công thức cấu tạo
Lời giải chi tiết:
CH tr 33 11.23
Sử dụng bảng năng lượng của một số liên kết ở điều kiện chuẩn (Phụ lục 2, SGK Hóa học 10, Cánh Diều):
a) Tính tổng năng lượng liên kết trong mỗi phân tử H2S và H2O.
b) Nhiệt độ bắt đầu phân hủy thành nguyên tử hai chất trên là 400oC và 1000oC. Theo em, nhiệt độ phân hủy của chất nào cao hơn? Vì sao?
Phương pháp giải:
Dựa vào bảng số liệu và số liên kết có trong các phân tử
Lời giải chi tiết:
a) - Công thức cấu tạo của H2S là H-S-H
→ Năng lượng liên kết trong H2S = 368.2 = 736 (kJ mol-1)
- Công thức cấu tạo của H2O là H-O-H
→ Năng lượng liên kết trong H2O = 464.2 = 928 (kJ mol-1)
b) Nhiệt độ phân hủy của H2O cao hơn do liên kết H-O bền hơn liên kết H-S
CH tr 33 11.24
Các phân tử như F2, N2 khi phản ứng với H2 thì cần cắt đứt liên kết giữa các nguyên tử. Dựa vào năng lượng liên kết, dự đoán phản ứng của F2 hay của N2 với H2 sẽ thuận lợi hơn (dễ xảy ra hơn). Bỏ qua ảnh hưởng của độ bền phân tử sản phẩm tới mức độ phản ứng.
Phương pháp giải:
Dựa vào năng lượng liên kết để dự đoán: năng lượng liên kết càng cao → càng khó phá vỡ liên kết → càng khó phản ứng
Lời giải chi tiết:
- Năng lượng liên kết của F-F (159 kJ mol-1) < năng lượng liên kết của N≡N (946 kJ mol-1)
→ F2 dễ tham gia phản ứng với H2 hơn N2
CH tr 33 11.25
Giải thích vì sao ở điều kiện thường không tồn tại phân tử NaCl riêng biệt mà là tinh thể NaCl.
Lời giải chi tiết:
Bản chất liên kết ion trong phân tử NaCl là lực hút tĩnh điện giữa các ion trái dấu và không có tính định hướng. Có nghĩa là 1 ion Na+ có thể hút nhiều ion Cl- xung quanh và ngược lại → ở điều kiện thường, trong tinh thể NaCl, 1 ion được bao quanh ở nhiều ion trái dấu khác thay vì phân tử NaCl chỉ có 2 ion → tạo cấu trúc mạng tinh thể
Các bài khác cùng chuyên mục
- Bài 18: Hydrogen halide và hydrohalic acid trang 62, 63, 64 SBT Hóa 10 Cánh diều
- Bài 17: Nguyên tố và đơn chất Halogen trang 56, 57, 58 SBT Hóa 10 Cánh diều
- Bài 16: Tốc độ phản ứng hóa học trang 49, 50, 51 SBT Hóa 10 Cánh diều
- Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học trang 44, 45, 46 SBT Hóa 10 Cánh diều
- Bài 14. Phản ứng hóa học và enthalpy trang 41, 42, 43 SBT Hóa 10 Cánh diều
- Bài 18: Hydrogen halide và hydrohalic acid trang 62, 63, 64 SBT Hóa 10 Cánh diều
- Bài 17: Nguyên tố và đơn chất Halogen trang 56, 57, 58 SBT Hóa 10 Cánh diều
- Bài 16: Tốc độ phản ứng hóa học trang 49, 50, 51 SBT Hóa 10 Cánh diều
- Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học trang 44, 45, 46 SBT Hóa 10 Cánh diều
- Bài 14. Phản ứng hóa học và enthalpy trang 41, 42, 43 SBT Hóa 10 Cánh diều





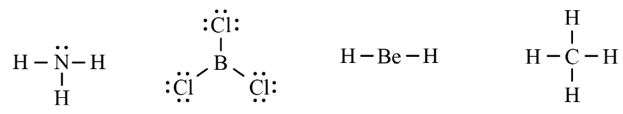
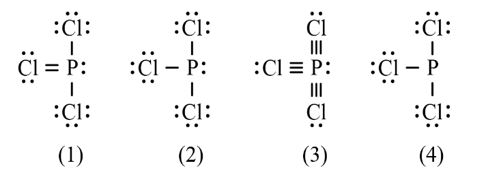








Danh sách bình luận