Bài 7. Sulfuric acid và muối sulfate trang 44, 45, 46, 47, 48, 49 ,50 Hóa học 11 Cánh diều
Nhãn dán trên chai đựng dung dịch sulfuric acid thường có hình như Hình 7.1. Giải thích ý nghĩa của hình và nguyên nhân gây nên hiện tượng được mô tả trong hình.
CH tr 44 MĐ
Video hướng dẫn giải
Nhãn dán trên chai đựng dung dịch sulfuric acid thường có hình như Hình 7.1. Giải thích ý nghĩa của hình và nguyên nhân gây nên hiện tượng được mô tả trong hình.
Phương pháp giải:
Sulfuric acid có tính acid mạnh, sulfuric acid đặc có tính oxi hóa, tính háo nước.
Lời giải chi tiết:
- Ý nghĩa của biển báo trên Hình 7.1: hóa chất ăn mòn.
- Nguyên nhân: Sulfuric acid có tính acid mạnh, sulfuric acid đặc có tính oxi hóa, tính háo nước. Do đó sulfuric acid có khả năng ăn mòn vật liệu, gây bỏng da.
CH tr 44 CH
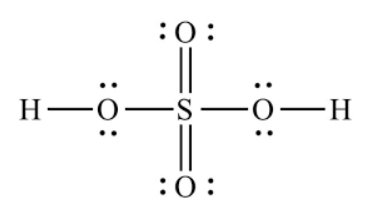
Hãy viết công thức Lewis của phân tử H2SO4.
Phương pháp giải:
Công thức Lewis là công thức biểu diễn cấu tạo phân tử qua các liên kết (cặp electron chung) và các electron riêng. Các nguyên tử liên kết với nhau theo xu hướng chung là tạo ra lớp electron ngoài cùng như của khí hiếm gần nhất để mỗi nguyên tử đó trở nên bền vững hơn.
Lời giải chi tiết:
Công thức Lewis của phân tử H2SO4.
CH tr 45 TN1
Video hướng dẫn giải
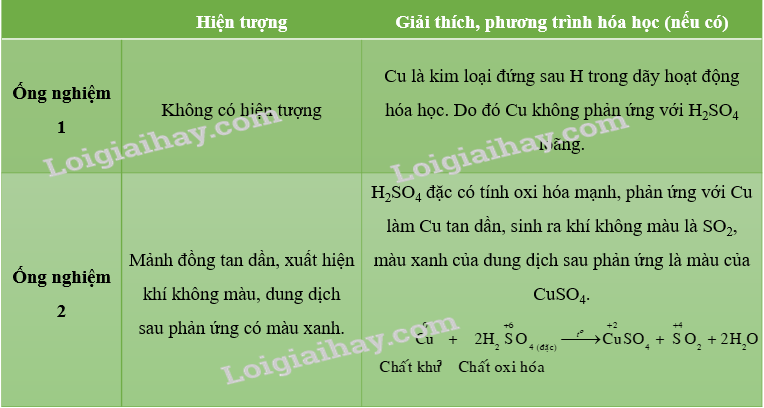
Thí nghiệm 1. Tính oxi hoá của dung dịch sulfuric acid loãng và dung dịch sulfuric acid đặc
Chuẩn bị: Kim loại đồng dạng mảnh hoặc sợi, dung dịch sulfuric acid loãng và dung dịch sulfuric acid đặc, ống nghiệm, bông tẩm kiểm, đèn cồn.
Tiến hành:
• Cho mảnh đồng nhỏ vào ống nghiệm thứ nhất. Cho tiếp vào ống nghiệm khoảng 3 mL dung dịch sulfuric acid loãng. Đun nóng nhẹ ống nghiệm trên ngọn lửa đèn cồn.
• Cho mảnh đồng nhỏ vào ống nghiệm thứ hai. Cho tiếp vào ống nghiệm khoảng 3 mL dung dịch sulfuric acid đặc. Nút bông tẩm kiềm vào miệng ống nghiệm. Đun nóng nhẹ ống nghiệm trên ngọn lửa đèn cồn.
Yêu cầu: Quan sát hiện tượng và giải thích. Viết phương trình hoá học minh hoạ, xác định vai trò của các chất khi phản ứng xảy ra.
Phương pháp giải:
- Dung dịch sulfuric acid loãng có tính acid, dung dịch sulfuric acid đặc có tính acid, tính oxi hóa mạnh và tính háo nước.
- Trong phản ứng oxi hóa khử, chất khử là chất cho electron, có số oxi hóa tăng; chất oxi hóa là chất nhận electron, có số oxi hóa giảm.
Lời giải chi tiết:
CH tr 45 TN2
Thí nghiệm 2. Tính háo nước và tính oxi hoá của dung dịch sulfuric acid đặc
Chuẩn bị: Đường kính hoặc bột gạo hay bột mì, cốc thuỷ tinh chịu nhiệt, chậu thuỷ tinh rộng, ống nhỏ giọt, dung dịch sulfuric acid đặc.
Tiến hành: Đặt cốc thuỷ tinh vào chậu thuỷ tinh. Cho một thìa nhỏ đường kính, hoặc bột gạo, hoặc bột mì vào cốc. Nhỏ từ từ vài mL dung dịch sulfuric acid đặc vào cốc.
Yêu cầu: Quan sát hiện tượng. Giải thích và viết phương trình hoá học.
Phương pháp giải:
Dung dịch sulfuric acid loãng có tính acid, dung dịch sulfuric acid đặc có tính acid, tính oxi hóa mạnh và tính háo nước.
Lời giải chi tiết:
- Hiện tượng: Đường kính hoặc bột gạo hay bột mì dần dần hoá thành chất rắn màu đen, sau đó trong cốc sủi bọt đẩy chất rắn màu đen trào ra ngoài cốc.
- Giải thích: Các hợp chất đường kính, bột gạo hay bột mì,… (công thức tổng quát có dạng Cn(H2O)m) bị sulfuric acid đặc hút nước tạo ra chất rắn màu đen là carbon. Một phần carbon sinh ra tiếp tục bị oxi hoá bởi sulfuric acid tạo thành khí CO2 và SO2 , đẩy carbon trào ra ngoài cốc.
- Phương trình hóa học:
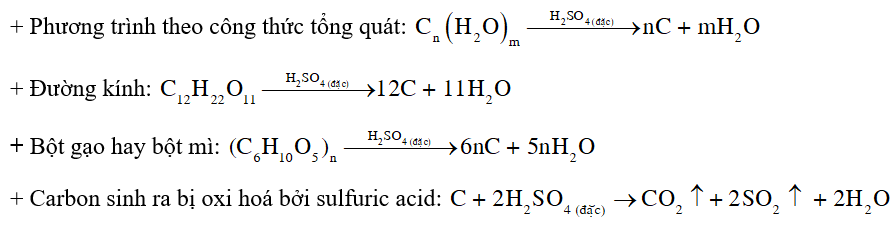
CH tr 45 CH
Hãy viết phương trình hóa học của phản ứng giữa dung dịch sulfuric acid loãng, dư với lần lượt từng chất sau: kẽm (zinc), zinc oxide, barium hydroxide, sodium carbonate.
Phương pháp giải:
Dung dịch sulfuric acid loãng có các tính chất chung của acid:
- Đổi màu quỳ tím thành đỏ.
- Tác dụng với kim loại hoạt động trong dãy hoạt động hoá học.
- Tác dụng với basic oxide và base.
- Tác dụng với nhiều muối.
Lời giải chi tiết:
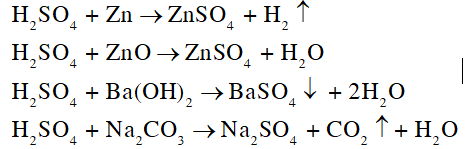
CH tr 46 CH
Số oxi hoá lớn nhất của sulfur trong các hợp chất là +6. Vậy H2SO4 có khả năng thể hiện tính khử không? Giải thích.
Phương pháp giải:
Trong phản ứng oxi hóa khử, chất khử là chất cho electron, có số oxi hóa tăng; chất oxi hóa là chất nhận electron, có số oxi hóa giảm.
Lời giải chi tiết:
Các số oxi hóa có thể có của sulfur: -2; 0; +2; +4; +6.
Vì +6 là số oxi hóa lớn nhất của sulfur, do đó trong các phản ứng oxi hóa khử, số oxi hóa của sulfur chỉ có thể giảm về +4 (hoặc +2; 0; -2). Vậy H2SO4 không có khả năng thể hiện tính khử, mà chỉ thể hiện tính oxi hóa.
CH tr 46 CH1
Video hướng dẫn giải
Dự đoán hiện tượng xảy ra khi cho vài giọt dung dịch sulfuric acid đặc vào ống nghiệm chứa vài hạt cơm (thành phần chính là tinh bột ((C6H10O5)n). Viết phương trình hoá học minh hoạ.
Phương pháp giải:
Dung dịch sulfuric acid đặc có tính acid, tính oxi hóa mạnh và tính háo nước.
Lời giải chi tiết:
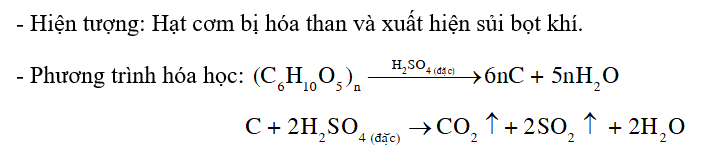
CH tr 46 CH2
Trong phòng thí nghiệm có một lọ đựng dung dịch sulfuric acid đặc không còn nguyên chất, không sử dụng được nữa. Hãy để xuất cách loại bỏ lọ acid này một cách an toàn mà ít gây ảnh hưởng đến môi trường và sức khoẻ.
Phương pháp giải:
Loại bỏ lọ acid bằng cách cho acid phản ứng hóa học với chất khác, sinh ra sản phẩm an toàn, ít gây ảnh hưởng đến môi trường và sức khoẻ.
Lời giải chi tiết:
- Cách loại bỏ: Sử dụng dịch base (nước vôi trong - Ca(OH)2) để trung hòa acid, tạo kết tủa với ion
- Phương trình:
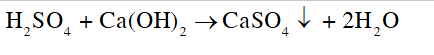
CH tr 48 CH1
Video hướng dẫn giải
“Nhờ có chất xúc tác nên phản ứng giữa SO2 và O2 ưu tiên diễn ra theo chiều thuận". Phát biểu trên là đúng hay sai? Giải thích.
Phương pháp giải:
Chất xúc tác không làm thay đổi nồng độ các chất trong hệ cân bằng và cũng không làm thay đổi hằng số cân bằng nên không làm chuyển dịch cân bằng. Chất xúc tác có tác dụng làm tăng tốc độ phản ứng thuận và phản ứng nghịch nên làm cho hệ nhanh chóng đạt trạng thái cân bằng.
Lời giải chi tiết:
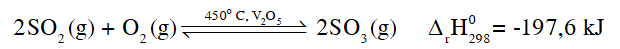
Vai trò của chất xúc tác trong phản ứng giữa SO2 và O2 là làm tăng tốc độ phản ứng thuận và nghịch. Do đó không xảy ra sự ưu tiên cho phản ứng thuận. Phát biểu trên là sai.
CH tr 48 CH2
Quá trình sản xuất sulfuric acid có thể ảnh hưởng đến môi trường và người tham gia sản xuất. Hãy tìm hiểu nguyên nhân và đề xuất một số biện pháp hạn chế những tác hại đó.
Phương pháp giải:
- Khí SO2 là là một khí độc, khi tiếp xúc với sulfur dioxdie ở một nồng độ nhất định, cơ thể cảm thấy khó thở, gây ra bệnh viêm đường hô hấp, đau mắt,…là một trong những nguyên nhân gây nên mưa acid.
- Dung dịch sulfuric acid đặc có tính acid, tính oxi hóa mạnh và tính háo nước.
Lời giải chi tiết:
- Trong quá trình sản xuất sulfuric acid có thể xảy ra hiện tượng rò rỉ khí sulfur dioxide, sulfur trioxide làm ảnh hưởng tới sức khỏe của người tham gia sản xuất (khó thở, bệnh viêm đường hô hấp, đau mắt,…) và môi trường (gây nên mưa acid).
- Biện pháp hạn chế tác hại:
+ Dẫn khí sulfur dioxide, sulfur trioxide bị rò rỉ vào tháp hoặc bồn chứa các chất hấp phụ phù hợp, như than hoạt tính, hấp phụ khí sulfur dioxide, sulfur trioxide.
+ Chuyển hoá sulfur dioxide, sulfur trioxide bị rò rỉ thành các chất ít gây ô nhiễm hơn bằng các hoá chất như vôi sống (thành phần chính là CaO), vôi tôi (thành phần chính là Ca(OH)2) hoặc đá vôi nghiền (thành phần chính là CaCO3).
CH tr 49 CH
Video hướng dẫn giải
Hai chất phụ gia thực phẩm đều màu trắng là bột thạch cao nung và bột "baking soda" NaHCO3. Làm thế nào để phân biệt hai chất phụ gia này?
Phương pháp giải:
Dựa vào độ tan trong nước của hai muối trên để phân biệt.
Ở nhiệt độ phòng, thạch cao nung (CaSO4.0,5H2O) tan rất ít trong nước, baking soda (NaHCO3) tan nhiều trong
Lời giải chi tiết:
Chuẩn bị 2 cốc thủy tinh chứa 100 gam nước, lấy 5 gam mỗi chất cho vào từng cốc thủy tinh chứa nước đã chuẩn bị và khuấy đều. Chất tan hết trong nước là bột "baking soda" (NaHCO3), chất không tan hết trong nước là thạch cao nung (CaSO4.0,5H2O).
CH tr 50 CH
Video hướng dẫn giải
Trình bày cách sử dụng dung dịch barium hydroxide để phân biệt ba phân đạm có thành phần chính lần lượt là NaNO3, NH4Cl, (NH4)2SO4.
Phương pháp giải:
Ion được nhận biết nhờ phản ứng với ion Ba2+ tạo kết tủa BaSO4 màu trắng. Kết tủa này không tan trong dung dịch acid và base.
Ion ammonium . Khi phản ứng với dung dịch kiềm, sinh khí NH3 (ammonia) có mùi khai, xốc.
Lời giải chi tiết:
Đánh số thứ tự từng mẫu phân đạm, trích mẫu thử sang ống nghiệm đánh số tương ứng.
Cho lần lượt từng mẫu thử tác dụng với dung dịch barium hydroxide (Ba(OH)2), đun nóng nhẹ:
- Mẫu thử nào tan và không có hiện tượng gì thêm thì mẫu thử đó là NaNO3.
- Mẫu thử nào tan và xuất hiện khí có mùi khai, xốc thì mẫu thử đó là NH4Cl:
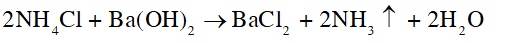
- Mẫu thử nào tan, xuất hiện kết tủa trắng và khí có mùi khai, xốc thì mẫu thử đó là (NH4)2SO4:
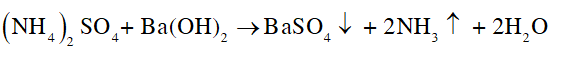
CH tr 50 BT1
a) Tính thể tích dung dịch H2SO4 98% (D = 1,84 g mL-1) cần dùng để pha chế thành 500 mL dung dịch H2SO4 0,05 M.
b) Tính thể tích dung dịch H2SO4 0,05 M cần dùng để trung hoà 10 mL dung dịch NaOH có pH = 13.
Phương pháp giải:

Lời giải chi tiết:

CH tr 50 BT2
Các ao, hồ, suối, sông quanh miệng núi lửa thường có môi trường acid. Điển hình là hồ Kawah Ijen, miền Đông đảo Java, Indonesia. Hồ nằm cao hơn mặt nước biển 2300 m, được cho là “hồ acid” lớn nhất thế giới. Giá trị pH của nước trong hồ dao động từ 0,13 đến 0,50 chủ yếu do sulfuric acid gây nên.
Hãy giải thích nguyên nhân có mặt của sulfuric acid trong hồ.
Phương pháp giải:
pH = -lg[H+]. Với [H+] là nồng độ ion H+ trong dung dịch.
Môi trường acid có pH < 7
Đơn chất sulfur được tìm thấy chủ yếu tại các vùng có núi lửa. Qua các quá trình oxi hóa sulfur, tạo ra sulfuric acid.
Lời giải chi tiết:

CH tr 50 BT3
Dựa vào tính chất nào để phân biệt nhanh muối magnesium sulfate và muối barium sulfate?
Phương pháp giải:
Dựa vào tính hút nước: magnesium sulfate hút nước, barium sulfate thì không. Hoặc dựa vào độ tan trong nước của hai muối.
Lời giải chi tiết:
Ở 20 oC, độ tan của barium sulfate là 0,2448 mg/100 g H2O, độ tan của magnesium sulfate là 33,7 g/100 g H2O.
Như vậy để phân biệt muối magnesium sulfate và muối barium sulfate, ta dựa vào độ tan của hai muối trên.
Lấy cùng một lượng muối magnesium sulfate và muối barium sulfate, hòa tan mỗi muối trên vào trong 2 cốc chứa cùng một lượng nước, ở cùng một nhiệt độ và khuấy đều. Muối tan tốt hơn là magnesium sulfate, muối hầu như không tan là barium sulfate.
CH tr 50 BT4
Viết phương trình hoá học của các phản ứng theo dãy chuyển hoá dưới đây.
FeS2 → SO2 → SO3 → H2SO4 → (NH4)2SO4
Phương pháp giải:
FeS2 → SO2 → SO3 → H2SO4 là chuỗi phản ứng sản xuất sulfuric acid.
H2SO4 → (NH4)2SO4 là phản ứng sản xuất phân bón. NH3 có tính base, phản ứng với sulfuric acid.
Lời giải chi tiết:
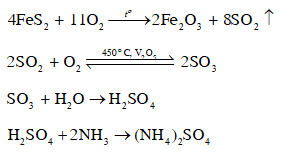
Các bài khác cùng chuyên mục
- Bài 19: Carboxylic acid trang 132, 133, 134, 135, 136, 137, 138, 139 Hóa học 11 Cánh diều
- Bài 18: Hợp chất carbonyl trang 122, 123, 124, 125, 126, 127, 128, 129, 130, 131 Hóa học 11 Cánh diều
- Bài 17: Phenol trang 116, 117, 118, 119, 120, 121 Hóa học 11 Cánh diều
- Bài 16: Alcohol trang 107, 108, 109, 110, 111, 112, 113, 114, 115 Hóa học 11 Cánh diều
- Bài 15: Dẫn xuất halogen trang 100, 101, 102, 103, 104, 105, 106 Hóa học 11 Cánh diều
- Bài 19: Carboxylic acid trang 132, 133, 134, 135, 136, 137, 138, 139 Hóa học 11 Cánh diều
- Bài 18: Hợp chất carbonyl trang 122, 123, 124, 125, 126, 127, 128, 129, 130, 131 Hóa học 11 Cánh diều
- Bài 17: Phenol trang 116, 117, 118, 119, 120, 121 Hóa học 11 Cánh diều
- Bài 16: Alcohol trang 107, 108, 109, 110, 111, 112, 113, 114, 115 Hóa học 11 Cánh diều
- Bài 15: Dẫn xuất halogen trang 100, 101, 102, 103, 104, 105, 106 Hóa học 11 Cánh diều













Danh sách bình luận