Trắc nghiệm Bài 5: Ammonia - Muối ammonium Hóa 11 Kết nối tri thức
Đề bài
Muối được làm bột nở trong thực phẩm là:
-
A.
(NH4)2CO3.
-
B.
Na2CO3.
-
C.
NH4HCO3.
-
D.
NH4Cl.
Dãy các chất đều phản ứng với NH3 trong điều kiện thích hợp là :
-
A.
HCl, O2, Cl2, FeCl3.
-
B.
H2SO4, Ba(OH)2, FeO, NaOH.
-
C.
HCl, HNO3, AlCl3, CaO.
-
D.
KOH, HNO3, CuO, CuCl2.
Nhận xét nào sau đây không đúng về muối ammonium?
-
A.
Muối ammonium bền với nhiệt.
-
B.
Các muối ammonium đều là chất điện li mạnh.
-
C.
Tất cả các muối ammonium đều tan trong nước.
-
D.
Các muối ammonium đều bị thủy phân trong nước.
Chất nào sau đây có thể làm khô khí NH3 có lẫn hơi nước?
-
A.
P2O5.
-
B.
H2SO4 đặc.
-
C.
CuO bột.
-
D.
NaOH rắn.
Phản ứng giữa NH3 với chất nào sau đây chứng minh NH3 thể hiện tính base
-
A.
Cl2.
-
B.
O2.
-
C.
HCl.
-
D.
CuO.
Hợp chất X tan trong nước tạo dung dịch không màu. Dung dịch này không tạo kết tủa với dung dịch BaCl2, khi phản ứng với NaOH tạo ra khí có mùi khai, khi phản ứng với dung dịch HCl tạo ra khí làm đục nước vôi trong và làm mất màu dung dịch thuốc tím. Chất này là
-
A.
NH4HSO3.
-
B.
Na2SO3.
-
C.
NH4HCO3.
-
D.
(NH4)2CO3.
Trong các phản ứng sau, phản ứng nào NH3 đóng vai trò là một chất oxi hóa?
-
A.
2NH3 + H2O2+ MnSO4 → MnO2 + (NH4)2SO4.
-
B.
2NH3+ 3Cl2 → N2 + 6HCl.
-
C.
4NH3 + 5O2 → 4NO+ 6H2O.
-
D.
2NH3 + 2Na → 2NaNO3 + H2.
Để tách riêng NH3 ra khỏi hỗn hợp gồm N2, H2, NH3 trong công nghiệp, người ta đã:
-
A.
Cho hỗn hợp qua nước vôi trong dư.
-
B.
Cho hỗn hợp qua bột CuO nung nóng.
-
C.
Nén và làm lạnh hỗn hợp để hóa lỏng NH3.
-
D.
Cho hỗn hợp qua dung dịch H2SO4 đặc.
Nhận xét nào sau đây về NH3 là đủ nhất?
-
A.
NH3 là một base.
-
B.
NH3 là một chất khử.
-
C.
NH3 vừa có tính khử của một chất khử vừa có tính chất của một base.
-
D.
NH3 chỉ có tính base và tính khử mà không thể hiện tính oxi hóa.
NH3 thể hiện tính khử trong phản ứng hóa học nào trong các phản ứng hóa học sau?
-
A.
2NH3 + H2O--> NH4+ + OH-.
-
B.
3NH3+ AlCl3 + 3H2O → Al(OH)3 + 3NH4Cl.
-
C.
2NH3 + 3CuO → N2 + 3Cu + 3H2O.
-
D.
NH3 + HCl → NH4Cl.
Cho cân bằng hóa học: \({N_{2(k)}} + 3{H_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_{3(k)}}\) ∆H = -92 kJ. Khi giảm thể tích của hỗn hợp ở trạng thái cân bằng khi nhiệt độ không đổi thì cân bằng sẽ chuyển dịch:
-
A.
Theo chiều phản ứng nghịch.
-
B.
Theo chiều phản ứng thuận.
-
C.
Không làm chuyển dịch cân bằng.
-
D.
Tùy theo mức độ giảm thể tích mà cân bằng chuyển dịch theo chiều thuận hay chiều nghịch.
Phải dùng bao nhiêu lít khí Nitrogen và bao nhiêu lít khí Hydrogen để điều chế 17,0 gam NH3? Biết răng hiệu suất phản ứng tổng hợp NH3 là 20%. Các thể tích khí được đo ở đktc.
-
A.
11,2 lít N2 và 33,6 lít H2.
-
B.
11,2 lít N2 và 168 lít H2.
-
C.
56 lít N2 và 168 lít H2.
-
D.
33,6 lít N2 và 11,2 lít H2.
Trong phân tử NH3 chứa liên kết?
-
A.
Liên kết cho nhận.
-
B.
Liên kết cộng hóa trị không phân cực.
-
C.
Liên kết cộng hóa trị phân cực.
-
D.
Liên kết Ion.
Cho hỗn hợp N2 và H2 vào bình phản ứng có nhiệt độ không đổi. Sau thời gian phản ứng, áp suất khí trong bình giảm 5% so với áp suất ban đầu. Biết ti lệ số mol của nitrogen đã phản ứng là 15%. Thành phần phần trăm về số mol của N2 và H2 trong hỗn hợp đầu?
-
A.
20% và 80%.
-
B.
16,67 và 83,33%.
-
C.
25% và 75%.
-
D.
40% và 60%.
Bình cầu chứa đầy khí ammonia khô, được úp ngược lên một chậu chứa dung dịch HCl loãng pha dung dịch quỳ có màu hồng. Nước phun lên trong bình cầu và dung dịch trong bình cầu chuyển thành màu xanh. Hiện tượng này xảy ra vì?
-
A.
Acid đã phản ứng với ammonia, làm quỳ đổi màu từ hồng sang xanh.
-
B.
Ammonia là acid yếu, làm quỳ chuyển màu xanh.
-
C.
Ammonia có tính base, tan trong nước nên áp suất giảm, nhờ đó nước có thể phun lên.
-
D.
Acid đã phản ứng khí ammonia trong bình nên áp suất giảm, nhờ đó nước có thể phun lên.
Cho các phát biểu sau:
- Ammonia lỏng được dùng làm chất làm lạnh trong thiết bị.
- Để làm khô khí NH3 có lẫn hơi nước, cho khí NH3 đi qua bình đựng dung dịch H2SO4 đậm đặc.
- Khi cho quỳ tím ẩm vào lọ đựng khí NH3, quỳ tím chuyển thành màu đỏ.
- Nitrogen lỏng được dùng để bảo quản máu và các mẫu vật sinh học.
-
A.
2.
-
B.
1.
-
C.
4.
-
D.
3.
Trong quá trình tổng hợp ammonia theo quy trình Haber (Haber – Bosch), sau khi đã hóa lỏng NH3, hydrogen và nitrogen sẽ:
-
A.
Qua ống dẫn khí thải được loại bổ
-
B.
Đưa trở lại buồng phản ứng để tái sử dụng
-
C.
Tiếp tục qua lò phản ứng số 2 để tăng hiệu suất tổng hợp
-
D.
Hygrogen được tái sử dụng, còn nitrogen loại bỏ dựa vào tỉ trọng
Phương trình phân ly của NH3 trong nước nào sau đây đúng:
-
A.
\(N{H_3}(aq) + {H_2}O(l) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} N{H_3}O{H^ - }(aq) + {H^ + }(aq)\)
-
B.
\(N{H_3}(aq) + {H_2}O(l) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} N{H_2}^ - (aq) + {H_3}{O^ + }(aq)\)
-
C.
\(N{H_3}(aq) + {H_2}O(l) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} N{H_4}^ + (aq) + O{H^ - }(aq)\)
-
D.
\(N{H_3}(aq) + {H_2}O(l) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} N{H_4}OH(l)\)
Tính base của NH3 do:
-
A.
Trên N còn cặp electron tự do
-
B.
Phân tử có 3 liên kết cộng hóa trị phân cực
-
C.
NH3 tan được nhiều trong nước
-
D.
NH3 tác dụng với nước tạo NH4OH
Phát biểu nào sau đây không đúng khi nói về ammonia?
-
A.
Trong công nghiệp, ammoina thường được sử dụng với vai trò chất làm lạnh (chất sinh hàn)
-
B.
Do có hàm lượng nitrogen cao (82,35% theo khối lượng) nên ammonia được sử dụng làm phân đạm rất hiệu quả
-
C.
Phần lớn ammonia được dùng phản ứng với acid để sản xuất các loại phân đạm
-
D.
Qúa trình tổng hợp ammonia từ nitrogen và hydrogen là quá trình thuận nghịch nên không thể đạt hiệu suất 100%
Lời giải và đáp án
Muối được làm bột nở trong thực phẩm là:
-
A.
(NH4)2CO3.
-
B.
Na2CO3.
-
C.
NH4HCO3.
-
D.
NH4Cl.
Đáp án : C
Dựa vào kiến thức về Ứng dụng của muối Ammonium.
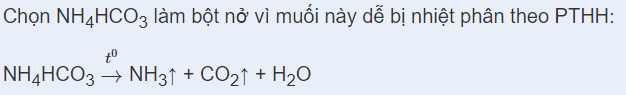
Dãy các chất đều phản ứng với NH3 trong điều kiện thích hợp là :
-
A.
HCl, O2, Cl2, FeCl3.
-
B.
H2SO4, Ba(OH)2, FeO, NaOH.
-
C.
HCl, HNO3, AlCl3, CaO.
-
D.
KOH, HNO3, CuO, CuCl2.
Đáp án : A
Dựa vào kiến thức về Tính chất hóa học của Ammonia.
HCl + NH3 -> NH4Cl
Cl2 + NH3 -> NH4Cl + N2
FeCl3 + NH3 + H2O -> Fe(OH)3 + 3NH4Cl
Nhận xét nào sau đây không đúng về muối ammonium?
-
A.
Muối ammonium bền với nhiệt.
-
B.
Các muối ammonium đều là chất điện li mạnh.
-
C.
Tất cả các muối ammonium đều tan trong nước.
-
D.
Các muối ammonium đều bị thủy phân trong nước.
Đáp án : A
Dựa vào kiến thức về Muối ammonium.
Các muối ammonium đều kém bền nhiệt và dễ bị phân hủy khi nung nóng
Chất nào sau đây có thể làm khô khí NH3 có lẫn hơi nước?
-
A.
P2O5.
-
B.
H2SO4 đặc.
-
C.
CuO bột.
-
D.
NaOH rắn.
Đáp án : D
Dựa vào kiến thức về Tính chất hóa học của Ammonia.
Chất dùng làm khô khí NH3 có lẫn hơi nước phải là chất có đặc tính hút nước và không phản ứng với NH3.
→ Dùng NaOH rắn để làm khô khí
Phản ứng giữa NH3 với chất nào sau đây chứng minh NH3 thể hiện tính base
-
A.
Cl2.
-
B.
O2.
-
C.
HCl.
-
D.
CuO.
Đáp án : C
Dựa vào kiến thức về Tính chất hóa học của Ammonia.
HCl + NH3 -> NH4Cl => Chọn C
Hợp chất X tan trong nước tạo dung dịch không màu. Dung dịch này không tạo kết tủa với dung dịch BaCl2, khi phản ứng với NaOH tạo ra khí có mùi khai, khi phản ứng với dung dịch HCl tạo ra khí làm đục nước vôi trong và làm mất màu dung dịch thuốc tím. Chất này là
-
A.
NH4HSO3.
-
B.
Na2SO3.
-
C.
NH4HCO3.
-
D.
(NH4)2CO3.
Đáp án : A
Dựa vào kiến thức về Tính chất hóa học của Ammonia.
- X+ NaOH sinh ra khí có mùi khai → cation là NH4+
- Dung dịch X không tạo kết tủa với dung dịch BaCl2 → gốc axit không thể là SO42−,CO32−,SO32−
- Dung dịch X + HCl sinh ra khí làm đục nước vôi trong và làm mất màu dung dịch thuốc tím → anion là HSO3−.
→ X là NH4HSO3.
Trong các phản ứng sau, phản ứng nào NH3 đóng vai trò là một chất oxi hóa?
-
A.
2NH3 + H2O2+ MnSO4 → MnO2 + (NH4)2SO4.
-
B.
2NH3+ 3Cl2 → N2 + 6HCl.
-
C.
4NH3 + 5O2 → 4NO+ 6H2O.
-
D.
2NH3 + 2Na → 2NaNO3 + H2.
Đáp án : D
Dựa vào kiến thức về Tính chất hóa học của Ammonia.
Để tách riêng NH3 ra khỏi hỗn hợp gồm N2, H2, NH3 trong công nghiệp, người ta đã:
-
A.
Cho hỗn hợp qua nước vôi trong dư.
-
B.
Cho hỗn hợp qua bột CuO nung nóng.
-
C.
Nén và làm lạnh hỗn hợp để hóa lỏng NH3.
-
D.
Cho hỗn hợp qua dung dịch H2SO4 đặc.
Đáp án : C
Dựa vào kiến thức về Tính chất vật lý của Ammonia.
Ammonia dễ hóa lỏng, hóa lỏng ở -33,3℃.
Nhận xét nào sau đây về NH3 là đủ nhất?
-
A.
NH3 là một base.
-
B.
NH3 là một chất khử.
-
C.
NH3 vừa có tính khử của một chất khử vừa có tính chất của một base.
-
D.
NH3 chỉ có tính base và tính khử mà không thể hiện tính oxi hóa.
Đáp án : D
Dựa vào kiến thức về Tính chất hóa học của Ammonia.
Trong phân tử ammonia, nguyên tử nitrogen có số oxi là -3 (số oxi hóa thấp nhất của nitrogen) nên ammonia chỉ thể hiện tính khử.
NH3 thể hiện tính khử trong phản ứng hóa học nào trong các phản ứng hóa học sau?
-
A.
2NH3 + H2O--> NH4+ + OH-.
-
B.
3NH3+ AlCl3 + 3H2O → Al(OH)3 + 3NH4Cl.
-
C.
2NH3 + 3CuO → N2 + 3Cu + 3H2O.
-
D.
NH3 + HCl → NH4Cl.
Đáp án : C
Dựa vào kiến thức về Tính chất hóa học của Ammonia.
NH3 thể hiện tính khử trong phản ứng:
\(2\mathop N\limits^{ - 3} {H_3}\; + {\rm{ }}3CuO\;{\rm{ }}\; \to \;{\rm{ }}\;{\mathop N\limits^0 _2} + {\rm{ }}3Cu{\rm{ }} + {\rm{ }}3{H_2}O\)
Cho cân bằng hóa học: \({N_{2(k)}} + 3{H_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_{3(k)}}\) ∆H = -92 kJ. Khi giảm thể tích của hỗn hợp ở trạng thái cân bằng khi nhiệt độ không đổi thì cân bằng sẽ chuyển dịch:
-
A.
Theo chiều phản ứng nghịch.
-
B.
Theo chiều phản ứng thuận.
-
C.
Không làm chuyển dịch cân bằng.
-
D.
Tùy theo mức độ giảm thể tích mà cân bằng chuyển dịch theo chiều thuận hay chiều nghịch.
Đáp án : B
Dựa vào kiến thức về các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hóa học.
Khi giảm thể tích hỗn hợp => áp suất hỗn hợp tăng => cân bằng chuyển dịch theo chiều giảm số mol khí (chiều thuận).
Phải dùng bao nhiêu lít khí Nitrogen và bao nhiêu lít khí Hydrogen để điều chế 17,0 gam NH3? Biết răng hiệu suất phản ứng tổng hợp NH3 là 20%. Các thể tích khí được đo ở đktc.
-
A.
11,2 lít N2 và 33,6 lít H2.
-
B.
11,2 lít N2 và 168 lít H2.
-
C.
56 lít N2 và 168 lít H2.
-
D.
33,6 lít N2 và 11,2 lít H2.
Đáp án : C
Dựa vào kiến thức về Sản xuất Ammonia.
nNH3 = \(\frac{{17}}{{17}}\) = 1 mol
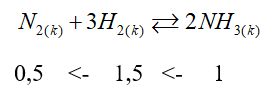
H = 20% => VH2 = \(\frac{{1,5.22,4.100}}{{20}}\) = 168 (lít)
VN2 = \(\frac{{0,5.22,4.100}}{{20}}\)= 56 (lít)
Trong phân tử NH3 chứa liên kết?
-
A.
Liên kết cho nhận.
-
B.
Liên kết cộng hóa trị không phân cực.
-
C.
Liên kết cộng hóa trị phân cực.
-
D.
Liên kết Ion.
Đáp án : C
Dựa vào kiến thức về Tính chất hóa học của Ammonia.
Trong phân tử ammonia, liên kết N-H phân cực, cặp electron dùng chung lệch về nguyên tử nitrogen làm cho nguyên tử hydrogen mang một phần điện tích dương.
Cho hỗn hợp N2 và H2 vào bình phản ứng có nhiệt độ không đổi. Sau thời gian phản ứng, áp suất khí trong bình giảm 5% so với áp suất ban đầu. Biết ti lệ số mol của nitrogen đã phản ứng là 15%. Thành phần phần trăm về số mol của N2 và H2 trong hỗn hợp đầu?
-
A.
20% và 80%.
-
B.
16,67 và 83,33%.
-
C.
25% và 75%.
-
D.
40% và 60%.
Đáp án : B
Dựa vào kiến thức về Sản xuất Ammonia.
Gọi số mol ban đầu của N2 và H2 lần lượt là x; y.
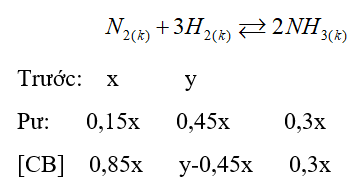
\(\frac{{{P_t}}}{{{P_s}}} = \frac{{{n_t}}}{{{n_s}}}\)=> \(\frac{{{P_t}}}{{0,95{P_t}}} = \frac{{x + y}}{{0,7x + y}}\) => 0,7x + y = 0,95(x + y)
=>y = 5x
%nN2 = \(\frac{x}{{x + y}}.100\% = \frac{x}{{x + 5x}}.100\% \)= 16,67%
%nH2 = 100% - 16,67% = 83,33%
Bình cầu chứa đầy khí ammonia khô, được úp ngược lên một chậu chứa dung dịch HCl loãng pha dung dịch quỳ có màu hồng. Nước phun lên trong bình cầu và dung dịch trong bình cầu chuyển thành màu xanh. Hiện tượng này xảy ra vì?
-
A.
Acid đã phản ứng với ammonia, làm quỳ đổi màu từ hồng sang xanh.
-
B.
Ammonia là acid yếu, làm quỳ chuyển màu xanh.
-
C.
Ammonia có tính base, tan trong nước nên áp suất giảm, nhờ đó nước có thể phun lên.
-
D.
Acid đã phản ứng khí ammonia trong bình nên áp suất giảm, nhờ đó nước có thể phun lên.
Đáp án : D
Dựa vào kiến thức về Tính chất hóa học của Ammonia.
Ban đầu trong bình chứa đầy khí NH3 khô nên không có sự chênh lệch áp suất nên nước không phun được vào bình
Ammonia có tính base vì vậy phản ứng được với acid tạo muối dạng dung dịch nên làm giảm khí -> giảm áp suất trong bình
PTHH: HCl + NH3 -> NH4Cl
Do vậy áp suất trong bình giảm, nhờ đó nước có thể phun lên
Cho các phát biểu sau:
- Ammonia lỏng được dùng làm chất làm lạnh trong thiết bị.
- Để làm khô khí NH3 có lẫn hơi nước, cho khí NH3 đi qua bình đựng dung dịch H2SO4 đậm đặc.
- Khi cho quỳ tím ẩm vào lọ đựng khí NH3, quỳ tím chuyển thành màu đỏ.
- Nitrogen lỏng được dùng để bảo quản máu và các mẫu vật sinh học.
-
A.
2.
-
B.
1.
-
C.
4.
-
D.
3.
Đáp án : A
Dựa vào kiến thức về Ammonia và Nitrogen.
Ammonia có tính base => làm quỳ chuyển màu xanh và không thể làm khô bằng dung dịch H2SO4 đậm đặc.
H2SO4 + 2NH3 -> (NH4)2SO4
Trong quá trình tổng hợp ammonia theo quy trình Haber (Haber – Bosch), sau khi đã hóa lỏng NH3, hydrogen và nitrogen sẽ:
-
A.
Qua ống dẫn khí thải được loại bổ
-
B.
Đưa trở lại buồng phản ứng để tái sử dụng
-
C.
Tiếp tục qua lò phản ứng số 2 để tăng hiệu suất tổng hợp
-
D.
Hygrogen được tái sử dụng, còn nitrogen loại bỏ dựa vào tỉ trọng
Đáp án : B
Dựa vào kiến thức về quy trình Haber để tổng hợp ammonia
Tại thời điểm cân bằng nồng độ ammonia, nitrigen, hydrogen trong buồng phản ứng không đổi. Hỗn hợp khí này được dẫn qua hệ thống làm lạnh để hóa lỏng ammonia, còn hỗn hợp nitrogen và hydrogen được tái sử dụng bằng cách đưa trở lại buồng phản ứng.
Phương trình phân ly của NH3 trong nước nào sau đây đúng:
-
A.
\(N{H_3}(aq) + {H_2}O(l) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} N{H_3}O{H^ - }(aq) + {H^ + }(aq)\)
-
B.
\(N{H_3}(aq) + {H_2}O(l) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} N{H_2}^ - (aq) + {H_3}{O^ + }(aq)\)
-
C.
\(N{H_3}(aq) + {H_2}O(l) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} N{H_4}^ + (aq) + O{H^ - }(aq)\)
-
D.
\(N{H_3}(aq) + {H_2}O(l) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} N{H_4}OH(l)\)
Đáp án : C
Dựa vào phương trình phân li của NH3 trong nước
\(N{H_3}(aq) + {H_2}O(l) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} N{H_4}^ + (aq) + O{H^ - }(aq)\)
Tính base của NH3 do:
-
A.
Trên N còn cặp electron tự do
-
B.
Phân tử có 3 liên kết cộng hóa trị phân cực
-
C.
NH3 tan được nhiều trong nước
-
D.
NH3 tác dụng với nước tạo NH4OH
Đáp án : A
Dựa vào kiến thức thuyết Bronsted – Lowy về acid và base
Theo thuyết Bronsted – Lowy về base là chất có khả năng nhận proton H+, tức là phân tử NH3 còn cặp electron tự do để nhận proton H+ thể hiện tính base.
Phát biểu nào sau đây không đúng khi nói về ammonia?
-
A.
Trong công nghiệp, ammoina thường được sử dụng với vai trò chất làm lạnh (chất sinh hàn)
-
B.
Do có hàm lượng nitrogen cao (82,35% theo khối lượng) nên ammonia được sử dụng làm phân đạm rất hiệu quả
-
C.
Phần lớn ammonia được dùng phản ứng với acid để sản xuất các loại phân đạm
-
D.
Qúa trình tổng hợp ammonia từ nitrogen và hydrogen là quá trình thuận nghịch nên không thể đạt hiệu suất 100%
Đáp án : B
Dựa vào kiến thức về ammonia
B sai do ammonia là nguyên liệu để sản xuất phân đạm.
Luyện tập và củng cố kiến thức Bài 6: Một số hợp chất của nitrogen với oxygen Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 7: Sulfur và sulfur dioxide Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 8: Sulfuric acid và muối sulfate Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 9: Ôn tập chương 2 Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 4: Nitrogen Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết









