Giải bài tập hóa học 8, Hóa 8 - Để học tốt hóa học 8
Giải bài tập hóa học 8, Hóa 8 - Để học tốt hóa học 8
 Đề kiểm tra 45 phút (1 tiết) - Chương 2 - Hóa học 8
Đề kiểm tra 45 phút (1 tiết) - Chương 2 - Hóa học 8
Đề kiểm tra 45 phút (1 tiết) - Đề số 1 - Chương 2 - Hóa học 8
Đáp án và lời giải chi tiết đề thi kiểm tra 45 phút (1 tiết) - Đề số 3 - Chương 1 - Hóa học 8
Đề bài
Phần trắc nghiệm (3 điểm)
Câu 1. Trong bài thực hành khi làm thí nghiệm phân hủy thuốc tím ở nhiệt độ cao có các hiện tượng:
- Có hơi màu tím thoát ra (I).
- Cho tàn đóm vào tàn đóm bùng cháy ( II).
- Tiếp tục đun nóng thuốc tím, khi thử bằng tàn đóm, thấy tàn đóm không bùng cháy. Để nguội chất rắn thu được rồi hoà tan trong nước, chất này không tan (III).
Hiện tượng nào cho dưới đây là hiện tượng hoá học?
A. Cả I, II, III. B. Chỉ có (I).
C. Chỉ có (II). D. Chỉ có (III).
Câu 2. Khi đốt cháy hợp chất X thu được H2O và SO2. X có chứa các nguyên tố nào sau đây?
A. Hai nguyên tố H, O.
B. Hai nguyên tố H, S.
C. Hai nguyên tố H, S có thể có O.
D. Hai nguyên tố H, N.
Câu 3. Ghép các thí nghiệm ở cột A với hiện tượng ở cột B cho phù hợp:
| Thí nghiệm (A) | Hiện tượng (B) | Trả lời | |
| 1. Cho kẽm tác dụng với dung dịch axit clohiđric | A. có chất rắn màu trắng xuất hiện | 1 với... | |
| 2. Cho dung dịch bari clorua tác dụng với dung dịch natri sunfat. | B. Dung dịch như sôi lên có khí thoát ra | ||
| 3. Trộn bột sắt với bột lưu huỳnh rồi đun nóng. | C. Chất rắn có màu vàng | ||
| 4. Thổi khí cacbonic vào dung dịch nước vôi trong | D. Chất rắn nóng chảy chuyển thành màu đen | ||
| E. Dung dịch có màu xanh | |||
| G. Dung dịch vẩn đục | |||
Câu 4. Cho a gam bột sắt tác dụng với dung dịch có 14,6 gam axit clohiđric HCl sinh ra 25,4 gam muối sắt(II) clorua và 0,4 gam khí hiđro. Giá trị của a là
A. 1,12. B. 1,46.
C. 11,2. D.2,3.
Câu 5. Cho phương trình hoá học: Cu(NO3)2 \(\to\) CuO + NO2 + O2
Hệ số của các chất trong phương trình hoá học là những số nguyên. Tổng hệ số của phương trình là
A. 9. B. 8.
C.10. D. 12.
Câu 6. Cho 26 gam kim loại M (hoá trị II) tác dụng với khí do thu được một sản
phẩm duy nhất là muối MCl2 có khối lượng 54,4 gam. M là kim loại
A.Cu (64). B. Mg (24).
C. Zn (65). D. Ca (40).
Phần tự luận (7 điểm)
Câu 1. (3 điểm)
Hãy chọn hệ số và công thức hoá học thích hợp điền vào chỗ có dấu hỏi trong các phương trình hoá học sau:
|
Fe + |
CuSO4 |
\(\to\) |
Cu + |
? |
|
HC1 + |
CuO |
\(\to\) |
CuCl2 + |
? |
|
Fe(OH)3 |
+ H2SO4 |
\(\to\) |
H2O + |
? |
|
K + |
O2 |
\(\to\) |
? |
|
|
? + |
? |
\(\to\) |
Fe3O4 |
|
|
? + |
? |
\(\to\) |
NO |
|
Câu 2. (1 điểm)
Cho 3,9 gam kim loại K vào 100 gam nước thấy thoát ra 0,1 gam khí hiđro và dung dịch có kali hiđroxit (KOH). Viết phương trình hoá học và tính khối lượng của dung dịch thu được sau phản ứng.
Câu 3. (3 điểm)
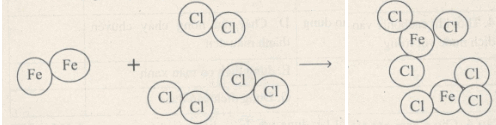
Cho sơ đồ tượng trưng của phản ứng giữa sắt với clo tạo ra muối sắt(III)
Lời giải chi tiết
Phần trắc nghiệm (3 điểm)
Trả lời đúng mỗi câu được 0,5 điểm
Câu 1. C
Câu 2. B
Phương trình dạng tổng quát:
\(X + {O_2} \to S{O_2} + {H_2}O\)
Trong X có H, S.
Câu 3.
|
Thí nghiệm (A) |
Hiện tượng (B) |
Trả lời |
|
1. Cho kẽm tác dụng với dung dịch axit clohiđric |
A. có chất rắn màu trắng xuất hiện |
1 với B |
|
2. Cho dung dịch bari clorua tác dụng với dung dịch natri sunfat. |
B. Dung dịch như sôi lên có khí thoát ra * |
2 với A |
|
3. Trộn bột sắt với bột lưu huỳnh rồi đun nóng. |
C. Chất rắn có màu vàng |
3 với D |
|
4. Thổi khí cacbonic vào dung dịch nước vôi trong |
D. Chất rắn nóng chảy chuyến thành màu đen |
4 với G |
|
|
E. dung dịch có màu xanh |
|
|
* |
G. Dung dịch vẩn đục |
|
|
|
||
Câu 4. C Câu 5. A Câu 6. C
Phần tự luận (7 điểm)
Câu 1
\(\eqalign{
& Fe + CuS{O_4} \to Cu + FeS{O_4} \cr
& 2HCl + CuO \to CuC{l_2} + {H_2}O \cr
& 2Fe{\left( {OH} \right)_3} + 3.{H_2}S{O_4} \to 3{H_2}O + F{e_2}{\left( {S{O_4}} \right)_3} \cr
& 4K + {O_2} \to 2{K_2}O \cr
& 3Fe + 2{O_2} \to F{e_3}{O_4} \cr
& {N_2} + {O_2}\buildrel {{t^o}cao} \over
\longrightarrow 2NO \cr} \)
\(\eqalign{
& Fe + CuS{O_4} \to Cu + FeS{O_4} \cr
& 2HCl + CuO \to CuC{l_2} + {H_2}O \cr
& 2Fe{\left( {OH} \right)_3} + 3.{H_2}S{O_4} \to 3{H_2}O + F{e_2}{\left( {S{O_4}} \right)_3} \cr
& 4K + {O_2} \to 2{K_2}O \cr
& 3Fe + 2{O_2} \to F{e_3}{O_4} \cr
& {N_2} + {O_2}\buildrel {{t^o}cao} \over
\longrightarrow 2NO \cr} \)
Câu 2. (1 điểm)
Phương trình hoá học:
\(2K + 2{H_2}O \to 2KOH + {H_2}.\)
mđd = mK + mnước - mhiđrô = 3,9 + 100- 0,1 = 103,8 (gam).
Khối lượng dung dịch sau phản ứng = 103,8 (gam).
Câu 3. (3 điểm)
Trong phản ứng đơn chất là Fe, Cl2, hợp chất là FeCl3
- Các nguyên tử Fe tách rời nhau, phân tử Cl2 cũng chia thành 2 nguyên tử.
Như vậy phân tử Cl2 biến đổi, kết quả là phân tử FeCl3 được tạo thành từ một nguyên tử Fe và 3 nguyên tử Cl.
- Số nguyên tử của mỗi nguyên tố không thay đổi.
Loigiaihay.com
Các bài khác cùng chuyên mục