Lý thuyết bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Tốc độ phản ứng, phương trình và hằng số tốc độ phản ứng
Lý thuyết: Tốc độ phản ứng
I. Tốc độ phản ứng hóa học
- Tốc độ phản ứng hóa học dùng để đánh giá mức độ xảy ra nhanh hay chậm của một phản ứng
- Tốc độ phản ứng được xác định bằng sự thay đổi lượng chất đầu hoặc chất sản phẩm trong một đơn vị thời gian: giây (s), phút (min), giờ (h), ngày (d),… Lượng chất có thể được biểu diễn bằng số mol, nồng độ mol, khối lượng, hoặc thể tích


- Đa số các phản ứng hóa học có tốc độ giảm dần theo thời gian. Để đặc trưng cho sự nhanh chậm của phản ứng trong một khoảng thời gian, ta dùng tốc độ phản ứng trung bình.
- Xét phản ứng tổng quát: aA + bB → cC + dD
Gọi ∆CA, ∆CB, ∆CC, ∆CD lần lượt là biến thiên lượng chất các chất A, B, C, D trong khoảng thời gian ∆t. Tốc độ trung bình của phản ứng được tính theo công thức
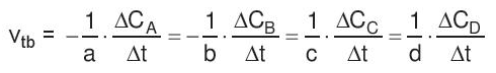
II. Biểu thức tốc độ phản ứng
- Các phản ứng diễn ra với tốc độ khác nhau tùy thuộc vào nhiều yếu tố: nồng độ, nhiệt độ, áp suất đối với đối với chất tham gia là chất khí, bề mặt tiếp xúc, chất xúc tác, cường độ ánh sáng, thể của chất, dung môi hòa tan các chất phản ứng
- Ở nhiệt độ không đổi, tốc độ phản ứng tỉ lệ với tích số nồng độ các chất tham gia phản ứng với số mũ thích hợp
aA + bB → cC + dD
- Biểu thức tốc độ phản ứng:
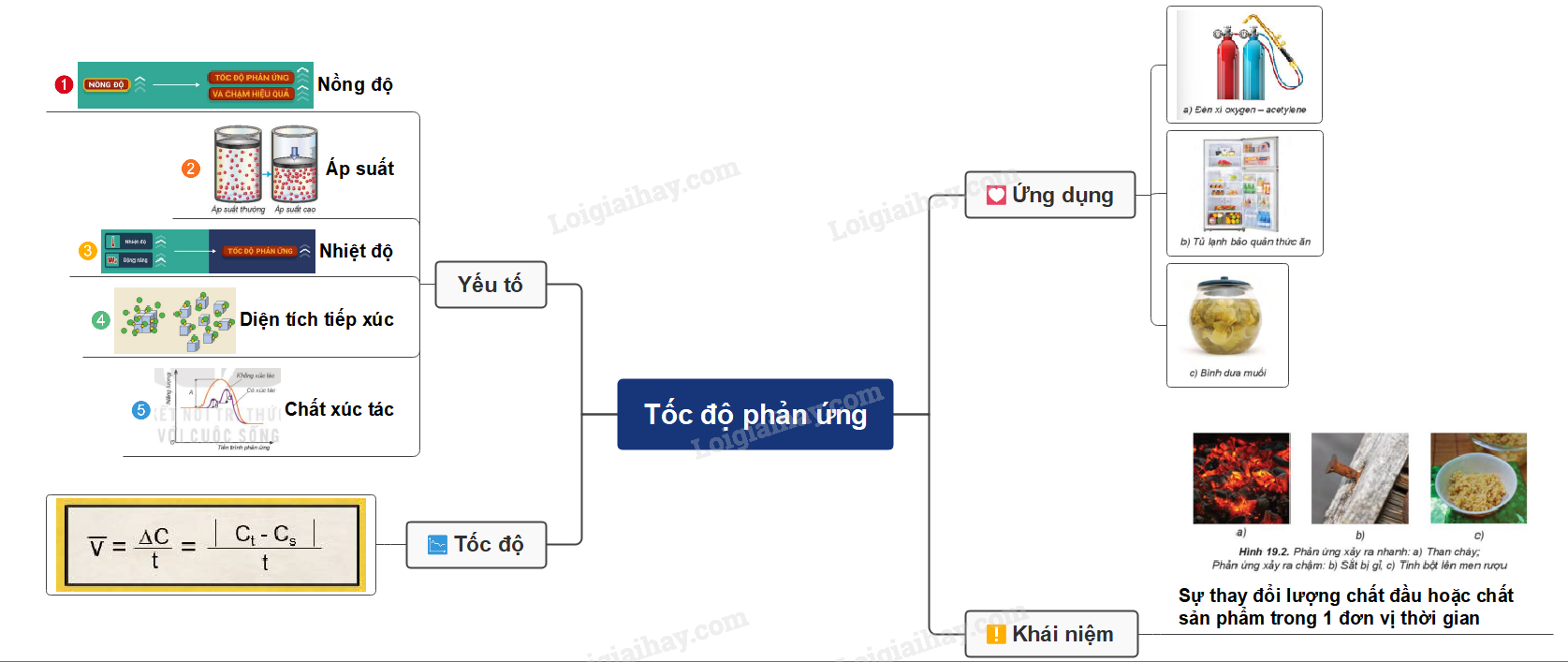
Sơ đồ tư duy:
Luyện Bài Tập Trắc nghiệm Hóa 10 - Chân trời sáng tạo - Xem ngay
Các bài khác cùng chuyên mục
- Lý thuyết bài 18: Hydrogen halide và một số phản ứng của ion Halide
- Lý thuyết bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA
- Lý thuyết bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
- Lý thuyết bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
- Lý thuyết bài 14: Tính biến thiên enthalpy của phản ứng hóa học
- Lý thuyết bài 18: Hydrogen halide và một số phản ứng của ion Halide
- Lý thuyết bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA
- Lý thuyết bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
- Lý thuyết bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
- Lý thuyết bài 14: Tính biến thiên enthalpy của phản ứng hóa học





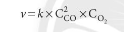







Danh sách bình luận