Cho bảng số liệu sau đây:
|
Nguyên tử |
Bán kính (pm) |
Ion |
Bán kính (pm) |
|
Na |
186 |
Na+ |
98 |
|
K |
227 |
K+ |
? |
Dựa trên xu hướng biến đổi tuần hoàn và dữ liệu trong bảng trên, giá trị nào sau đây là phù hợp nhất với bán kính ion K+?
A. 90 pm.
B. 133 pm.
C. 195 pm.
D. 295 pm.
Dựa vào điện tích hạt nhân càng lớn càng hút electron mạnh → bán kính càng nhỏ và ngược lại nên:
- Bán kính các cation nhỏ hơn nhiều so với bán kính nguyên tử tương ứng
- Bán kính các anion lớn hơn nhiều so với bán kính nguyên tử tương ứng
- Bán kính của K > bán kính của Na
→ Bán kính ion K+ > bán kính ion Na+
- Do bán kính các cation nhỏ hơn nhiều so với bán kính nguyên tử tương ứng
→ Đáp án: B

Các bài tập cùng chuyên đề
Dựa vào bảng tuần hoàn, hãy so sánh và giải thích sự khác nhau về bán kính nguyên tử của
a) lithium (Z = 3) và potassium (Z = 19).
b) calcium (Z = 20) và selenium ( Z = 34)
Một hạt nhân có điện tích là +Z sẽ hút electron bằng một lực với độ lớn $F\, = \,a\frac{Z}{{{r^2}}}$, trong đó: r là khoảng cách từ hạt nhân tới electron, a là một hằng số. Hãy cho biết:
a) Điện tích hạt nhân càng lớn thì lực hút electron càng mạnh hay yếu?
b) Khoảng cách giữa electron và hạt nhân càng lớn thì electron bị hạt nhân hút càng mạnh hay càng yếu?
Các nguyên tố chu kì 2 có bao nhiêu lớp electron? Vẽ mô hình nguyên tử theo Rutherford – Bohr của Li và F để giải thích về sự khác biệt bán kính nguyên tử.
Quan sát hình 7.2, cho biết quy luật biến đổi bán kính nguyên tử của các nguyên tố ở chu kì 3, 4, 5 theo chiều tăng dần điện tích hạt nhân.
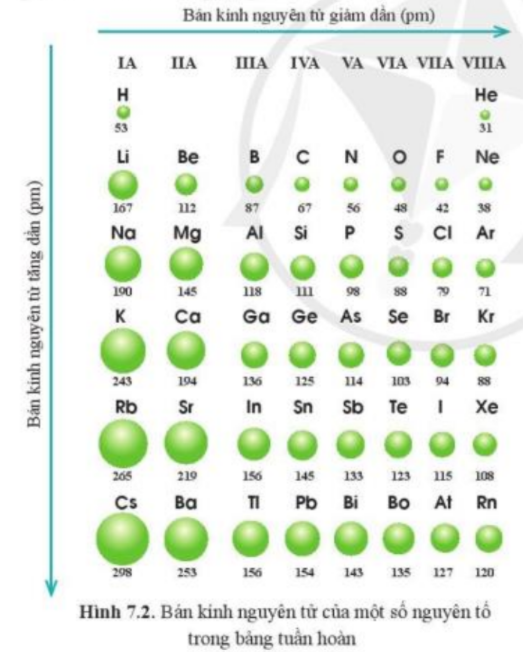
Hãy giải thích vì sao nguyên tử He là nguyên tử nguyên tố có kích thước nhỏ nhất trong bảng tuần hoàn mà không phải nguyên tử H.
Quan sát Hình 6.1, cho biết bán kính nguyên tử của các nguyên tố trong mỗi chu kì và trong mỗi nhóm A biến đổi như thế nào.
Xu hướng biến đổi bán kính nguyên tử của các nguyên tố trong mỗi chu kì và trong mỗi nhóm A do yếu tố nào gây ra? Giải thích
Dựa vào xu hướng biến đổi bán kính nguyên tử của các nguyên tố trong bảng tuần hoàn, em hãy sắp xếp các nguyên tố sau đây theo chiều tăng dần bán kính nguyên tử: Li, N, O, Na, K.
Nguyên tử của nguyên tố nào sau đây có bán kính nhỏ nhất?
A. Si (Z = 14)
B. P (Z = 15)
C. Ge (Z = 32)
D. As (Z = 33)
Trong liên kết H-X (với X là F, Cl, Br), cặp electron trong liên kết sẽ bị lệch về nguyên tử X do chúng có độ âm điện lớn hơn H. Hãy sắp xếp các nguyên tử X theo chiều giảm dần mức độ lệch của cặp electron liên kết về phía nó.
A. Br > Cl > F.
B. Cl > F > Br.
C. F > Cl > Br.
D. Mức độ lệch của cặp electron là như nhau trong ba trường hợp.
Dãy các ion nào sau đây có bán kính tăng dần?
A. S2- < Cl- < K+ < Ca2+.
B. K+ < Ca2+ < S2- < Cl-.
C. Cl- < S2- < Ca2+ < K+.
D. Ca2+ < K+ < Cl- < S2-.
Dãy nguyên tử nào sau đây có bán kính tăng dần?
A. F < S < Si < Ge < Ca < Rb.
B. F < Si < S < Ca < Ge < Rb.
C. Rb < Ca < Ge < Si < S < F.
D. F < Si < S < Ge < Ca < Rb.
Chọn nguyên tử có bán kính lớn hơn trong mỗi cặp nguyên tử nguyên tố sau:
a) Al và In.
b) Si và N.
c) P và Pb.
d) C và F.
Quan sát hình sau:
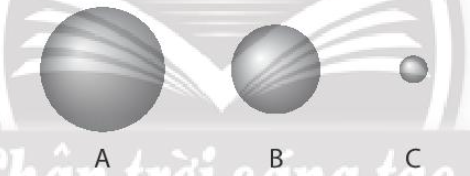
3 quả cầu A, B, C tượng trưng cho nguyên tử các nguyên tố helium, krypton và radon. Quả cầu nào là krypton?
Nguyên tử của nguyên tố nào có bán kính lớn nhất trong các nguyên tử sau đây?
A. Al.
B. P.
C. S.
D. K.
Dãy nguyên tố nào sau đây sắp xếp theo chiều tăng dần của bán kính nguyên tử?
A. Be, F, O, C, Mg.
B. Mg, Be, C, O, F.
C. F, O, C, Be, Mg.
D. F, Be, C, Mg, O.
Cho các nguyên tố X, Y, Z có số hiệu nguyên tử lần lượt là 6, 9, 14.
a) Xác định vị trí của các nguyên tố đó trong bảng tuần hoàn.
b) Xếp các nguyên tố đó theo thứ tự bán kính nguyên tử tăng dần.
c) Xếp các nguyên tố đó theo thứ tự độ âm điện giảm dần.
d) Xếp các nguyên tố đó theo thứ tự tính phi kim tăng dần.
Cho các nguyên tố X, Y, Z và T với số hiệu nguyên tử lần lượt là 9, 17, 33 và 35. Hãy sắp xếp thứ tự tăng dần độ âm điện và giải thích.
Cho các nguyên tố sau: K (Z = 19), N (Z = 7), Si (Z = 14), Mg (Z = 12). Hãy sắp xếp các nguyên tố trên theo chiều giảm dần bán kính nguyên tử.
Cho các nguyên tố sau: K (Z = 19), N (Z = 7), Si (Z = 14), Mg (Z = 12). Dãy gồm các nguyên tố được sắp xếp theo chiều giảm dần bán kính nguyên tử từ trái sang phải là
A. N, Si, Mg, K.
B. Mg, K, Si, N.
C. K, Mg, N, Si.
D. K, Mg, Si, N.
Cho các nguyên tố sau 3Li, 8O, 9F, 11Na. Dãy gồm các nguyên tổ được sắp xếp theo chiều tăng dần bán kính nguyên tử từ trái sang phải là
A. F, O, Li, Na.
B. F, Na, O, Li.
C. F, Li, O, Na.
D. Li, Na, O, F
Thứ tự tăng dần bán kính nguyên tử là
A. Li, Be, F, Cl.
B. Be, Li, F, Cl.
C. F, Be, Li, Cl.
D. Cl, F, Li, Be.
Phát biểu nào sau đây không đúng?
A. Nguyên tử có bán kính nhỏ nhất có Z = 1.
B. Kim loại yếu nhất trong nhóm IA có Z = 3.
C. Nguyên tố có độ âm điện lớn nhất có Z = 9.
D. Phi kim mạnh nhất trong nhóm VA có Z = 7.
Cho các nguyên tố sau: Li, Na, K, Ca. Nguyên tử của nguyên tố có bán kính bé nhất là
A. Li.
B. Na.
C. K.
D. Cs.
Phát biểu nào sau đây không đúng?
A. Nguyên tử có Z = 11 có bán kính nhỏ hơn nguyên tử có Z = 19.
B. Nguyên tử có Z = 12 có bán kính lớn hơn nguyên tử có Z = 10.
C. Nguyên tử có Z = 11 có bán kính nhỏ hơn nguyên tử có Z = 13.
D. Các nguyên tố kim loại kiềm có bán kính nguyên tử lớn nhất trong chu kì.
Cấu hình electron hóa trị của nguyên tử các nguyên tố nhóm IIA trong bảng tuần hoàn đều là
A. np2.
B. ns2.
C. ns2np2.
D. ns2np4.
Đại lượng nào sau đây trong nguyên tử của các nguyên tố biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử?
A. Số lớp electron.
B. Số electron ở lớp ngoài cùng.
C. Nguyên tử khối.
D. Số electron trong nguyên tử.
Dãy các nguyên tố nào sau đây sắp xếp theo chiều tăng dần bán kính nguyên tử ?
A. C, F, Ca, O, Be.
B. Ca, Be, C, O, F.
C. F, O, C, Be, Ca.
D. O, C, F, Ca, Be.
Hãy so sánh và giải thích kích thước tương đối của:
a) nguyên tử lithium và nguyên tử fluorine.
b) nguyên tử lithium và ion của nó (Li+).
c) nguyên tử oxygen và ion của nó (O2-).
d) ion nitride (N3-) và ion fluoride (F-).
Cho các nguyên tố sau: 11Na, 13Al và 17Cl. Các giá trị bán kính nguyên tử (pm) tương ứng trong trường hợp nào sau đây là đúng?
A. Na (157); Al (125); Cl (99).
B. Na (99); Al (125); Cl (157).
C. Na (157); Al (99); Cl (125).
D. Na (125); Al (157); Cl (99).







Danh sách bình luận