Xét cân bằng hoá học: \({\rm{N}}{{\rm{H}}_{\rm{3}}} + {{\rm{H}}_{\rm{2}}}{\rm{O}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{NH}}_4^ + + {\rm{O}}{{\rm{H}}^ - }\)
Cân bằng sẽ chuyển dịch theo chiều thuận khi cho thêm vài giọt dung dịch nào sau đây?
A.NH4Cl. B. NaOH. C. HCl. D. NaCl.
Nguyên lí Le Chatelier: Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động đó.
Xét cân bằng hoá học: \({\rm{N}}{{\rm{H}}_{\rm{3}}} + {{\rm{H}}_{\rm{2}}}{\rm{O}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{NH}}_4^ + + {\rm{O}}{{\rm{H}}^ - }\)
Khi thêm vài giọt dung dịch NH4Cl, nồng độ của ion \({\rm{NH}}_4^ + \)tăng, cân bằng chuyển dịch theo chiều làm giảm nồng độ ion \({\rm{NH}}_4^ + \), cân bằng chuyển dịch theo chiều nghịch.
Khi thêm vài giọt dung dịch NaOH, nồng độ của ion \({\rm{O}}{{\rm{H}}^ - }\)tăng, cân bằng chuyển dịch theo chiều làm giảm nồng độ ion \({\rm{O}}{{\rm{H}}^ - }\), cân bằng chuyển dịch theo chiều nghịch.
Khi thêm vài giọt dung dịch HCl, nồng độ của ion \({\rm{O}}{{\rm{H}}^ - }\)giảm (vì xảy ra phản ứng \({{\rm{H}}^ + } + {\rm{O}}{{\rm{H}}^ - } \to {{\rm{H}}_{\rm{2}}}{\rm{O}}\)), cân bằng chuyển dịch theo chiều làm tăng nồng độ ion \({\rm{O}}{{\rm{H}}^ - }\), cân bằng chuyển dịch theo chiều thuận.
Khi thêm vài giọt dung dịch NaCl, cân bằng không bị chuyển dịch.
→ Chọn C.

Các bài tập cùng chuyên đề
- Vận dụng được kiến thức về cân bằng hoá học, tốc độ phản ứng, enthalpy cho phản ứng tổng hợp ammonia trong quá trình Haber – Bosch.
- Nhận biết được ion ammonium trong phân đạm.
Quan sát Hình 4.5, cho biết trạng thái, màu sắc của muối ammonium chloride và đặc tính liên kết của phân tử.
Quan sát Thí nghiệm, nếu hiện tượng xảy ra. Giải thích. Viết phương trình hoá học khi cho NH4Cl, NH4NO3, (NH4)2SO4 tác dụng với dung dịch NaOH
Đun nóng NH4Cl (Hình 4.6) thấy có hiện tượng khói trắng trong ống nghiệm. Giải thích.
Viết phương trình hoá học khi cho dung dịch (NH4)2CO3 tác dụng với các dung dịch KOH, HCl, Ba(OH)2, CaCl2.
NH4HCO3 thường được dùng làm bột nở trong sản xuất bánh bao. Giải thích.
Hãy giải thích vì sao các loại phân bón như NH4Cl, NH4NO3, (NH4)2SO4 không thích hợp bón cho đất chua.
Có thể nhận biết muối ammonium bằng cách cho muối tác dụng với dung dịch kiềm thấy thoát ra một chất khí. Chất khí đó là
A. NH3. B. H2. C. NO2. D. NO.
Viết phương trình hoá học của các phản ứng xảy ra khi cho dung dịch (NH4)2SO4 tác dụng với dung dịch NaOH, dung dịch Ba(OH)2, dung dịch BaCl2, dung dịch Ba(NO3)2.
Để giảm sốt hoặc giảm đau, người ta có thể dùng túi chườm lạnh chứa hoá chất. Hãy tìm hiểu về loại túi chườm lạnh này. Từ đó:
a) Cho biết các chất thường được sử dụng trong túi chườm lạnh.
b) Giải thích nguyên nhân giúp túi chườm lạnh có nhiệt độ thấp.
Lượng lớn ammonium nitrate và ammonium chloride được sử dụng làm phân bón. Dựa vào đặc điểm phản ứng nhiệt phân của hai muối này, hãy cho biết muối nào có nguy cơ cháy nổ cao hơn trong quá trình lưu trữ.
Tại một nhà máy phân bón, ammophos được sản xuất từ ammonia và phosphoric acid, thu được NH4H2PO4 và (NH4)2HPO4 với tỉ lệ mol là 1 : 1.
a) Viết các phương trình hoá học.
b) Tính thể tích khí ammonia (đkc) cần dùng để tác dụng vừa đủ với dung dịch chứa 5,88 tấn phosphoric acid. Tính khối lượng ammophos thu được.
a) Viết phương trình hoá học xảy ra khi cho dung dịch (NH4)2CO3 lần lượt tác dụng với lượng dư các dung dịch: HCl, Ba(OH)2.
b) Trình bày phương pháp hoá học phân biệt ba dung dịch: NH4NO3, KNO3, NH4Cl.
Xét cân bằng hoá học: \({\rm{N}}{{\rm{H}}_{\rm{3}}} + {{\rm{H}}_{\rm{2}}}{\rm{O}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{NH}}_4^ + + {\rm{O}}{{\rm{H}}^ - }\)
Hằng số cân bằng (KC) của phản ứng được biểu diễn bằng biểu thức nào sau đây?
A.\({{\rm{K}}_{\rm{C}}} = \frac{{[{\rm{NH}}_4^ + ][{\rm{O}}{{\rm{H}}^ - }]}}{{[{\rm{N}}{{\rm{H}}_{\rm{3}}}]}}\). B. \({{\rm{K}}_{\rm{C}}} = \frac{{[{\rm{NH}}_4^ + ][{\rm{O}}{{\rm{H}}^ - }]}}{{[{\rm{N}}{{\rm{H}}_{\rm{3}}}][{{\rm{H}}_{\rm{2}}}{\rm{O}}]}}\).
C. \({{\rm{K}}_{\rm{C}}} = \frac{{[{\rm{NH}}_4^ + ][{\rm{O}}{{\rm{H}}^ - }]}}{{[{{\rm{H}}_{\rm{2}}}{\rm{O}}]}}\). D. \({{\rm{K}}_{\rm{C}}} = \frac{{[{\rm{NH}}_4^ + ]}}{{[{\rm{N}}{{\rm{H}}_{\rm{3}}}]}}\).
Phát biểu nào sau đây không đúng?
A. Ammonia là base Brønsted khi tác dụng với nước.
B. Ammonia được sử dụng là chất làm lạnh.
C. Muối ammonium là tinh thể ion, dễ tan trong nước.
D. Các muối ammonium đều rất bền với nhiệt.
Phân biệt được dung dịch NH4Cl và NaCl bằng thuốc thử là dung dịch
A. KCl. B. KNO3. C. KOH. D. K2SO4.
Nhiệt phân hoàn toàn muối nào sau đây thu được sản phẩm chỉ gồm khí và hơi?
A. NaCl. B. CaCO3. C. KClO3. D. (NH4)2CO3.
Hợp chất có công thức hoá học NH4NO3 được giới chức quốc gia Lebanon xác định là nguyên nhân gây ra vụ nổ thảm khốc ở thủ đô Beirut vào ngày 04/08/2020. Tia lửa hàn trong quá trình sửa chữa nhà kho có thể đã làm 2 750 tấn NH4NO3 cất trữ phát nổ, phá huỷ nhiều nhà cửa, dẫn đến nhiều người thiệt mạng. Hãy giải thích vì sao NH4NO3 có khả năng phát nổ.
Hiện nay người ta sản xuất ammonia bằng cách chuyển hoá có xúc tác một hỗn hợp gồm không khí, hơi nước và khí methane (thành phần chính của khí thiên nhiên).
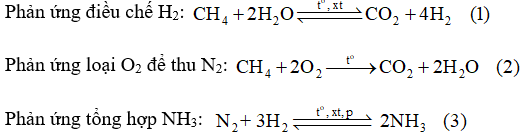
Để sản xuất khí ammonia, nếu lấy 841,7 m3 không khí (chứa 21,03% O2; 78,02% N2, còn lại là khí hiếm theo thể tích), thì cần phải lấy bao nhiêu m3 khí methane và bao nhiêu m3 hơi nước để có đủ lượng N2 và H2 theo tỉ lệ 1 : 3 về thể tích dùng cho phản ứng tổng hợp ammonia. Giả thiết các phản ứng (1), (2) đều xảy ra hoàn toàn và các thể tích khí đo ở cùng điều kiện.
Muối NH4NO3 sẽ nhiệt phân theo phản ứng nào trong 2 phản ứng sau?
Biết enthalpy tạo thành chuẩn của các chất có giá trị như sau:
|
Chất |
NH4NO3(s) |
NH3(g) |
N2O(g) |
HNO3(g) |
H2O(g) |
|
\[{\Delta _{\rm{f}}}{\rm{H}}_{298}^0\](kJ/mol) |
-365,61 |
-45,90 |
82,05 |
-134,31 |
-241,82 |
Trong các nhận xét dưới đây về muối ammonium, nhận xét nào đúng?
A. Muối ammonium tồn tại dưới dạng tinh thể ion, phân tử gồm cation ammonium và anion hydroxide.
B. Tất cả muối ammonium đều dễ tan trong nước, khi tan điện li hoàn toàn thành cation ammonium và anion gốc acid.
C. Dung dịch muối ammonium phản ứng với dung dịch base đặc, nóng thoát ra chất khí làm quỳ tím ẩm hoá đỏ.
D. Khi nhiệt phân các muối ammonium luôn có khí NH3 thoát ra.
Cho hỗn hợp khí (X) gồm N2, H2, NH3 có tỉ khối so với khí hydrogen là 8. Dẫn hỗn hợp khí (X) đi qua dung dịch H2SO4 đặc, dư thì thể tích khí còn lại một nửa. Thành phần % theo thể tích mỗi khí trong hỗn hợp (X) lần lượt là
A. 25% N2, 25% H2 và 50% NH3.
B. 25% N2, 50% H2 và 25% NH3.
C. 50% N2, 25% H2 và 25% NH3.
D. 20% N2, 30% H2 và 50% NH3.
Để tạo độ xốp cho một số loại bánh, có thể dùng chất nào sau đây?
A. (NH4)3PO4. B. NH4HCO3. C. CaCO3. D. NaCl.
Cho hai quá trình sau:
\(N{H_4}N{O_3}(s) \to {N_2}O(g) + 2{H_2}O(g)\) \({\Delta _r}H_{298}^0 = - 36kJ\)
\(N{H_4}Cl(s) \to N{H_3}(g) + HCl(g)\) \({\Delta _r}H_{298}^0 = 176kJ\)
Ammonium nitrate và ammonium chloride được sử dụng làm phân bón. Trong quá trình lưu giữ, dưới ảnh hưởng của nhiệt, phân bón nào có nguy cơ cháy, nổ cao hơn? Giải thích.
Cho một ít tinh thể muối X vào ống nghiệm và đun nóng trên ngọn lửa đèn cồn, sau một thời gian thấy không còn chất rắn nào ở đáy ống nghiệm. Muối X có thể là muối nào sau đây?
A. NaCl. B. CaCO3. C. KClO3. D. NH4Cl.
Sơ đồ quy trình dưới đây mô tả các bước trong quá trình sản xuất một số loại phân bón. Hãy xác định các chất (A), (X), (Y), (Z), (Q). Viết các phản ứng hoá học xảy ra.
Không khí → (A)
Methane → (X)
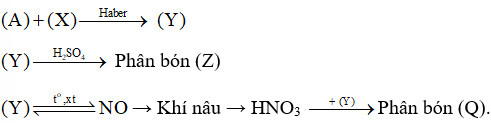
A. Muối ammonium tồn tại dưới dạng tinh thể ion, phân tử gồm cation ammonium và anion hydroxide.
B. Tất cả muối ammonium đều dễ tan trong nước, khi tan điện li hoàn toàn thành cation ammonium và anion gốc acid.
C. Dung dịch muối ammonium phản ứng với dung dịch base đặc, nóng thoát ra chất khí làm quỳ tím ẩm hoá đỏ.
D. Khi nhiệt phân các muối ammonium luôn có khí NH3 thoát ra.
A. 2,479.
B. 3,7185.
C. 4,958.
D. 7,437.
(1) Các muối nitrate đều tan trong nước và đều là chất điện li mạnh.
(2) Ion NO3- có tính oxi hóa trong môi trường acid.
(3) Khi nhiệt phân muối nitrate rắn ta đều thu được khí NO2.
(4) Hầu hết muối nitrate đều bền nhiệt.
Trong các mệnh đề trên, những mệnh đề đúng là
A. (1) và (3).
B. (2) và (4).
C. (2) và (3).
D. (1) và (2).
Chọn nhận định về muối ammonium ?
Muối ammonium bền với nhiệt.
Các muối ammonium đều là chất điện li mạnh.
Tất cả các muối ammonium đều tan trong nước.
Các muối ammonium đều không bị thủy phân trong nước.







Danh sách bình luận