Almelec là hợp kim của aluminium với một lượng nhỏ magnesium và silicon (98,8% aluminium; 0,7% magnesium và 0,5 % silicon). Almelec được sử dụng làm dây điện cao thế do nhẹ, dẫn điện tốt và bền. Dựa vào bảng tuần hoàn các nguyên tố hóa học, hãy:
a) Sắp xếp theo thứ tự tăng dần về bán kính nguyên tử các nguyên tố hóa học có trong almelec.
b) Cho biết thứ tự giảm dần về độ âm điện của các nguyên tố hóa học có trong almelec.
- Trong một chu kì, bán kính nguyên tử giảm theo chiều tăng dần của điện tích hạt nhân.
- Trong một nhóm A, bán kính nguyên tử tăng theo chiều tăng dần của điện tích hạt nhân
- Độ âm điện tăng từ trái qua phải trong một chu kì.
- Độ âm điện giảm dần từ trên xuống dưới trong một nhóm.
a) Mg (Z = 12 ), Al (Z = 13) và Si (Z = 14) cùng nằm ở chu kì 3 => bán kính nguyên tử tăng dần theo thứ tự: Si, Al, Mg.
b) Mg (Z = 12 ), Al (Z = 13) và Si (Z = 14) cùng nằm ở chu kì 3 => độ âm điện của các nguyên tố theo thứ tự giảm dần: Si, Al, Mg.

Các bài tập cùng chuyên đề
Dãy các nguyên tố được sắp xếp theo thứ tự độ âm điện tăng dần là Ca, Mg, P, S. Hãy giải thích sự sắp xếp này dựa trên sự biến đổi độ âm điện theo chu kì và nhóm A.
Dựa vào bảng tuần hoàn các nguyên tố hóa học, sắp xếp các nguyên tố Ba, Mg, Ca, Sr theo thứ tự giảm dần tính kim loại và giải thích.
Trong các nguyên tố O, F, Cl Se, nguyên tố có tính phi kim mạnh nhất là
A. O.
B. F.
C. Se.
D. Cl.
Cho vị trí của các nguyên tố E, T, Q, X, Y trong bảng tuần hoàn rút gọn (chỉ biểu diễn các nguyên tố nhóm A) như sau:

Có các nhận xét sau:
(1) Thứ tự giảm dần tính kim loại Y, E, X.
(2) Thứ tự tăng dần độ âm điện là Y, X, T.
(3) Thứ tự giảm dần tính phi kim là T, Q.
(4) Thứ tự giảm dần bán kính nguyên tử là Y, E, X, T.
Số nhận xét đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Borax (Na2B4O7.10H2O), còn gọi là hàn the, là khoáng chất dạng tinh thể. Nhờ có khả năng hòa tan oxide của kim loại, borax được dùng để làm sạch bề mặt kim loại trước khi hàn, chế tạo thủy tinh quang học, men đồ sứ,… Một lượng lớn borax được dùng để sản xuất bột giặt.
a) Nêu vị trí trong bảng tuần hoàn của mỗi nguyên tố có trong thành phần của borax và viết cấu hình electron của nguyên tử các nguyên tố đó.
b) Sắp xếp các nguyên tố trên theo chiều bán kính nguyên tử tăng dần và giải thích.
c) Sắp xếp các nguyên tố trên theo chiều độ âm điện giảm dần và giải thích.
Công thức cấu tạo của phân tử cafein, một chất gây đắng tìm thấy nhiều trong cafe và trà được biểu diễn ở hình bên
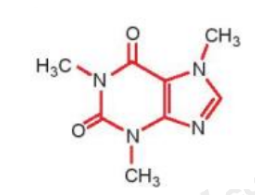
a) Nêu vị trí của các nguyên tố tạo nên cafein trong bảng tuần hoàn.
b) So sánh tính phi kim, bán kính nguyên tử và độ âm điện của các nguyên tố đó (trừ H) và giải thích
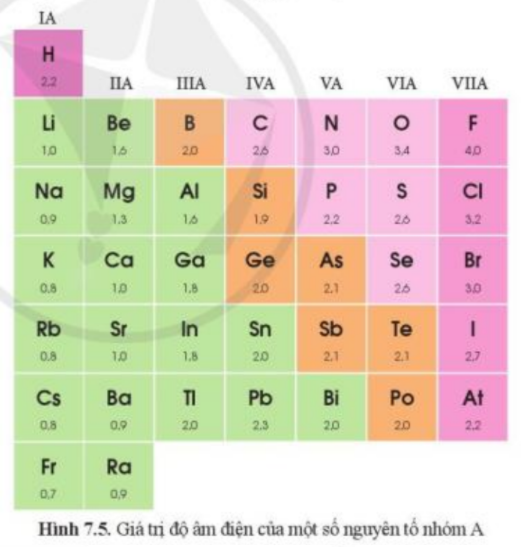
Dựa vào hình 7.5, hãy nhận xét quy luật chung về sự biến đổi độ âm điện của các nguyên tử nguyên tố nhóm A trong một chu kì, trong một nhóm.
Cặp electron liên kết của phân tử H2 có bị lệch về nguyên tử nào không? Vì sao?
Cặp electron liên kết bị lệch nhiều hơn trong phân tử NH3 hay trong phân tử H2O? Vì sao?
Không dùng bảng độ âm điện, hãy so sánh độ âm điện của nguyên tố X có Z = 14 và nguyên tố Y có Z = 16. Giải thích.
Giải thích nguyên nhân của quy luật biến đổi tính phi kim trong một chu kì, một nhóm.
Sắp xếp các nguyên tố sau theo chiều tăng dần tính phi kim: O, S, F. Giải thích
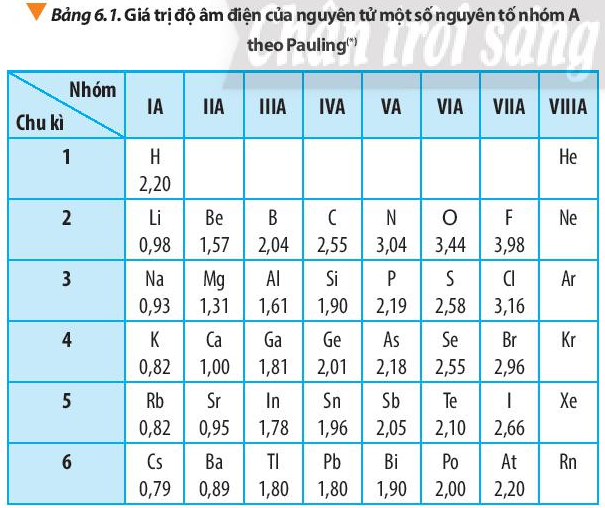
Từ số liệu trong Bảng 6.1, nhận xét sự biến đổi giá trị độ âm điện của nguyên tử các nguyên tố trong một nhóm A và trong một chu kì. Giải thích
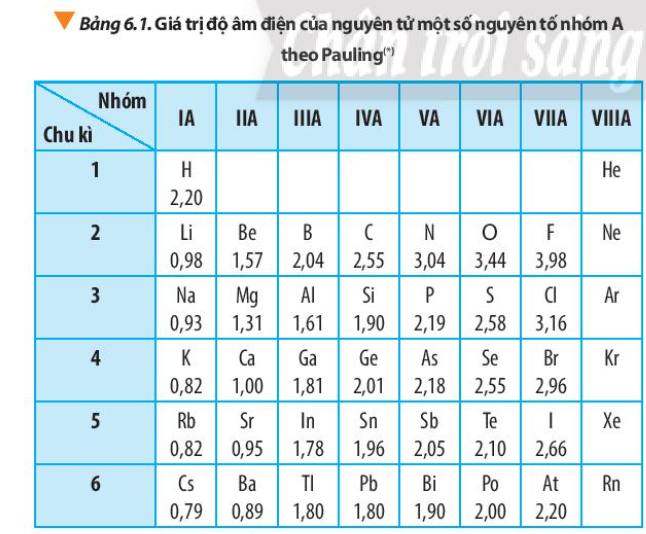
Hãy cho biết vì sao trong Bảng 6.1, giá trị độ âm điện của nguyên tử các nguyên tố nhóm VIIIA còn để trống
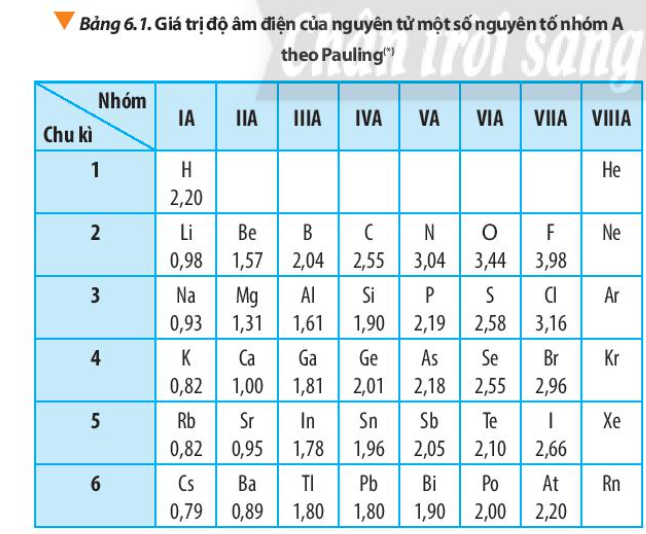
Dựa vào xu hướng biến đổi độ âm điện của nguyên tử các nguyên tố trong bảng tuần hoàn, em hãy sắp xếp các nguyên tố sau đây theo chiều tăng dần độ âm điện của nguyên tử: Na, K, Mg, Al
Giải thích sự hình thành ion Na+ và ion F-
Khả năng nhường hoặc nhận electron hóa trị của các nguyên tử các nguyên tố nhóm A thay đổi như thế nào khi:
a) đi từ đầu chu kì đến cuối chu kì?
b) đi từ đầu nhóm đến cuối nhóm?
Dựa vào xu hướng biến đổi tính kim loại – phi kim của các nguyên tố trong bảng tuần hoàn, hãy sắp xếp các nguyên tố sau đây theo chiều giảm dần tính kim loại: sodium, magnesium và potassium
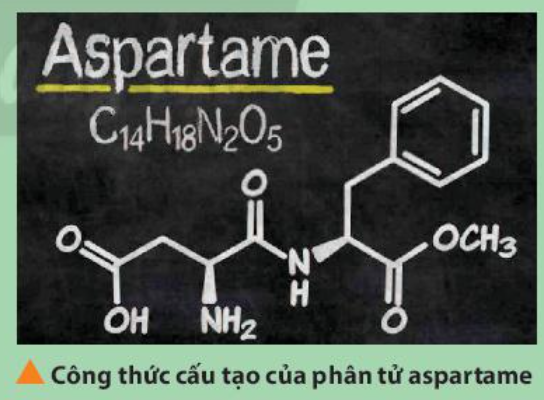
Aspartame là một chất làm ngọt nhân tạo, được sử dụng trong một số loại soda dành cho người ăn kiêng. Xác định vị trí của các nguyên tố tạo nên aspartame trong bảng tuần hoàn. Trong số các nguyên tố đó, nguyên tố nào có tính phi kim mạnh nhất?
Bốn nguyên tố D, E, M, Q cùng thuộc một nhóm A trong bảng tuần hoàn, có số hiệu nguyên tử lần lượt là 9, 17, 35, 53. Các nguyên tố này được sắp xếp theo chiều tính phi kim tăng dần theo dãy nào sau đây?
A. D, Q, E, M
B. Q, M, E, D
C. D, E, M, Q
D. D, M, E, Q
Trong bảng tuần hoàn các nguyên tố hóa học, cho biết nguyên tố nào có tính phi kim mạnh nhất. Giải thích.
Cho bảng số liệu sau:

Hãy vẽ đồ thị hoặc biểu đồ với hai đại lượng bán kính nguyên tử và độ âm điện trong bảng số liệu trên. Quan sát và cho biết hai đại lượng này biến thiên như thế nào? Giải thích.
Ghép từng nhóm đặc điểm ở cột A với một phần tử tương ứng trong cột B.
|
Cột A |
Cột B |
|
a) Một khí hoạt động rất mạnh, nguyên tử có độ âm điện lớn: |
1. Sodium (Na) |
|
b) Một kim loại mềm: nguyên tử rất dễ nhường electron: |
2. Antimony (Sb) |
|
c) Một nguyên tố vừa thể hiện tính kim loại, vừa thể hiện tính phi kim, tạo thành oxide cao nhất có công thức dạng M2O5 |
3. Argon (Ar) |
|
d) Một khí rất trơ về mặt hóa học: |
4. Chlorine (Cl) |
Điền kí hiệu hoá học hoặc cụm từ thích hợp vào chỗ trống trong đoạn thông tin sau:
Trong số các nguyên tố thuộc chu kì 2 trong bảng tuần hoàn (trừ Ne), ...(1)... là nguyên tố có độ âm điện nhỏ nhất và bán kính nguyên tử ...(2)...; (3)... là nguyên tố có độ âm điện lớn nhất nhưng bán kính nguyên tử ...(4)... Tính kim loại giảm dần từ ...(5)... tới ...(6)..., còn tính phi kim thì biến đổi theo chiều ngược lại.
Cấu hình electron nào sau đây ứng với nguyên tố có độ âm điện lớn nhất?
A. 1s22s22p5
B. 1s22s22p6
C. 1s22s22p63s1
D. 1s22s22p63s23p2
Xu hướng biến đổi độ âm điện của các nguyên tố trong bảng tuần hoàn tương tự như xu hướng biến đổi của yếu tố nào sau đây?
(1) Tính kim loại.
(2) Tính phi kim.
(3) Bán kính nguyên tử.
A. (1).
B. (2).
C. (3).
D. (1), (2) và (3).
Dãy các nguyên tố nào sau đây có tính kim loại giảm dần?
A. Sr > Al > P > Si > N.
B. Sr > Al > P > N > Si.
C. Sr > Al > Si > P > N.
D. Sr > Si > Al > P > N.
Chọn nguyên tố thể hiện tính kim loại nhiều hơn trong mỗi cặp nguyên tố sau:
a) Sr và Sb.
b) As và Bi.
c) B và O.
d) S và As.
Phát biểu nào sau đây là đúng về xu hướng biến đổi tính kim loại trong bảng tuần hoàn các nguyên tố hóa học?
A. Tính kim loại của các nguyên tố tăng theo chiều từ trái sang phải trong một chu kì và từ trên xuống dưới trong một nhóm.
B. Tính kim loại giảm dần theo chiều từ trái sang phải trong một chu kì và tăng dần từ trên xuống dưới trong một nhóm.
C. Tính kim loại giảm dần theo chiều từ trái sang phải trong một chu kì và từ trên xuống dưới trong một nhóm.
D. Tính kim loại tăng dần theo chiều từ trái sang phải trong một chu kì và giảm dần từ trên xuống dưới trong một nhóm.
Dựa vào Hình 6.1 và Bảng 6.1 trong SGK, hãy vẽ đồ thị hoặc biểu đồ đối với hai đại lượng bán kính nguyên tử và độ âm điện trong bảng số liệu trên. Quan sát và cho biết hai đại lượng này biến thiên như thế nào. Giải thích.








Danh sách bình luận