Sử dụng dữ liệu Bảng 1.1, hãy tính giá trị của biểu thức \(\frac{{{\rm{(}}{{\rm{N}}_{\rm{2}}}{{\rm{O}}_{\rm{4}}}{\rm{)}}}}{{{{{\rm{(N}}{{\rm{O}}_{\rm{2}}}{\rm{)}}}^{\rm{2}}}}}\) trong 5 thí nghiệm. Nhận xét giá trị thu được từ các thí nghiệm khác nhau.
Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái mà tại đó, tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
(N2O4) và (NO2) là nồng độ ở trạng thái cân bằng (mol/l) của N2O4 và NO2.
|
Thí nghiệm |
Nồng độ ở trạng thái cân bằng (mol/l) |
\(\frac{{{\rm{(}}{{\rm{N}}_{\rm{2}}}{{\rm{O}}_{\rm{4}}}{\rm{)}}}}{{{{{\rm{(N}}{{\rm{O}}_{\rm{2}}}{\rm{)}}}^{\rm{2}}}}}\) |
|
|
(NO2) |
(N2O4) |
||
|
1 |
0,0547 |
0,6430 |
214,9000 |
|
2 |
0,0457 |
0,4480 |
214,5090 |
|
3 |
0,0475 |
0,4910 |
217,6177 |
|
4 |
0,0523 |
0,5940 |
217,1616 |
|
5 |
0,0204 |
0,0898 |
215,7824 |
Nhận xét giá trị \(\frac{{{\rm{(}}{{\rm{N}}_{\rm{2}}}{{\rm{O}}_{\rm{4}}}{\rm{)}}}}{{{{{\rm{(N}}{{\rm{O}}_{\rm{2}}}{\rm{)}}}^{\rm{2}}}}}\) thu được từ 5 thí nghiệm trên xấp xỉ bằng nhau.

Các bài tập cùng chuyên đề
Cho phản ứng: 2HI (g) ⇌ H2 (g) + l2(g)
a) Vẽ dạng đồ thị biểu diễn tốc độ của phản ứng thuận và phản ứng nghịch theo thời gian.
b) Xác định trên đồ thị thời điềm phản ứng trên bắt đầu đạt đến trạng thái cân bằng.
Viết biểu thức hằng số cân bằng cho các phản ứng sau:
a) Phản ứng tồng hợp ammonia: N2(g) + 3H2(g) ⇌ 2NH3(g)
b) Phản ứng nung vôi: CaCO3(s) ⇌ CaO(s) + CO2(g)
Hằng số cân bằng KCcủa một phản ứng thuận nghịch phụ thuộc vào yếu tố nào sau đây?
A. Nồng độ. B. Nhiệt độ. C. Áp suất. D. Chất xúc tác.
Cho hai đồ thị (a) và (b) dưới đây. Mỗi đồ thị biểu diễn sự thay đổi tốc độ phản ứng thuận và tốc độ phản ứng nghịch theo thời gian.
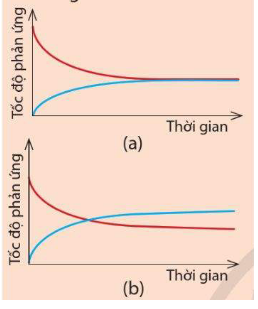
Hãy cho biết đồ thị nào thể hiện đúng Ví dụ 2. Đường màu xanh trong đồ thị đó biểu diễn tốc độ phản ứng thuận hay tốc độ phản ứng nghịch?
Viết biểu thức hằng số cân bằng KCcho phản ứng thuận nghịch:
a, N2(g) + 3H2(g) ⇌ 2NH3(g)
b, CaCO3 (s) ⇌ CaO (s) + CO2 (g)
Hãy cho biết trong công nghiệp, để thu được nhiều NH3 hơn thì cần tăng hay giảm nồng độ N2 và H2.
Viết biểu thức tính KCcho các phản ứng sau:
(1) CaCO3 ⇌ CaO + CO2.
(2) Cu2O + ½ O2 ⇌ 2CuO.
Cho phản ứng sau:
COCl2(g) ⇌ CO(g) + Cl2(g) KC = 8,2 x 10-2 (900K)
Ở trạng thái cân bằng, nếu nồng độ CO và Cl2 đều bằng 0,15M thì nồng độ COCl2 là bao nhiêu?
Viết các biểu thức tính tốc độ phản ứng thuận và tốc độ phản ứng nghịch của phản ứng thuận nghịch sau, biết phản ứng thuận và phản ứng nghịch đều là phản ứng đơn giản:
aA+bB ⇌ cC + dD
Lập tỉ lệ giữa hằng số tốc độ phản ứng thuận và hằng số tốc độ phản ứng nghịch ở trạng thái cân bằng.
Cho hệ cân bằng sau:
2SO2(g) + O2(g) → 2SO3(g)
Viết biểu thức tính hằng số cân bằng KC của phản ứng trên.
Nêu hiện tượng xảy ra trong Thí nghiệm 1, từ đó cho biết chiều chuyển dịch cân bằng của phản ứng trong bình 2 và bình 3.
Trên thực tế có các phản ứng sau:
2H2 + O2 (1)
2H2Ođiện phân → 2H2 + O2 (2)
Vậy có thể viết
2H2 + O2 ⇌ 2H2O được không? Tại sao?
Quan sát Hình 1.1, nhận xét sự biến thiên nồng độ của các chất trong hệ phản ứng theo thời gian (với điều kiện nhiệt độ không đổi).
Cho 0,4 mol SO2 và 0,6 mol O2vào một bình dung tích 1 lít được giữ ở một nhiệt độ không đổi. Phản ứng trong bình xảy ra như sau:
2SO2 (g) + O2 (g) ⇌ 2SO3 (g)
Khi phản ứng đạt đến trạng thái cân bằng, lượng SO3 trong bình là 0,3 mol. Tính hằng số cân bằng KC của phản ứng tổng hợp SO3 ở nhiệt độ trên.
Nhũ đá được hình thành trong các hang động liên quan đến cân bằng sau đây:
Ca(HCO3)2(aq) ⇌ CaCO3(s) + CO2(aq) + H2O(1)
Nếu nồng độ CO2 hoà tan trong nước tăng lên thì có thuận lợi cho sự hình thành nhũ đá hay không? Giải thích.
Hai acid HA và HB cùng nồng độ ban đầu là 0,5 M, phân li trong nước theo các cân bằng:
HA ⇌ H+ + A-
HB ⇌ H+ + B-
Với các hằng số cân bằng (hay gọi là hằng số phân li acid) tương ứng là KC(HA) = 0,2 và KC(HB) = 0,1. Tính nồng độ H+ của mỗi dung dịch acid. Rút ra kết luận về mối liên hệ giữa độ mạnh của acid với độ lớn của hằng số phân li acid. Biết rằng acid càng mạnh khi càng dễ tạo ra H+.
Viết biểu thức hằng số cân bằng KCcho phản ứng (*), (**) dưới đây.
H2 (g) + I2 (g) ⇌ 2HI(g) (*)
1/2 H2(g) + 1/2 I2 (g) ⇌ HI (g) (**)
Theo em, giá trị hai hằng số cân bằng này có bằng nhau không?
Trong công nghiệp, hydrogen được sản xuất từ phản ứng:
CH4 (g) + H2O (g) ⇌ 3H2 (g) + CO (g)
a) Tính hằng số cân bằng KC của phản ứng trên ở 760 °C.
Biết ở nhiệt độ này, tất cả các chất đều ở thể khí và nồng độ mol của CH4, H2O, H2 và CO ở trạng thái cần bằng lần lượt là 0,126 M; 0,242 M; 1,150 M và 0,126 M.
b*) Ở 760 °C, giả sử ban đầu chỉ có CH4, H2O có nồng độ bằng nhau và bằng x M. Xác định x, biết nồng độ của H2 ở trạng thái cân bằng là 0,6 M.
Vì sao giá trị \(\frac{{{{\rm{k}}_{\rm{t}}}}}{{{{\rm{k}}_{\rm{n}}}}}\) là một hằng số ở nhiệt độ xác định?
Viết biểu thức cân bằng hằng số K C cho các phản ứng sau:
a) 2SO 2 ( g ) + O 2 ( g ) ⇌ 2SO 3 ( g )
b) 2C( s ) + O 2 ( g ) ⇌ 2CO( g )
c) AgCl( s ) ⇌ Ag + (aq) + (aq)
Cho cân bằng hóa học sau: H 2 (g) + I 2 (g) ⇌ 2HI(g) ΔrH 298 o = - 9,6 kJ
Nhận xét nào sau đây sai?
A. Khi tăng nhiệt độ, cần sử dụng chuyển dịch theo chiều nghịch.
B. Ở nhiệt độ không thay đổi, khi tăng hiệu suất thì cân bằng không được chuyển dịch.
C. Ở nhiệt độ không đổi, khi tăng nhiệt độ H 2 hoặc I 2 , thì cân bằng tăng giá trị vĩnh viễn.
D. Ở trạng thái cân bằng, tốc độ phản ứng thuận lợi bằng tốc độ phản ứng nghịch.
Cho cân bằng hóa học sau:
CO( g ) + H 2 O( g ) ⇌ CO 2 ( g ) + H 2 ( g )
Ở 700 o C, cân bằng hằng số K C = 8,3. Cho 1 mol khí CO và 1 mol hơi nước vào bình kín, dung tích 10 lít và giữ ở 700 o C. Tính nồng độ các chất ở trạng thái cân bằng.
Xét phản ứng thuận nghịch: H2(g) + I2(g) ⇌ 2HI(g)
Thực hiện phản ứng trên ở trong bình kín, ở nhiệt độ 445 oC với các nồng độ ban đầu khác nhau. Số liệu về nồng độ các chất ở thời điểm ban đầu và trạng thái cân bằng trong các thí nghiệm được trình bày trong Bảng 1.2.
Ammonia (NH3) được điều chế bằng phản ứng: N2(g) + 3H2(g) ⇌ 2NH3(g) ở t °C, nồng độ các chất ở trạng thái cân bằng là: (N2) = 0,45 M; (H2) = 0,14 M; (NH3) = 0,62 M.
Tính hằng số cân bằng KC của phản ứng trên tại t °C.
Ảnh hưởng của nhiệt độ đến sự chuyển dịch cân bằng:
2NO2(g) ⇌ N2O4(g) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}}{\rm{ < 0}}\)
(màu nâu đỏ) (không màu)
Khi xăng cháy trong động cơ ô tô sẽ tạo ra nhiệt độ cao, lúc đó N2 phản ứng với O2 tạo thành NO:
\[{{\rm{N}}_{\rm{2}}}\left( g \right){\rm{ }} + {\rm{ }}{{\rm{O}}_2}\left( g \right) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2{\rm{NO}}\left( g \right){\rm{ }}\left( 1 \right)\]
NO khi được giải phóng ra không khí nhanh chóng kết hợp với O2 tạo thành NO2 là một khí gây ô nhiễm môi trường. Ở 2 000 °C, hằng số cân bằng KC của phản ứng (1) là 0,01.
Nếu trong bình kín dung tích 1 lít có 4 mol N2 và 0,1mol O2 thì ở 2 000 °C lượng khí NO tạo thành là bao nhiêu (giả thiết NO chưa phản ứng với O2)?
Trong một bình kín xảy ra cân bằng hoá học sau:
\[{{\rm{H}}_2}\left( g \right){\rm{ }} + {\rm{ }}{{\rm{I}}_2}\left( g \right){\rm{ }} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2{\rm{HI}}\left( g \right)\]
Cho 1 mol H2 và 1 mol I2 vào bình kín, dung tích 2 lít. Lượng HI tạo thành theo thời gian được biểu diễn bằng đồ thị sau:
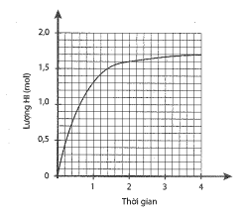
a) Xác định nồng độ các chất ở thời điểm cân bằng.
b) Tính hằng số cân bằng KC.
c) Tính hiệu suất của phản ứng.
Phosphorus trichloride (PCl3) phản ứng với chlorine (Cl2) tạo thành phosphorus pentachloride (PCl5) theo phản ứng: \[{\rm{PC}}{{\rm{l}}_{\rm{3}}}\left( g \right){\rm{ }} + {\rm{ C}}{{\rm{l}}_{\rm{2}}}\left( g \right){\rm{ }} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{PC}}{{\rm{l}}_{\rm{5}}}\left( g \right)\]
Cho 0,75 mol PCl3 và 0,75 mol Cl2 vào bình kín dung tích 8 lít ở 227 °C. Tính nồng độ các chất ở trạng thái cân bằng, biết giá trị hằng số cân bằng Kc ở 227 oC là 49.
Các kết quả trong bảng sau đây được ghi lại từ hai thí nghiệm giữa khí sulfur dioxide và khí oxygen để tạo thành khí sulfur trioxide ở 600 °C. Tính giá trị KC ở hai thí nghiệm và nhận xét kết quả thu được.
|
|
Nồng độ các chất ở thời điểm ban đầu (mol/L) |
Nồng độ các chất ở thời điểm cân bằng (mol/L) |
||||
|
SO2 |
O2 |
SO3 |
SO2 |
O2 |
SO3 |
|
|
Thí nghiệm 1 |
2,000 |
1,500 |
3,000 |
1,500 |
1,250 |
3500 |
|
Thí nghiệm 2 |
0,500 |
0 |
0,350 |
0,590 |
0,045 |
0,260 |
Cho các phản ứng hoá học sau:
a) Các phản ứng toả nhiệt là
A. (1); (2) và (3). B. (1) và (3).
C. (1); (2); (4) và (5). D. (1); (2); (3) và (5).
b) Khi tăng nhiệt độ, các cân bằng hoá học chuyển dịch theo chiều thuận là
A. (1); (2) và (3). B. (1); (2) và (5). C. (4) và (5). D. (3) và (5).
c) Khi tăng áp suất, các cân bằng hoá học chuyển dịch theo chiều thuận là
A. (1); (2) và (3). B. (1); (3) và (5). C. (2); (3) và (4). D. (3); (4) và (5).






