Vì sao magnesium phản ứng rất chậm với nước?
Dựa vào bảng 18.2.

Vì độ tan của Mg(OH)2 nhỏ hơn phản ứng của Mg và H2O nên Mg phản ứng rất chậm với nước.

Các bài tập cùng chuyên đề
Muối carbonate của kim loại nhóm IIA là muối của acid yếu, tác dụng được với nhiều acid vô cơ và hữu cơ, giải phóng khí carbon dioxide.
1. Viết phương trình hoá học của phản ứng giữa CaCO3 với dung dịch HCl, với dung dịch CH3COOH.
2. Đề xuất cách làm sạch cặn đá vôi trong phích nước.
Nhận biết từng ion riêng rẽ Ca2+, Ba2+, \({\rm{SO}}_4^{2 - }\)
- Cho vào ống nghiệm (1) khoảng 1 mL dung dịch CaCl2 1 M, ống nghiệm (2) khoảng 1 mL dung dịch BaCl2 1 M, ông nghiệm (3) khoảng 1 mL Na2SO4 1 M.
- Nhỏ từ từ từng giọt dung dịch Na2SO4 1 M vào mỗi ống nghiệm (1) và ống nghiệm (2); nhỏ vài giọt dung dịch BaCl2 1 M vào ống nghiệm (3).
Chú ý: BaCl2 độc, cần tuân thủ quy tắc an toàn trong phòng thí nghiệm.
Quan sát hiện tượng xảy ra và thực hiện các yêu cầu sau:
1. Viết phương trình hoá học của các phản ứng xảy ra trong mỗi ống nghiệm.
2. Ở ống nghiệm (1) và (2), ống nào tạo kết tủa nhanh hơn? Nhiều hơn?
Nhận biết ion \({\rm{CO}}_3^{2 - }\)
- Cho khoảng 1 mL dung dịch Na2CO3 1 M vào ống nghiệm, thêm tiếp khoảng 1 mL dung dịch CaCl2 1 M, lắc đều.
- Thêm tiếp 2 mL dung dịch HCl 2 M vào ống nghiệm, lắc đều.
Quan sát hiện tượng xảy ra và thực hiện các yêu cầu sau:
1. Viết phương trình hoá học của các phản ứng xảy ra trong thí nghiệm.
2. Nêu các hiện tượng xảy ra và giải thích.
a) Khi đun nóng nước có tính cứng tạm thời, phần lớn các ion Ca2+ và Mg2+ được tách ra khỏi nước ở dạng kết tủa muối carbonate. Viết phương trình hoá học của các phản ứng xảy ra.
b) Giải thích sự tạo thành cặn đá vôi trong phích nước, ấm đun nước.
Dựa vào tính khử của kim loại và độ tan của các hydroxide, dự đoán:
a) Magnesium hay barium phản ứng với oxygen mạnh hơn
b) Calcium hay barium phản ứng với nước mạnh hơn.
Dựa vào giá trị thế điện cực chuẩn của kim loại (Bảng 10.1) và giá trị thế điện cực chuẩn của quá trình \(2{H_2}{\rm{O}} + 2e \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {H_2} + 2{\rm{O}}{H^ - }\)là \({E_{2{H_2}{\rm{O}}/2{\rm{O}}{H^ - } + {H_2}}}\)= -0,413 V ở pH = 7, hãy:
a) Sắp xếp Na, Mg, Cu theo dãy tăng dần tính khử của kim loại
b) Giải thích vì sao Na và Mg tác dụng được với nước.
Dự đoán tính chất hoá học đặc trưng của kim loại nhóm IIA và so sánh với kim loại nhóm IA.
Hoàn thành phương trình hoá học của các phản ứng sau:
\(\begin{array}{l}{\rm{a) Be + }}{{\rm{O}}_2} \to \\{\rm{b) Ca + }}{{\rm{O}}_2} \to \\{\rm{c) Ba + }}{{\rm{O}}_2} \to \end{array}\)
Hoàn thành phương trình hoá học của các phản ứng sau:
\(\begin{array}{l}{\rm{a) Ca + }}{{\rm{H}}_2}{\rm{O}} \to \\{\rm{b) Ba + }}{{\rm{H}}_2}{\rm{O}} \to \end{array}\)
Giả sử, khi calcium tiếp xúc với không khí ẩm: đầu tiên tạo thành calcium oxide, sau đó chuyển thành calcium hydroxide, rồi thành calcium carbonate. Viết phương trình hoá học của các phản ứng trên.
Kim loại kiềm thổ được điều chế bằng phương pháp điện phân
-
A.
nóng chảy M(OH)2.
-
B.
dung dịch MCl2.
-
C.
nóng chảy MO.
-
D.
nóng chảy MCl2.
Hiện tượng “nước chảy đá mòn” và hiện tượng “xâm thực” của nước mưa vào các phiến đá vôi là do trong nước có hoà tan khí nào sau đây?
-
A.
O2.
-
B.
N2.
-
C.
CO2.
-
D.
CH4.
Tiến hành các thí nghiệm sau:
(1) Cho mẩu nhỏ Na vào cốc đựng nước dư.
(2) Điện phân dung dịch KC1 bão hoà, có màng ngăn điện cực.
(3) Cho dung dịch H2SO4 vào dung dịch Ba(HCO3)2.
(4) Đun sôi dung dịch gồm CaCl2 và NaHCO3.
Số thí nghiệm tạo ra chất khí là
-
A.
4
-
B.
3
-
C.
2
-
D.
1
Dãy các kim loại nào sau đây tác dụng nhanh với nước ở điều kiện thường?
-
A.
Be, Na, Ba.
-
B.
Mg, Ca, Ba.
-
C.
Li, Ca, Ba.
-
D.
Sr, Sn, Ba.
Barium phản ứng với nước dễ dàng hơn so với magnesium ở điều kiện thường là do các nguyên nhân nào sau đây?
(1) Barium có tính khử mạnh hơn magnesium.
(2) Độ tan của barium hydroxide trong nước cao hơn nhiều so với magnesium hydroxide.
(3) Bọt khí hydrogen sinh ra bám trên bề mặt magnesium nhiều hơn, cản trở phản ứng tiếp diễn.
-
A.
(1).
-
B.
(1), (2) và (3).
-
C.
(1) và (3).
-
D.
(1) và (2).
Cho 400ml dung dịch Ba(OH)2 0,1 M vào 600ml dung dịch NaHCO3 0,1 M. Sau phản ứng thu được m gam kết tủa . Giá trị của m là
-
A.
5,91
-
B.
3,94
-
C.
7,88
-
D.
4,00
Trong quá trình trồng trọt, người nông dân được khuyến cáo không bón vôi sống (thành phần chính là CaO) cùng với phân đạm ammonium. Nguyên nhân của khuyến cao này là
-
A.
thất thoát đạm vì giải phóng ammonia.
-
B.
tạo thành hỗn hợp gây cháy nổ.
-
C.
tạo acid làm ảnh hưởng đến cây trồng.
-
D.
làm tăng độ chua của đất.
Một học sinh thực hiện các thí nghiệm để nhận biết hai dung dịch chất X và chất Y, thu được một số kết quả như sau:
- Dung dịch chất X và chất Y đều làm dung dịch phenolphtalein chuyển sang màu hồng.
- Trộn X và Y thu được kết tủa trắng.
- Chất X cháy với ngọn lửa màu lục trên đèn khí, trong khi chất Y cháy với ngọn lửa màu tím.
Mỗi kết luận sau đây của học sinh đó về chất X và chất Y là đúng hay sai? Biết mỗi chất X. Y đều chỉ chứa một loại cation và một loại anion.
(a) Chất X có chứa cation Ba2+, chất Y chứa cation K+.
(b) Chất X không thể là barium chloride.
(c) Chất Y phải là potassium carbonate.
(d) Chất kết tủa màu trắng phải là hợp chất của barium.
Thực hiện phản ứng giữa các dung dịch sau:
a) Potasium carbonate và calcium hydroxide.
b) Sodium phosphate và barium chloride.
c) Magnesium hydrogencarbonate và sulfuric acid.
d) Sodium hydrogencarbonate và barium hydroxide.
e) Barium hydroxide và nitric acid.
Những phản ứng nào thu được kết tủa? Viết phương trình hóa học của các phản ứng xảy ra.
Barium phản ứng với nước dễ dàng hơn so với magnesium ở điều kiện thường là do các nguyên nhân nào sau đây?
(1) Barium có tính khử mạnh hơn magnesium.
(2) Độ tan của barium hydroxide trong nước cao hơn nhiều so với magnesium hydroxide.
(3) Bọt khí hydrogen sinh ra bám trên bề mặt magnesium nhiều hơn, cản trở phản ứng tiếp diễn.
A. (1). B. (1), (2) và (3). C. (1) và (3). D. (1) và (2).
Dãy các kim loại nào sau đây tác dụng nhanh với nước ở điều kiện thường?
A. Be, Na, Ba. B. Mg, Ca, Ba.
C. Li, Ca, Ba. D. Sr, Sn, Ba.
Hãy viết phương trình hóa học của phản ứng để giải thích:
a) Hiện tượng bào mòn thạch nhủ tao hang động( tạo hang động ).
b) Hiện tượng tạo thành nhũ đá, măng đá trong các hang động tự nhiên.
c) Câu tục ngữ “nước chảy đá mòn”.
Từ dữ liệu cho ở bảng sau, hãy tính các giá trị \({\Delta _r}H_{298}^o\) của phản ứng phân hủy các chất sau và cho biết hợp chất nào dễ bị phân hủy hơn?
Bảng giá trị \({\Delta _f}H_{298}^o\) của một số chất
|
Chất |
MgO(s) |
CaO(s) |
SrO(s) |
BaO(s) |
CO2(s) |
|||||
|
\({\Delta _f}H_{298}^o(kJ/mol)\) |
-601,20 |
-635,10 |
-592,00 |
-548,10 |
-393,50 |
|||||
|
Chất |
MgCO3(s) |
CaCO3(s) |
SrCO3(s) |
BaCO3(s) |
|
|||||
|
\({\Delta _f}H_{298}^o(kJ/mol)\) |
-1 112,00 |
-1 206,90 |
-1 218,00 |
-1 219,00 |
|
|||||

Từ 2 chất ban đầu là magnesium và nitric acid đặc, mô tả cách điều chế magnesium oxide.
Cho sơ đồ chyển hóa sau:
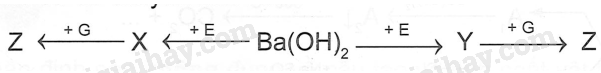
Biết X, Y, Z, E, G là các hợp chất khác nhau, mỗi mũi tên ứng với một phương trình hóa học của phản ứng xảy ra giữa hai chất tương ứng. Các chất E,G trong sơ đồ trên lần lượt là
A. Na2SO4, NaOH.
B. NaHCO3, BaCl2.
C. CO2, NaHSO4.
D. Na2CO3, HCl.
Cho sơ đồ:
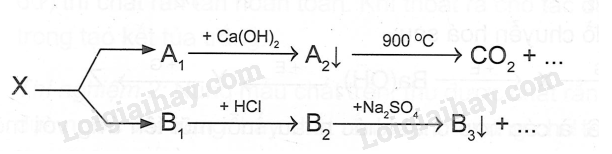
Chất X trong sơ đồ trên có thể là
A. BaCO3 B. CaCO3 C. BaSO3 D. MgCO3
Cho 400ml dung dịch Ba(OH)2 0,1 M vào 600ml dung dịch NaHCO3 0,1 M. Sau phản ứng thu được m gam kết tủa . Giá trị của m là
A. 5,91 B. 3,94 C. 7,88 D. 4,00
Dãy gồm các kim loại đều phản ứng với nước ở nhiệt độ thường, tạo ra dung dịch có môi trường kiềm là
A. Na, Ba, K. B. Na, Fe, K.
C. Be, Na, Ca. D. Na, Cr, K.
Phương trình hóa học của phản ứng nào sau đây không đúng?
A. Ca + 2H2O → Ca(OH)2 + H2
B. BeO + H2O → Be(OH)2
C. Mg + H2SO4 → MgSO4 + H2
D. Be + 2NaOH → Na2BeO2 + H2
Thực hiện thí nghiệm sau: Cho từ từ 50 mL dung dịch Ba(OH)2 1 M vào 15 mL dung dịch Al2(SO4)3 chưa biết nồng độ. Sau khi các phản ứng kết thúc thu được 12,045 g kết tủa. Xác định nồng độ của dung dịch Al2(SO4)3.







Danh sách bình luận