Một số quá trình tự nhiên và hoạt động của cong người thải hydrogen sulfide vào không khí. Chất này có thể bị oxi hóa bởi oxygen có trong không khí theo hai phản ứng sau: 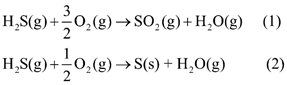
Cho biết giá trị enthalpy tạo thành chuẩn của H2S(g), SO2(g) và H2O(g) lần lượt là -20,7kJ mol-1;-296,8 kJ mol-1 và -241,8 kJ mol-1.
(a) Tính giá trị biến thiên enthalpy chuẩn của mỗi phản ứng trên. Ở 298 K, mỗi phản ứng có thuận lợi về mặt năng lượng không?
(b) Trong môi trường không khí mà nồng độ oxygen bị suy giảm, hãy dự đoán hydrogen sulfide dễ chuyển hóa thành sulfur dioxide hay sulfur. Giải thích.
(a) \({\Delta _r}H_{298}^0(1) = {\Delta _f}H_{298}^0(S{O_2}) + {\Delta _f}H_{298}^0({H_2}{\rm{O}}) - {\Delta _f}H_{298}^0({H_2}{\rm{S}})\)
= -296,8 + (-241,8) – (-20,7) = -517,9 kJ
\({\Delta _r}H_{298}^0(2) = {\Delta _f}H_{298}^0({H_2}{\rm{O}}) - {\Delta _f}H_{298}^0({H_2}{\rm{S}})\)= (-241,8) – (-20,7) = -221,1 kJ
Phản ứng (1) (2) đều thuận lợi về mặt năng lượng.
b) trong môi trường không khí mà nồng độ oxygen bị suy giảm, hydrogen sulfide dễ chuyển hóa thành sulfur vì phản ứng (2) cần ít oxygen hơn.








Bình luận