Cho các nguyên tố 11Na, 19K, 13Al, 12Mg. Chiều tăng dần tính kim loại của chúng là
-
A.
Mg < Al < K < Na.
-
B.
Al < Mg < Na < K.
-
C.
K < Na < Mg < Al.
-
D.
Al < Na < Mg < K.
- Từ Z → Cấu hình e → Vị trí trong BTH.
- Từ vị trí so sánh được tính kim loại của các nguyên tố:
+ Trong cùng một chu kì, theo chiều tăng của điện tích hạt nhân thì tính kim loại giảm dần.
+ Trong cùng một nhóm A, theo chiều tăng của điện tích hạt nhân thì tính kim loại tăng dần.
Cấu hình e nguyên tử:
11Na: 1s22s22p63s1.
19K: 1s22s22p63s23p64s1.
13Al: 1s22s22p63s23p1.
12Mg: 1s22s22p63s2.
Vị trí tương đối của các nguyên tố trong bảng tuần hoàn:
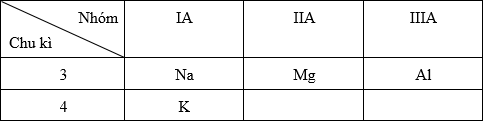
- Trong cùng một chu kì, theo chiều tăng của điện tích hạt nhân thì tính kim loại giảm dần
→ Al < Mg < Na
- Trong cùng một nhóm A, theo chiều tăng của điện tích hạt nhân thì tính kim loại tăng dần
→ Na < K
Vậy tính kim loại: Al < Mg < Na < K.
Đáp án : B








Bình luận