Bài 38.17 Trang 54 SBT hóa học 8
Giải bài 38.17 Trang 54 sách bài tập hóa học 8. Dẫn 6,72 lít (ở đktc) hỗn hợp hai khí H2 và CO từ từ qua hỗn hợp hai oxit ...
Đề bài
Dẫn 6,72 lít (ở đktc) hỗn hợp hai khí H2 và CO từ từ qua hỗn hợp hai oxit FeO và CuO nung nóng, sau phản ứng thấy khối lượng hỗn hợp giảm m gam.
a) Viết các phương trình hoá học.
b) Tính m.
c) Tính phần trăm thể tích các khí, biết tỉ khối hỗn hợp khí so với CH4 bằng 0,45.
Phương pháp giải - Xem chi tiết
a) \(CuO + CO\buildrel {{t^o}} \over\longrightarrow Cu + C{O_2}(1)\)
\(FeO + CO\buildrel {{t^o}} \over\longrightarrow Fe + C{O_2} \uparrow (2)\)
\(CuO + {H_2}\buildrel {{t^o}} \over\longrightarrow Cu + {H_2}O(3)\)
\(FeO + {H_2}\buildrel {{t^o}} \over\longrightarrow Fe + {H_2}O(4)\)
b) Nx: số mol nguyên tử oxi trong oxit mất đi bằng số mol CO hay H2 tham gia => m.
c) Gọi số mol H2, CO trong 1 mol hỗn hợp lần lượt là x mol và y mol
Sử dụng phương pháp đường chéo => tỉ lệ \(\dfrac{{{n_{CO}}}}{{{n_{{H_2}}}}}\) => % thể tích từng khí.
Lời giải chi tiết
a) Các phựơng trình hoá học :
\(CuO + CO\buildrel {{t^o}} \over\longrightarrow Cu + C{O_2}(1)\)
\(FeO + CO\buildrel {{t^o}} \over\longrightarrow Fe + C{O_2} \uparrow (2)\)
\(CuO + {H_2}\buildrel {{t^o}} \over\longrightarrow Cu + {H_2}O(3)\)
\(FeO + {H_2}\buildrel {{t^o}} \over\longrightarrow Fe + {H_2}O(4)\)
b) Khối lượng chất rắn giảm đi sau phản ứng do đã mất bớt các nguyên tử oxi trong oxit để tạo thành kim loại
Theo các phương trình hoá học (1), (2), (3), (4) số mol nguyên tử oxi trong oxit mất đi bằng số mol CO hay H2 tham gia.
Vậy khối lượng chất rắn giảm : \(\dfrac{6,72}{{22,4}}\times 16 = 4,8(g);m = 4,8(g)\)
c) Gọi số mol H2, CO trong 1 mol hỗn hợp lần lượt là x mol và y mol
\({\overline M _{hh}} = 0,45 \times 16 = 7,2\)
Áp dụng phương pháp đường chéo ta có:
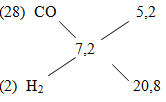
=> \(\dfrac{{{n_{CO}}}}{{{n_{{H_2}}}}} = \dfrac{{5,2}}{{20,8}} = \dfrac{1}{4}\)
Ta có : \({V_{{H_2}}} = \dfrac{{4 \times 100\% }}{5} = 80\% ;\% {V_{CO}} = 20\% \)
Loigiaihay.com













Danh sách bình luận