30 bài tập lý thuyết về tốc độ phản ứng có lời giải
Làm đề thiCâu hỏi 1 :
Khi cho cùng một lượng dung dịch axit sunfuric vào hai cốc đựng cùng một thể tích dung dịch Na2S2O3 với nồng độ khác nhau, ở cốc đựng dung dịch Na2S2O3 có nồng độ lớn hơn thấy kết tủa xuất hiện trước. Điều đó chứng tỏ ở cùng điều kiện về nhiệt độ, tốc độ phản ứng:
- A Không phụ thuộc vào nồng độ của chất phản ứng.
- B Tỉ lệ thuận với nồng độ của chất phản ứng.
- C Tỉ lệ nghịch với nồng độ của chất phản ứng.
- D Không thay đổi khi thay đổi nồng độ của chất phản ứng.
Đáp án: B
Phương pháp giải:
Ở cùng điều kiện về nhiệt độ, tốc độ phản ứng tỉ lệ thuận với nồng độ của chất phản ứng.
Lời giải chi tiết:
Ở cùng điều kiện về nhiệt độ, tốc độ phản ứng tỉ lệ thuận với nồng độ của chất phản ứng.
Đáp án B
Câu hỏi 2 :
Đối với các phản ứng có chất khí tham gia, khi tăng áp suất, tốc độ phản ứng tăng là do
- A Nồng độ của các chất khí tăng lên.
- B Nồng độ của các chất khí giảm xuống.
- C Chuyển động của các chất khí tăng lên.
- D Nồng độ của các chất khí không thay đổi.
Đáp án: A
Phương pháp giải:
Ta có: p = nRT/V
Mặt khác: n = C.V
Do đó ta có: p = CRT
Lời giải chi tiết:
Ta có: p = nRT/V
Mặt khác: n = C.V
Do đó ta có: p = CRT
=> Đối với các phản ứng có chất khí tham gia, khi tăng áp suất, tốc độ phản ứng tăng là do nồng độ của các chất khí tăng lên.
Đáp án A
Câu hỏi 3 :
Khi cho axit clohiđric tác dụng với kali pemanganat (rắn) để điều chế clo, khí clo sẽ thoát ra nhanh hơn khi:
- A Dùng axit clohiđric đặc và đun nhẹ hỗn hợp.
- B Dùng axit clohiđric đặc và làm lạnh hỗn hợp.
- C Dùng axit clohiđric loãng và đun nhẹ hỗn hợp.
- D Dùng axit clohiđric loãng và làm lạnh hỗn hợp.
Đáp án: A
Phương pháp giải:
Dựa vào ảnh hưởng của nồng độ các chất phản ứng và nhiệt độ đối với tốc độ phản ứng.
Lời giải chi tiết:
Nồng độ chất phản ứng tăng và nhiệt độ tăng thì tốc độ phản ứng tăng
Đáp án A
Câu hỏi 4 :
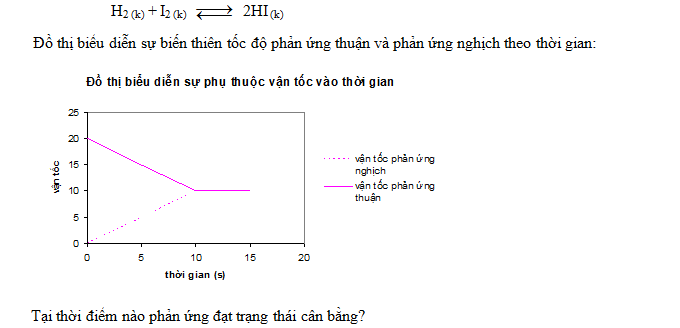
- A 0 giây
- B 5 giây
- C 10 giây
- D 15 giây
Đáp án: C
Phương pháp giải:
Khi vt = vn thì phản ứng đạt tới trạng thái cân bằng.
Lời giải chi tiết:
Tại điểm giao nhau là úc vt = vn => cân bằng được thiết lập => tcb = 10s
Đáp án C
Câu hỏi 5 :
Có phương trình phản ứng: 2A + B → C. Tốc độ phản ứng tại một thời điểm được tính bằng biểu thức: v = k [A]2.[B]. Hằng số tốc độ k phụ thuộc
- A Nồng độ của chất
- B Nồng độ của chất B.
- C Nhiệt độ của phản ứng .
- D Thời gian xảy ra phản ứng.
Đáp án: C
Lời giải chi tiết:
Hằng số k chỉ phụ thuộc vào nhiệt độ của phản ứng.
Đáp án C
Câu hỏi 6 :
Công thức tính tốc độ phản ứng hóa học là:
- A
V= ∆C/∆t
- B
V= ∆t/∆C
- C V= ∆v/∆t
- D V= ∆C.∆t
Đáp án: A
Lời giải chi tiết:
Công thức tính tốc độ phản ứng hóa học là:
V= ∆C/∆t
Đáp án A
Câu hỏi 7 :
Trong phòng thí nghiệm, có thể điều chế khí oxi từ muối kali clorat. Người ta sử dụng cách nào sau đây nhằm mục đích tăng tốc độ phản ứng?
- A
Nung kaliclorat ở nhiệt độ cao.
- B
Nung hỗn hợp kali clorat và mangan đioxit ở nhiệt độ cao.
- C
Dùng phương pháp dời nước để thu khí oxi.
- D Dùng phương pháp dời không khí để thu khí oxi.
Đáp án: B
Lời giải chi tiết:
Dùng nhiệt độ và chất xúc tác (MnO2) sẽ làm tăng tốc độ của phản ứng
Đáp án B
Câu hỏi 8 :
Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng sau:
\({\text{2KCl}}{{\text{O}}_{\text{3}}}{\text{(r)}}\,\,\,\xrightarrow{{{t^o}}}\,\,\,{\text{2KCl(r)}}\,\,{\text{ + }}\,\,{\text{3}}{{\text{O}}_{\text{2}}}{\text{(k)}}\)
- A
Nhiệt độ
- B
Chất xúc tác
- C Áp suất
- D Kích thước của các tinh thể KClO3
Đáp án: C
Lời giải chi tiết:
Yếu tố áp suất chỉ ảnh hưởng đến chuyển dịch cân bằng chứ không làm tăng tốc độ phản ứng
Đáp án C
Câu hỏi 9 :
Dùng không khí nén thổi vào lò cao để đốt cháy than cốc (trong sản xuất gang), yếu tố nào ảnh hưởng đến tốc độ phản ứng?
- A Nhiệt độ, áp suất
- B
tăng diện tích
- C Nồng độ
- D xúc tác
Đáp án: A
Phương pháp giải:
Dựa vào các yếu tố làm tăng tốc độ của một phản ứng.
Lời giải chi tiết:
- Không khí nén => khí ở áp suất cao => yếu tố áp suất
- Đốt cháy => yếu tố nhiệt độ
Đáp án A
Câu hỏi 10 :
Khi ninh (hầm) thịt cá, người ta làm gì cho chúng nhanh chín?
- A
Dùng nồi áp suất
- B
Chặt nhỏ thịt cá
- C Cho thêm muối vào
- D Cả 3 đều đúng
Đáp án: D
Phương pháp giải:
Dựa vào các yếu tố làm tăng tốc độ phản ứng.
Lời giải chi tiết:
- Tăng áp suất làm tăng tốc độ chín => thức ăn chín nhanh hơn
- Chặt nhỏ làm tăng diện tích tiếp xúc => thức ăn chín nhanh hơn
- Thêm muối => tăng nhiệt độ sôi của hỗn hợp => thức ăn chín nhanh hơn
Đáp án D
Câu hỏi 11 :
Xét phản ứng: mA + nB → pC + qD
Biểu thức tính vận tốc của phản ứng là:
- A
v = k [A]m[B]n
- B
v = k [A].[B]
- C v = k [C]p[D]q
- D v = k [A]m[B]n.[C]P[D]q
Đáp án: A
Lời giải chi tiết:
Biểu thức vận tốc: v = k [A]m[B]n
k: hằng số tỉ lệ (hằng số vận tốc).
[A], [B]: nồng độ mol của chất A và B.
Đáp án A
Câu hỏi 12 :
Khi diện tích bề mặt tăng, tốc độ phản ứng tăng là đúng với phản ứng có chất nào tham gia?
- A Chất lỏng
- B Chất rắn
- C Chất khí
- D Cả 3 đều đúng
Đáp án: D
Lời giải chi tiết:
Diện tích tiếp xúc tăng thì tốc độ phản ứng tăng.
Đáp án D
Câu hỏi 13 :
Yếu tố nào dưới đây đã được sử dụng để làm tăng tốc độ phản ứng khi rắc men vào tinh bột đã được nấu chín (cơm, ngô, khoai, sắn) để ủ rượu?
- A Nhiệt độ.
- B Áp suất.
- C Chất xúc tác.
- D Nồng độ.
Đáp án: C
Lời giải chi tiết:
Men là chất xúc tác để làm tăng tốc độ phản ứng lên men tinh bột thành rượu.
Đáp án C
Câu hỏi 14 :
Hai nhóm học sinh làm thí nghiệm: nghiên cứu tốc độ phản ứng kẽm tan trong dung dịch axit clohydric:
*Nhóm thứ nhất: Cân miếng sắt 1g và thả vào cốc đựng 100ml dung dịch axit HCl 2M.
*Nhóm thứ hai: Cân 1g bột sắt và thả vào cốc đựng 150ml dung dịch axit HCl 2M.
Kết quả cho thấy bọt khí thoát ra ở thí nghiệm của nhóm thứ hai mạnh hơn là do:
- A Diện tích bề mặt bột sắt lớn hơn.
- B Nồng độ sắt bột lớn hơn.
- C Nhóm thứ hai dùng axit nhiều hơn.
- D Cả ba nguyên nhân đều sai.
Đáp án: A
Phương pháp giải:
Các yếu tố ảnh hưởng đến tốc độ phản ứng gồm nồng độ, nhiệt độ, áp suất, diện tích tiếp xúc và chất xúc tác. Từ đó xét xem trong thí nghiệm, yếu tố nào ảnh hưởng đến tốc độ phản ứng.
Lời giải chi tiết:
Diện tích bề mặt bột sắt ở nhóm 2 lớn hơn nhóm 1 nên bọt khí thoát ra ở thí nghiệm của nhóm thứ hai mạnh hơn.
Khối lượng sắt trong 2 thí nghiệm là bằng nhau. Nên yếu tố nồng độ bột sắt không ảnh hường.
Thể tích dung dịch không ảnh hưởng đến tốc độ phản ứng.
Đáp án A
Câu hỏi 15 :
Người ta nghiền nguyên liệu trước khi đưa vào lò nung để sản xuất clanhke (trong quá trình sản xuất xi măng) là đã tăng yếu tố nào sau đây để tăng tốc độ của phản ứng?
- A Áp suất.
- B Nhiệt độ.
- C Diện tích bề mặt chất phản ứng.
- D Nồng độ.
Đáp án: C
Phương pháp giải:
Dựa vào các phương pháp làm tăng tốc độ của phản ứng.
Lời giải chi tiết:
Người ta nghiền nguyên liệu trước khi đưa vào lò nung để sản xuất clanhke (trong quá trình sản xuất xi măng) là đã tăng diện tích bề mặt chất phản ứng để tăng tốc độ của phản ứng
Đáp án C
Câu hỏi 16 :
Tốc độ phản ứng chỉ có chất rắn tham gia và tạo thành sau phản ứng không phụ thuộc vào:
- A nhiệt độ
- B diện tích bề mặt tiếp xúc
- C áp suất
- D khuấy trộn
Đáp án: C
Phương pháp giải:
Dựa vào các yếu tố ảnh hưởng tới tốc độ của một phản ứng hóa học.
Lời giải chi tiết:
Tốc độ phản ứng chỉ có chất rắn tham gia và tạo thành sau phản ứng không phụ thuộc vào: áp suất.
Áp suất chỉ ảnh hưởng đến tốc độ phản ứng của chất khí
Đáp án C
Câu hỏi 17 :
Hai nhóm học sinh làm thí nghiệm: nghiên cứu tốc độ phản ứng kẽm tan trong dung dịch axit clohi đric.
- Nhóm thứ nhất: Cân miếng kẽm 1 gam và thả vào cốc đựng 200 ml dung dịch axit HCl 2M.
- Nhóm thứ hai: Cân 1 gam bột kẽm và thả vào cốc đựng 300 ml dung dịch axit HCl 2M
Kết quả cho thấy bọt khí thoát ra ở thí nghiệm của nhóm thứ hai mạnh hơn là do
- A nhóm thứ hai dùng axit nhiều hơn.
- B nồng độ kẽm bột lớn hơn.
- C diện tích bề mặt bột kẽm lớn hơn.
- D nhóm thứ hai dùng axit đặc hơn.
Đáp án: C
Phương pháp giải:
Tốc độ phản ứng phụ thuộc vào các yếu tố: nồng độ, nhiệt độ, diện tích tiếp xúc bề mặt
Lời giải chi tiết:
Bột kẽm có diện tích tiếp xúc với HCl lớn hơn miếng kẽm nên khí thoát ra ở thí nghiệm của nhóm thứ hai mạnh hơn của nhóm thứ nhất
Đáp án C
Câu hỏi 18 :
Chất xúc tác trong phản ứng hóa học có tác dụng làm tăng tốc độ phản ứng, sau khi phản ứng sau chất xúc tác sẽ:
- A Phản ứng hết vừa đủ
- B Phản ứng nhưng vẫn còn dư
- C Phản ứng hết nhưng vẫn còn thiếu so với chất phản ứng
- D Không thay đổi
Đáp án: D
Phương pháp giải:
Dựa vào kiến thức về các yếu tố ảnh hưởng đến nồng độ
Lời giải chi tiết:
Chất xúc tác có tác dụng làm tăng tốc độ phản ứng, sau khi phản ứng chất xúc tác còn nguyên, khối lượng không thay đổi
Đáp án D
Câu hỏi 19 :
Đối với một hệ ở trạng thái cân bằng, nếu thêm vào chất xúc tác thì
- A Chỉ làm tăng tốc độ phản ứng thuận
- B Chỉ làm tăng tốc dộ phản ứng nghịch
- C Làm tăng tốc độ phản ứng thuận và nghịch với số lần như nhau
- D Không làm tăng tốc độ của phản ứng thuận và nghịch
Đáp án: C
Lời giải chi tiết:
Đáp án C
Câu hỏi 20 :
Phương pháp nào sau đây làm giảm tốc độ phản ứng?
- A Nấu thực phẩm trong nồi áp suất
- B Đưa lưu huỳnh đang cháy ngoài không khí vào oxi
- C Dùng không khí nén thổi vào lò cao để đốt than cốc (sản xuất gang)
- D Đậy nắp bếp lò than đang cháy.
Đáp án: D
Phương pháp giải:
Dựa vào các yếu tố làm tăng tốc độ phản ứng
Lời giải chi tiết:
A. Nấu thực phẩm trong nồi áp suất giúp thời gian thức ăn chín nhanh và nhừ hơn → tăng tốc độ phản ứng
B. Tăng nồng độ Oxi giúp lưu huỳnh cháy nhanh hơn → tăng tốc độ phản ứng
C. Tăng áp suất và nhiệt độ giúp than cốc cháy nhanh hơn → tăng tốc độ phản ứng
D. Đóng nắp làm giảm nồng độ oxi làm than khó tiếp tục cháy → giảm tốc độ phản ứng
Đáp án D
Câu hỏi 21 :
Thực nghiệm cho biết tốc độ phản ứng A2 + B2 → 2AB được tính theo biểu thức: v = k.[A2].[B2].
Trong các điều khẳng định dưới đây, khẳng định nào phù hợp với biểu thức trên?
- A Tốc độ phản ứng hóa học được đo bằng sự biến đổi nồng độ các chất phản ứng trong một đơn vị thời gian.
- B Tốc độ phản ứng tỉ lệ thuận với tích số nồng độ các chất phản ứng.
- C Tốc độ phản ứng tỉ lệ nghịch với tích số nồng độ các chất phản ứng.
- D Tốc độ phản ứng tăng lên khi có mặt chất xúc tác.
Đáp án: B
Phương pháp giải:
Dựa vào biểu thức tốc độ phản ứng để suy luận.
Lời giải chi tiết:
Từ biểu thức tính v = k.[A2].[B2] ta thấy tốc độ phản ứng phụ thuộc vào tích nồng độ A2 và B2 là chất tham gia phản ứng → Tốc độ phản ứng tỉ lệ thuận với tích số nồng độ các chất phản ứng.
Đáp án B
Câu hỏi 22 :
Trong gia đình, nồi áp suất được sử dụng để nấu chín kỹ thức ăn. Lí do nào sau đây là thích hợp cho việc sử dụng nồi áp suất ?
- A Tăng áp suất và nhiệt độ lên thức ăn.
- B Giảm hao phí năng lượng.
- C Giảm thời gian nấu ăn.
- D Cả A, B và C đúng.
Đáp án: D
Phương pháp giải:
Dựa vào kiến thức liên quan các yếu tố ảnh hưởng đến tốc độ phản ứng và liên hệ với kiến thức thực tế để suy luận.
Lời giải chi tiết:
Nồi áp suất có vai trò nén áp suất ở nhiệt độ cao do vậy giúp thức ăn chín kĩ hơn, thời gian chín nhanh hơn từ đó giúp giảm hao phí điện năng.
Đáp án D
Câu hỏi 23 :
Người ta đã sử dụng nhiệt độ của phản ứng đốt cháy than đá để nung vôi, biện pháp kỹ thuật nào sau đây không được sử dụng để tăng tốc độ phản ứng nung vôi?
- A Đập nhỏ đá vôi với kích thước khoảng 10cm.
- B Tăng nhiệt độ phản ứng lên khoảng 9000 C.
- C Tăng nồng độ khí cacbonic.
- D Thổi không khí nén vào lò nung vôi.
Đáp án: C
Phương pháp giải:
Viết PTHH nung vôi, sau đó dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng để kết luận.
Lời giải chi tiết:
PTHH: CaCO3 (rắn) \(\xrightarrow{{{t^0}}}\)CaO (rắn) + CO2 (khí)
A. Đập nhỏ đá vôi giúp đá vôi có diện tích tiếp xúc lớn hơn, dễ nhiệt phân hơn → tăng tốc độ pư
B. Tăng nhiệt độ giúp phản ứng xảy ra nhanh hơn → tăng tốc độ pư
C. CO2 là sản phẩm tạo thành, do vậy tăng nồng độ CO2 dẫn đến không làm tăng được tốc độ pư
D. Thổi không khí nén vào bình giúp tăng áp suất và nhiệt độ → tăng tốc độ pư
Đáp án C
Câu hỏi 24 :
Người ta sử dụng các biện pháp sau để tăng tốc độ phản ứng:
(1) Dùng khí nén, nóng thổi vào lò cao để đốt cháy than cốc (trong sản xuất gang).
(2) Nung đá vôi ở nhiệt độ cao để sản xuất vôi sống.
(3) Nghiền nguyên liệu trước khi nung để sản xuất clanhke.
(4) Cho bột sắt làm xúc tác trong quá trình sản xuất NH3 từ N2 và H2.
Trong các biện pháp trên, có bao nhiêu biện pháp đúng?
- A 1
- B 2
- C 3
- D 4
Đáp án: D
Phương pháp giải:
Dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng và xét các đáp án.
Lời giải chi tiết:
(1) đúng vì dùng khí nén, nóng để tăng áp suất và nhiệt độ giúp than cốc cháy tốt hơn
(2) đúng vì tăng nhiệt độ phản ứng giúp đá vôi phân hủy nhanh hơn.
(3) đúng vì nghiền nhỏ giúp tăng diện tích tiếp xúc của nguyên liệu giúp tăng tốc độ phản ứng
(4) đúng vì chất xúc tác bột Fe giúp tăng tốc độ phản ứng
→ 4 phát biểu đều đúng
Đáp án D
Câu hỏi 25 :
Khi đốt củi, để tăng tốc độ cháy, người ta sử dụng biện pháp nào sau đây?
- A đốt trong lò kín.
- B xếp củi chặt khít.
- C thổi hơi nước.
- D thổi không khí khô
Đáp án: D
Phương pháp giải:
Xét các đáp án và dựa vào các yếu tố làm tăng tốc độ phản ứng để suy luận.
Lời giải chi tiết:
A. Loại, đốt trong lò kín giúp hạn chế sự tiếp xúc với O2 → củi khó cháy hơn
B. Loại, xếp củi chặt làm diện tích tiếp xúc của củi với không khí giảm → giảm khả năng cháy của củi
C. Loại, thổi hơi nước giúp giảm nhiệt độ cháy → giảm khả năng cháy của củi
D. Chọn, thổi không khí khô giúp tăng nồng độ O2, củi cháy dễ dàng hơn
Đáp án D
Câu hỏi 26 :
Có hai cốc chứa dung dịch Na2SO3, trong đó cốc A có nồng độ lớn hơn cốc B. Thêm nhanh cùng một lượng dung dịch H2SO4 cùng nồng độ vào hai cốc. Hiện tượng quan sát được trong thí nghiệm trên là
- A cốc A xuất hiện kết tủa vàng nhạt, cốc B không thấy kết tủa.
- B cốc A xuất hiện kết tủa nhanh hơn cốc B.
- C cốc A xuất hiện kết tủa chậm hơn cốc B.
- D cốc A và cốc B xuất hiện kết tủa với tốc độ như nhau.
Đáp án: B
Phương pháp giải:
Dựa vào yếu tố nồng độ để suy luận
Lời giải chi tiết:
Cốc A có nồng độ lớn hơn cốc B, nên khi cho cùng nồng độ dd H2SO4 vào 2 cốc thì cốc A sẽ có tốc độ phản ứng nhanh hơn cốc B.
→ cốc A xuất hiện kết tủa nhanh hơn cốc B.
Đáp án B
Câu hỏi 27 :
Đối với phản ứng phân hủy H2O2 trong nước, khi thay đổi yếu tố nào sau đây, tốc độ phản ứng không thay đổi?
- A thêm MnO2
- B tăng nồng độ H2O2
- C đun nóng
- D tăng áp suất H2
Đáp án: D
Phương pháp giải:
Viết PTHH hóa học phân hủy và dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng để suy luận.
Lời giải chi tiết:
PTHH: \(2{H_2}{O_2}\xrightarrow{{Mn{O_2},{t^0}}}2{H_2} + {O_2}\)
- Thêm chất xúc tác MnO2; tăng nồng độ H2O2 và đun nóng giúp tốc độ pư xảy ra nhanh hơn
- Tăng áp suất H2 là bên chất sản phẩm nên không làm tăng được tốc độ pư
Đáp án D
Câu hỏi 28 :
Tốc độ phản ứng không phụ thuộc yếu tố nào sau đây?
- A
Nồng độ các chất tham gia phản ứng.
- B
Thời gian xảy ra phản ứng.
- C
Bề mặt tiếp xúc giữa các chất phản ứng.
- D
Chất xúc tác.
Đáp án: B
Phương pháp giải:
Lý thuyết về tốc độ phản ứng.
Lời giải chi tiết:
Tốc độ phản ứng phụ thuộc vào 5 yếu tố:
- Nồng độ các chất tham gia phản ứng.
- Diện tích bề mặt tiếp xúc.
- Nhiệt độ.
- Áp suất (với phản ứng có chất khí).
- Chất xúc tác.
Do đó tốc độ phản ứng không phụ thuộc yếu tố thời gian xảy ra phản ứng.
Đáp án B
Câu hỏi 29 :
Nội dung nào thể hiện trong các câu sau đây là sai ?
- A
Thực phẩm bảo quản ở nhiệt độ thấp hơn sẽ giữ được lâu hơn.
- B
Nấu thực phẩm trong nồi áp suất nhanh chín hơn so với khi nấu chúng ở áp suất thường.
- C
Than cháy trong oxi nguyên chất nhanh hơn khi cháy trong không khí.
- D Nhiên liệu cháy ở tầng khí quyển trên cao nhanh hơn khi cháy ở mặt đất.
Đáp án: D
Phương pháp giải:
Dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng.
Lời giải chi tiết:
Nội dung A đúng vì khi đó nhiệt độ giảm nên tốc độ phản ứng phân hủy thực phẩm giảm, thực phẩm giữ được lâu hơn.
Nội dung B đúng vì tăng áp suất tốc độ phản ứng tăng.
Nội dung C đúng vì tăng nồng độ chất phản ứng thì tốc độ phản ứng tăng.
Nội dung D sai vì ở tầng khí quyển trên cao khí oxi loãng hơn so với mặt đất nên nhiên liệu cháy chậm hơn.
Đáp án D
Câu hỏi 30 :
Tốc độ phản ứng phụ thuộc vào các yếu tố sau:
- A Nhiệt độ
- B Nồng độ, áp suất.
- C Chất xúc tác, diện tích bề mặt.
- D cả A, B, C.
Đáp án: D
Phương pháp giải:
Dựa vào kiến thức bài 36: Tốc độ phản ứng hóa học trong sgk hóa 10 – trang 150
Lời giải chi tiết:
Tốc độ phản ứng phụ thuộc vào các yếu tố: nồng độ, nhiệt độ, áp suất, chất xúc tác và bề mặt tiếp xúc.
Đáp án D
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- 20 câu hỏi cân bằng phản ứng OXH - Khử mức độ vận dụng, vận dụng cao có lời giải
- 50 câu hỏi ôn tập về bảng tuần hoàn các nguyên tố và định luật tuần hoàn có lời giải
- 40 câu hỏi lý thuyết về axit sunfuric - muối sunfat có lời giải (phần 1)
- 30 bài tập thông hiểu về cấu hình electron có lời giải (phần 1)
- 20 bài tập vận dụng về cấu hình electron có lời giải
- 20 câu hỏi cân bằng phản ứng OXH - Khử mức độ vận dụng, vận dụng cao có lời giải
- 50 câu hỏi ôn tập về bảng tuần hoàn các nguyên tố và định luật tuần hoàn có lời giải
- 40 câu hỏi lý thuyết về axit sunfuric - muối sunfat có lời giải (phần 1)
- 30 bài tập thông hiểu về cấu hình electron có lời giải (phần 1)
- 20 bài tập vận dụng về cấu hình electron có lời giải









