Trắc nghiệm Bài 3. Cấu trúc lớp vỏ electron nguyên tử - Hóa 10 Kết nối tri thức
Đề bài
Số đơn vị điện tích hạt nhân của nguyên tử fluorine là 9. Trong nguyên tử fluorine, số electron ở phân mức năng lượng cao nhất là
-
A.
2
-
B.
5
-
C.
9
-
D.
11
Các electron của ngyên tử nguyên tố X được phân ố trên 3 lớp, lớp thứ ba có 6 electron. Số đơn vị điện tích hạt nhân nguyên tử của nguyên tố X là
-
A.
6
-
B.
8
-
C.
14
-
D.
16
Nguyên tố có Z = 11 thuộc loại nguyên tố
-
A.
s
-
B.
p
-
C.
d
-
D.
f
Số electron tối đa có thể có ở phân lớp p là
-
A.
2
-
B.
6
-
C.
10
-
D.
14
Kí hiệu phân lớp nào sau đây không đúng?
-
A.
1s
-
B.
2p
-
C.
3s
-
D.
2d
Phát biểu nào sau đây là đúng?
-
A.
Trong một nguyên tử thì số neutron luôn bằng số electron.
-
B.
Các electron trên cùng một lớp có năng lượng bằng nhau.
-
C.
Trong một nguyên tử thì số proton luôn bằng số electron.
-
D.
Các electron trên cùng một phân lớp có năng lượng gần bằng nhau.
Cho các cấu hình electron sau:
(1) 1s22s1.
(2) 1s22s22p4.
(3) 1s22s22p63s23p63d104s24p5
(4) 1s22s22p63s23p1
(5) 1s22s22p63s23p63d54s1
(6) 1s22s22p63s23p2
(7) 1s2.
(8) 1s22s22p63s23p5.
(9) 1s22s22p3.
Số cấu hình electron của nguyên tố phi kim là
-
A.
4
-
B.
5
-
C.
6
-
D.
7
Cho các phát biểu sau
(1) Phân lớp d có tối đa 10 e
(2) Phân lớp đã điền số electron tối đa được gọi là phân lớp electron bão hòa.
(3) Nguyên tử nguyên tố kim loại thường có 1 hoặc 2 hoặc 3 electron ở lớp ngoài cùng.
(4) Nguyên tử nguyên tố khí hiếm thường có 5 hoặc 6 hoặc 7 electron ở lớp ngoài cùng.
(5) Các electron trên cùng một lớp có mức năng lượng bằng nhau.
(6) Ở trạng thái cơ bản, nguyên tử trung hòa điện.
Số phát biểu đúng là
-
A.
2
-
B.
1
-
C.
4
-
D.
3
Các electron được điền theo thứ tự nào sau đây?
-
A.
1s, 2s, 2p, 3s, 3p, 3d, 4s, …
-
B.
1s, 2s, 2p, 3s, 3p, 4s, 3d, …
-
C.
1s, 2s, 2p, 3s, 4s, 3p, 3d, …
-
D.
1s, 2s, 3s, 4s, 2p, 3p, 3d, …
Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố Y cũng có electron ở mức năng lượng 3p và có một electron ở lớp ngoài cùng. Nguyên tử X và Y có số electron hơn kém nhau là 2. Nguyên tố X, Y lần lượt là
-
A.
kim loại và kim loại.
-
B.
phi kim và kim loại.
-
C.
kim loại và khí hiếm.
-
D.
khí hiếm và kim loại.
Cấu hình electron của ion nào dưới đây giống khí hiếm?
-
A.
29Cu+
-
B.
26Fe2+
-
C.
19K+
-
D.
24Cr3+
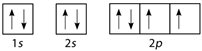
Nguyên tử M có cấu hình electron 1s22s22p4. Cấu hình electron theo ô orbital là
-
A.
-
B.

-
C.

-
D.
Cấu hình electron của nguyên tử X được biểu diễn bằng ô orbital. Thông tin nào dưới đây không đúng khi nói về cấu hình của nguyên tử X ?
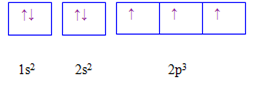
-
A.
Nguyên tử X có 7 electron.
-
B.
Lớp ngoài cùng có 3 electron
-
C.
Nguyên tử X có 3 electron độc thân.
-
D.
Nguyên tử X có 2 lớp electron.
Nguyên tử của nguyên tố X có Z = 28, cấu hình electron của ion X2+ là
-
A.
1s22s22p63s23p63d8.
-
B.
1s22s22p63s23p63d6.
-
C.
1s22s22p63s23p6 4s23d6.
-
D.
1s22s22p63s23p63d2.
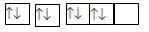
Nguyên tử của nguyên tố X có sự sắp xếp electron trên các orbital của nguyên tử như hình dưới đây. X là nguyên tố nào?
-
A.
Carbon (Z = 6).
-
B.
Fluorine (Z = 9).
-
C.
Oxygen (Z = 8).
-
D.
Nitrogen (Z = 7).
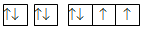
Cho các cấu hình sau của N (Z = 7). Hình vẽ nào sau đây đúng với quy tắc Hund?
-
A.
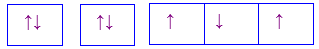
-
B.
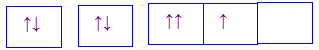
-
C.
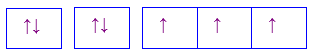
-
D.
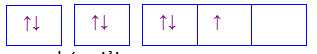
Cation X2+ và Y2- lần lượt có cấu hình electron ở phân lớp ngoài cùng là 3d6 và 2p6. Hợp chất được tạo ra giữa X và Y có công thức:
-
A.
MgO
-
B.
FeS
-
C.
MgS
-
D.
FeO
Cho các phát biểu sau:
(1) Các electron ở lớp L có mức năng lượng gần bằng nhau
(2) Các electron ở lớp M (n = 3) liên kết chặt chẽ với hạt nhân hơn các electron ở lớp K (n = 1)
(3) Các electron ở lớp L có mức năng lượng cao hơn các electron ở lớp K.
(4) Các electron ở lớp K có mức năng lượng bằng nhau.
(5) Các electron ở phân lớp 3s có mức năng lượng thấp hơn các electron ở phân lớp 2p
Số phát biểu đúng là
-
A.
2
-
B.
3
-
C.
4
-
D.
5
Cấu hình e nào sau đây là của nguyên tử Fe ?
-
A.
[Ar]3d64s2
-
B.
[Ar]4s23d6
-
C.
[Ar]3d8
-
D.
[Ar]3d74s1
Cấu hình electron của nguyên tử nguyên tố X là 1s22s22p63s23p64s1. Số hiệu nguyên tử của X là
-
A.
20
-
B.
19
-
C.
39
-
D.
18
Lời giải và đáp án
Số đơn vị điện tích hạt nhân của nguyên tử fluorine là 9. Trong nguyên tử fluorine, số electron ở phân mức năng lượng cao nhất là
-
A.
2
-
B.
5
-
C.
9
-
D.
11
Đáp án : B
Thứ tự theo chiều tăng dần của các mức năng lượng:
1s 2s 2p 3s 3p 4s 3d....
Nguyên tử F có điện tích hạt nhân Z = 9
=> Số electron của F là 9
Cấu hình electron: 1s22s22p5
Vậy số electron ở phân mức năng lượng cao nhất 2p là 5e.
Các electron của ngyên tử nguyên tố X được phân ố trên 3 lớp, lớp thứ ba có 6 electron. Số đơn vị điện tích hạt nhân nguyên tử của nguyên tố X là
-
A.
6
-
B.
8
-
C.
14
-
D.
16
Đáp án : D
+ Viết cấu hình electron của nguyên tử nguyên tố X.
+ Z = số e
Cấu hình e của nguyên tử nguyên tố X là: 1s2 2s2 2p6 3s2 3p4
Số đơn vị điện tích hạt nhân = số e = 2+2+6+2+4 = 16
Nguyên tố có Z = 11 thuộc loại nguyên tố
-
A.
s
-
B.
p
-
C.
d
-
D.
f
Đáp án : A
Nguyên tố s là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp s.
Tương tự với các nguyên tố p, d, f.
Cấu hình electron: 1s22s22p63s1
Nhận thấy e cuối cùng được điền vào phân lớp s nên X thuộc nguyên tố s.
Số electron tối đa có thể có ở phân lớp p là
-
A.
2
-
B.
6
-
C.
10
-
D.
14
Đáp án : B
Phân lớp p chứa tối đa 6 electron
Kí hiệu phân lớp nào sau đây không đúng?
-
A.
1s
-
B.
2p
-
C.
3s
-
D.
2d
Đáp án : D
- Lớp thứ nhất có 1 phân lớp, đó là phân lớp 1s
- Lớp thứ 2 có 2 phân lớp, đó là 2s và 2p
- Lớp thứ 3 có 3 phân lớp, đó là 3s, 3p và 3d
Lớp thứ 2 chỉ có 2 phân lớp là 2s và 2p, không có phân lớp 2d
Phát biểu nào sau đây là đúng?
-
A.
Trong một nguyên tử thì số neutron luôn bằng số electron.
-
B.
Các electron trên cùng một lớp có năng lượng bằng nhau.
-
C.
Trong một nguyên tử thì số proton luôn bằng số electron.
-
D.
Các electron trên cùng một phân lớp có năng lượng gần bằng nhau.
Đáp án : C
A. Sai vì trong nguyên tử, số electron = số proton
B. Sai vì các electron trong cùng 1 lớp nhưng khác phân lớp thì năng lượng không bằng nhau
C. Đúng
D. Sai vì các electron trong cùng phân lớp có năng lượng bằng nhau
Cho các cấu hình electron sau:
(1) 1s22s1.
(2) 1s22s22p4.
(3) 1s22s22p63s23p63d104s24p5
(4) 1s22s22p63s23p1
(5) 1s22s22p63s23p63d54s1
(6) 1s22s22p63s23p2
(7) 1s2.
(8) 1s22s22p63s23p5.
(9) 1s22s22p3.
Số cấu hình electron của nguyên tố phi kim là
-
A.
4
-
B.
5
-
C.
6
-
D.
7
Đáp án : B
- Các nguyên tử có 1, 2, 3 electron ở lớp ngoài cùng là các nguyên tố kim loại (trừ H, He và B)
- Các nguyên tử có 5, 6, 7 electron ở lớp ngoài cùng thường là phi kim
- Các nguyên tử có 4 electron ở lớp ngoài cùng có thể là phi kim hoặc kim loại
(1) Có 1 electron lớp ngoài cùng => Kim loại
(2) Có 6 electron lớp ngoài cùng => Phi kim
(3) Có 7 electron lớp ngoài cùng => Phi kim
(4) Có 3 electron lớp ngoài cùng => Kim loại
(5) Có 1 electron lớp ngoài cùng => Kim loại
(6) Có 4 electron lớp ngoài cùng, là phi kim
(7) Có 2 electron lớp ngoài cùng nhưng là cấu hình của He => khí hiếm
(8) Có 7 electron lớp ngoài cùng => Phi kim
(9) Có 5 electron lớp ngoài cùng => Phi kim
=> Có 5 cấu hình electron của nguyên tố phi kim
Cho các phát biểu sau
(1) Phân lớp d có tối đa 10 e
(2) Phân lớp đã điền số electron tối đa được gọi là phân lớp electron bão hòa.
(3) Nguyên tử nguyên tố kim loại thường có 1 hoặc 2 hoặc 3 electron ở lớp ngoài cùng.
(4) Nguyên tử nguyên tố khí hiếm thường có 5 hoặc 6 hoặc 7 electron ở lớp ngoài cùng.
(5) Các electron trên cùng một lớp có mức năng lượng bằng nhau.
(6) Ở trạng thái cơ bản, nguyên tử trung hòa điện.
Số phát biểu đúng là
-
A.
2
-
B.
1
-
C.
4
-
D.
3
Đáp án : C
(1) Đúng
(2) Đúng
(3) Đúng
(4) Sai, nguyên tố phi kim thường có 5, 6, 7 electron lớp ngoài cùng
(5) Sai, các electron trên cùng 1 lớp nhưng khác phân lớp thì năng lượng không bằng nhau
(6) Đúng
=> 4 đáp án đúng
Các electron được điền theo thứ tự nào sau đây?
-
A.
1s, 2s, 2p, 3s, 3p, 3d, 4s, …
-
B.
1s, 2s, 2p, 3s, 3p, 4s, 3d, …
-
C.
1s, 2s, 2p, 3s, 4s, 3p, 3d, …
-
D.
1s, 2s, 3s, 4s, 2p, 3p, 3d, …
Đáp án : B
Thứ tự sắp xếp các electron theo mức năng lượng là
1s 2s 2p 3s 3p 4s 3d 4p 5s...
Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố Y cũng có electron ở mức năng lượng 3p và có một electron ở lớp ngoài cùng. Nguyên tử X và Y có số electron hơn kém nhau là 2. Nguyên tố X, Y lần lượt là
-
A.
kim loại và kim loại.
-
B.
phi kim và kim loại.
-
C.
kim loại và khí hiếm.
-
D.
khí hiếm và kim loại.
Đáp án : B
Các electron được điền vào phân lớp theo thứ tự
1s 2s 2p 3s 3p 4s 3d 4p 5s...
- Nguyên tử Y có electron ở mức năng lượng 3p và có 1 electron ở lớp ngoài cùng
=> 1s22s22p63s23p64s1
=> Nguyên tử Y có 1 electron ở lớp ngoài cùng => Y là kim loại
- Nguyên tử X có electron ở mức năng lượng cao nhất là 3p và hơn kém nguyên tử Y 2 elctron
=> 1s22s22p63s23p5
=> Nguyên tử X có 7 electron ở lớp ngoài cùng => X là phi kim
Cấu hình electron của ion nào dưới đây giống khí hiếm?
-
A.
29Cu+
-
B.
26Fe2+
-
C.
19K+
-
D.
24Cr3+
Đáp án : C
Các nguyên tử nguyên tố có xu hướng nhường hoặc nhận electron để giống cấu hình của khí hiếm
19K+ có cấu hình giống với khí hiếm Ar (Z=18)
Đáp án C
Nguyên tử M có cấu hình electron 1s22s22p4. Cấu hình electron theo ô orbital là
-
A.

-
B.

-
C.

-
D.

Đáp án : A
Mỗi AO chứa tối đa 2 electron được kí hiệu 2 dấu mũi tên ngược nhau. Điền AO dựa trên nguyên lí Pauli
Nguyên tử M có cấu hình electron 1s22s22p4 tương ứng với các orbital là:
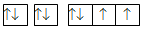
Đáp án A
Cấu hình electron của nguyên tử X được biểu diễn bằng ô orbital. Thông tin nào dưới đây không đúng khi nói về cấu hình của nguyên tử X ?

-
A.
Nguyên tử X có 7 electron.
-
B.
Lớp ngoài cùng có 3 electron
-
C.
Nguyên tử X có 3 electron độc thân.
-
D.
Nguyên tử X có 2 lớp electron.
Đáp án : B
Dựa vào cấu hình của nguyên tử X
Nguyên tử X có 2 lớp electron; lớp ngoài cùng có 5 electron
Đáp án B
Nguyên tử của nguyên tố X có Z = 28, cấu hình electron của ion X2+ là
-
A.
1s22s22p63s23p63d8.
-
B.
1s22s22p63s23p63d6.
-
C.
1s22s22p63s23p6 4s23d6.
-
D.
1s22s22p63s23p63d2.
Đáp án : A
Ion X2+ đã nhường đi 2 electron
Cấu hình của nguyên tố X: 1s22s22p63s23p63d10 =>
cấu hình ion X2+: 1s22s22p63s23p63d8
Đáp án A
Nguyên tử của nguyên tố X có sự sắp xếp electron trên các orbital của nguyên tử như hình dưới đây. X là nguyên tố nào?

-
A.
Carbon (Z = 6).
-
B.
Fluorine (Z = 9).
-
C.
Oxygen (Z = 8).
-
D.
Nitrogen (Z = 7).
Đáp án : C
Mỗi AO chứa tối đa 2 electron
Nguyên tố X có 8 electron
Đáp án C
Cho các cấu hình sau của N (Z = 7). Hình vẽ nào sau đây đúng với quy tắc Hund?
-
A.

-
B.

-
C.

-
D.

Đáp án : C
Dựa vào quy tắc Hund
N có 7 electron vào có 3 electron phân lớp p, theo quy tắc Hund, các electron được điền đủ vào AO
Đáp án C
Cation X2+ và Y2- lần lượt có cấu hình electron ở phân lớp ngoài cùng là 3d6 và 2p6. Hợp chất được tạo ra giữa X và Y có công thức:
-
A.
MgO
-
B.
FeS
-
C.
MgS
-
D.
FeO
Đáp án : D
X2+: 1s2 2s2 2p6 3s2 3p6 3d6 X: 1s2 2s2 2p6 3s2 3p6 3d6 4s2 X là Fe
Y2-: 1s2 2s2 2p6 Y: 1s2 2s2 2p4 Y là O
Vậy XY là FeO Chọn D
Cho các phát biểu sau:
(1) Các electron ở lớp L có mức năng lượng gần bằng nhau
(2) Các electron ở lớp M (n = 3) liên kết chặt chẽ với hạt nhân hơn các electron ở lớp K (n = 1)
(3) Các electron ở lớp L có mức năng lượng cao hơn các electron ở lớp K.
(4) Các electron ở lớp K có mức năng lượng bằng nhau.
(5) Các electron ở phân lớp 3s có mức năng lượng thấp hơn các electron ở phân lớp 2p
Số phát biểu đúng là
-
A.
2
-
B.
3
-
C.
4
-
D.
5
Đáp án : B
Dựa vào kiến thức về cấu hình electron
(1), (3), (4) đúng
Đáp án B
Cấu hình e nào sau đây là của nguyên tử Fe ?
-
A.
[Ar]3d64s2
-
B.
[Ar]4s23d6
-
C.
[Ar]3d8
-
D.
[Ar]3d74s1
Đáp án : A
Fe có Z = 26
Cấu hình nguyên tử Fe: [Ar]3d64s2
Đáp án A
Cấu hình electron của nguyên tử nguyên tố X là 1s22s22p63s23p64s1. Số hiệu nguyên tử của X là
-
A.
20
-
B.
19
-
C.
39
-
D.
18
Đáp án : B
Dựa vào cấu hình electron của X
Cấu hình của nguyên tố X: 1s22s22p63s23p64s1 => X có 19 electron
Đáp án B
Luyện tập và củng cố kiến thức Bài 2. Nguyên tố hóa học Hóa 10 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 1. Thành phần của nguyên tử Hóa 10 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
- Trắc nghiệm Bài 22. Hydrogen halide. Muối halide - Hóa 10 Kết nối tri thức
- Trắc nghiệm Bài 21. Nhóm halogen - Hóa 10 Kết nối tri thức
- Trắc nghiệm Bài 19. Tốc độ phản ứng - Hóa 10 Kết nối tri thức
- Trắc nghiệm Bài 17. Biến thiên enthalpy trong các phản ứng hóa học - Hóa 10 Kết nối tri thức
- Trắc nghiệm Bài 15. Phản ứng oxi hóa - khử - Hóa 10 Kết nối tri thức









