1. Tính khử của kim loại
Các nguyên tử kim loại dễ nhường electron hoá trị:
\({\rm{M}} \to {{\rm{M}}^{{\rm{n + }}}}{\rm{ + ne}}\) (M là kí hiệu, n là hoá trị của kim loại)
=> tính chất hoá học chung của kim loại là tính khử.
2. Tác dụng với oxygen
Hầu hết các kim loại (trừ vàng, bạc, platinum,...) đều tác dụng với oxygen tạo thành oxide.
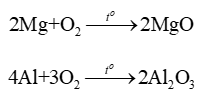
3. Tác dụng với chlorine
Hầu hết các kim loại đều tác dụng với khí chlorine khi đun nóng, thu được muối chloride tương ứng.
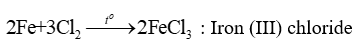
4. Tác dụng với lưu huỳnh (sulfur)
Nhiều kim loại có thể khử lưu huỳnh khi đun nóng (trừ thuỷ ngân phản ứng ngay ở nhiệt độ thường).
\({\rm{F}}{{\rm{e}}_{{\rm{(s)}}}}{\rm{ + }}{{\rm{S}}_{{\rm{(s)}}}} \to {\rm{Fe}}{{\rm{S}}_{{\rm{(s)}}}}\)
\({\rm{H}}{{\rm{g}}_{{\rm{(l)}}}}{\rm{ + }}{{\rm{S}}_{{\rm{(s)}}}} \to {\rm{Hg}}{{\rm{S}}_{{\rm{(s)}}}}\)
5. Tác dụng với nước
2M + 2nH2O \( \to \)2M(OH)n + nH2 (\({\rm{E}}_{{{\rm{M}}^{{\rm{n + }}}}{\rm{/M}}}^{\rm{o}}{\rm{ < - 0,414(V)}}\) và n = hoá trị kim loại)
|
Thế điện cực chuẩn |
\({\rm{E}}_{{{\rm{M}}^{{\rm{n + }}}}{\rm{/M}}}^{\rm{o}}{\rm{ < - 0,414(V)}}\) |
\({\rm{E}}_{{{\rm{M}}^{{\rm{n + }}}}{\rm{/M}}}^{\rm{o}}{\rm{ = - 0,414(V)}}\) |
\({\rm{E}}_{{{\rm{M}}^{{\rm{n + }}}}{\rm{/M}}}^{\rm{o}}{\rm{ > - 0,414(V)}}\) |
|
Kim loại |
K, Na, Ca, Ba |
Mg |
Ni, Sn, Pb, Cu, Ag, Au,... |
|
Mức độ phàn ứng với nước |
Phàn ứng nhanh ờ nhiệt độ thường |
Phản ứng rất chậm ở nhiệt độ thường, phản ứng nhanh hơn khi đun nóng |
Không phản ứng dù ở nhiệt độ cao |
Ví dụ: Na có \({\rm{E}}_{{\rm{N}}{{\rm{a}}^{\rm{ + }}}{\rm{/Na}}}^{\rm{o}}{\rm{ < - 2,71(V)}}\) < - 0,414 (V) => Na phản ứng với nước ở nhiệt độ thường.
Na (s) + H2O(l) \( \to \) 2NaOH(aq) + H2(g)
6. Tác dụng với acid thông thường
M + HCl, H2SO4 \( \to \) MCln, M2(SO4)n + H2 (\({\rm{E}}_{{{\rm{M}}^{{\rm{n + }}}}{\rm{/M}}}^{\rm{o}}{\rm{ < 0 (V)}}\)= KL trước H và n hoá trị thấp).
Do Fe có \({\rm{E}}_{{\rm{F}}{{\rm{e}}^{{\rm{2 + }}}}{\rm{/Fe}}}^{\rm{o}}{\rm{ < - 0,44 (V)}}\)< 0 => Fe tác dụng với H2SO4 loãng tạo khí H2
\({\mathop {{\rm{Fe}}}\limits^{\rm{0}} _{\left( {\rm{s}} \right)}}{\rm{ + }}{\mathop {\rm{H}}\limits^{{\rm{ + 1}}} _{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}_{\left( {{\rm{aq}}} \right)} \to \mathop {{\rm{Fe}}}\limits^{{\rm{ + 2}}} {\rm{S}}{{\rm{O}}_{\rm{4}}}_{\left( {{\rm{aq}}} \right)}{\rm{ + }}{\mathop {\rm{H}}\limits^{\rm{0}} _{\rm{2}}}_{\left( {\rm{g}} \right)}\)
7. Tác dụng với acid đặc
Hầu hêt kim loại (trừ Pt, Au) khử được S (trong H2SO4 đặc) xuống số oxi hoá thấp hơn.
\[{\mathop {Cu}\limits^0 _{\left( s \right)}}{\rm{ }} + {\rm{ }}2{H_2}\mathop S\limits^{ + 6} {O_4} \to \mathop {Cu}\limits^{ + 2} S{O_4}_{\left( {aq} \right)}{\rm{ }} + {\rm{ }}\mathop S\limits^{ + 4} {O_2}_{\left( g \right)}{\rm{ }} + {\rm{ }}2{H_2}{O_{\left( / \right)}}\]
Chú ý: HNO3 đặc, nguội và H2SO4 đặc, nguội làm thụ động hoá Al, Fe, Cr,...
8. Tác dụng với dung dịch muối
Kim loại không tan trong nước và có giá trị thế điện cực chuẩn nhỏ hơn thường tác dụng được với dung dịch muối của kim loại có giá trị thế điện cực lớn hơn ở điều kiện chuẩn.
Ví dụ: \({\rm{E}}_{C{u^{{\rm{2 + }}}}{\rm{/Cu}}}^{\rm{o}}{\rm{ = 0,34 (V)}}\) < \({\rm{E}}_{{\rm{A}}{{\rm{g}}^{\rm{ + }}}{\rm{/Ag}}}^{\rm{o}}{\rm{ = 0,799 (V)}}\) => Cu phản ứng được với AgNO3.
\(C{u_{\left( s \right)}}{\rm{ }} + {\rm{ }}2AgN{O_3}_{\left( {aq} \right)} \to Cu{\left( {N{O_3}} \right)_2}_{\left( {aq} \right)}{\rm{ }} + {\rm{ }}2A{g_{\left( s \right)}}\)

 Đại cương về kim loại - Từ điển Hoá 12
Đại cương về kim loại - Từ điển Hoá 12 






Danh sách bình luận