Ôn tập chương 3 trang 42, 43 SBT Hóa 10 Chân trời sáng tạo
Ion nào sau đây có cấu hình electron của khí hiếm helium? A. Mg2+. B. O2-. C. Na+. D. Li+. Trong sự hình thành phân tử lithium fluoride (LiF), ion lithium và ion fluoride đã lần lượt đạt được cấu hình electron bền của các khí hiếm nào? A. Helium và neon. B. Helium và argon. C. Neon và argon. D. Cùng là neon.
3.1
Ion nào sau đây có cấu hình electron của khí hiếm helium?
A. Mg2+.
B. O2-.
C. Na+.
D. Li+.
Phương pháp giải:
- Bước 1: Xác định vị trí nguyên tử của nguyên tố trong bảng tuần hoàn
- Bước 2: Xác định vị trí khí hiếm gần nhất với nguyên tố đó
Lời giải chi tiết:
- Bước 1: Vị trí của các nguyên tố trong bảng tuần hoàn hóa học
|
Nhóm Chu kì |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
VIIIA |
|
1 |
|
|
|
|
|
|
|
He |
|
2 |
Li |
|
|
|
|
O |
|
|
|
3 |
Na |
Mg |
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
- Bước 2: Nguyên tố Lithium (ô số 3) có vị trí gần với khí hiếm Helium (ô số 2) nhất
=> Nguyên tử của nguyên tố Lithium sẽ cho đi 3 - 2 = 1 electron để đạt cấu hình của khí hiếm gần nhất => Cấu hình electron của Li+: 1s2
=> Đáp án: D
3.2
Trong sự hình thành phân tử lithium fluoride (LiF), ion lithium và ion fluoride đã lần lượt đạt được cấu hình electron bền của các khí hiếm nào?
A. Helium và neon.
B. Helium và argon.
C. Neon và argon.
D. Cùng là neon.
Phương pháp giải:
- Bước 1: Xác định vị trí nguyên tử của nguyên tố trong bảng tuần hoàn
- Bước 2: Xác định vị trí khí hiếm gần nhất với nguyên tố đó
Lời giải chi tiết:
- Bước 1: Vị trí của các nguyên tố trong bảng tuần hoàn hóa học
|
Nhóm Chu kì |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
VIIIA |
|
1 |
|
|
|
|
|
|
|
He |
|
2 |
Li |
|
|
|
|
|
F |
Ne |
|
3 |
|
|
|
|
|
|
|
Ar |
|
4 |
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
- Bước 2:
+ Nguyên tố Lithium có vị trí gần với khí hiếm Helium nhất
+ Nguyên tố Fluorine có vị trí gần với khí hiếm Neon nhất
=> Đáp án: A
3.3
Không cần sử dụng hiệu độ âm điện, có bao nhiêu phân tử trong số các phân tử sau có liên kết ion BaCl2, CS2, Na2O và HI?
A. 3.
B. 2.
C. 4.
D. 1.
Phương pháp giải:
Dựa vào vị trí của các nguyên tố để xác định kim loại điển hình và phi kim điển hình. Phân tử nào chứa kim loại điển hình và phi kim điển hình thì sẽ có chứa liên kết ion
Lời giải chi tiết:
- Vị trí của các nguyên tố trong bảng tuần hoàn hóa học
|
Nhóm Chu kì |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
VIIIA |
|
1 |
H |
|
|
|
|
|
|
|
|
2 |
|
|
|
C |
|
O |
|
|
|
3 |
Na |
|
|
|
|
S |
Cl |
|
|
4 |
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
I |
|
|
6 |
|
Ba |
|
|
|
|
|
|
- Từ vị trí trong bảng tuần hoàn ta thấy: Na và Ba là các kim loại điển hình; Cl, O là các phi kim điển hình
=> Các phân tử BaCl2 và Na2O chứa liên kết ion
3.4
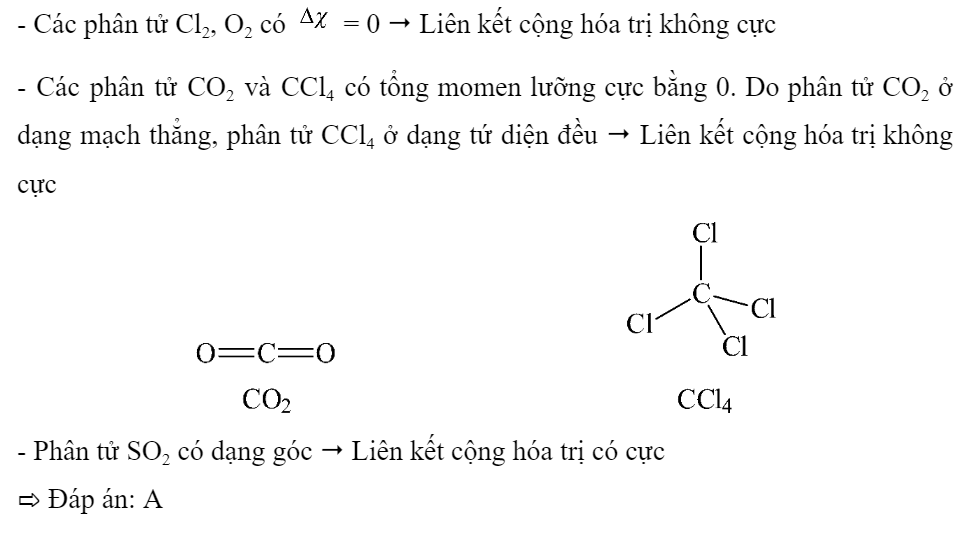
Tổng số các phân tử có cực trong số các phân tử sau: Cl2, O2, CCl4, CO2 và SO2 là bao nhiêu?
A. 1.
B. 2.
C. 4.
D. 3.
Phương pháp giải:
|
Hiệu độ âm điện (\(\Delta \chi \)) |
Loại liên kết |
|
\(0 \le \Delta \chi < 0,4\) |
Cộng hóa trị không phân cực |
|
\(0,4 \le \Delta \chi < 1,7\) |
Cộng hóa trị phân cực |
|
\(\Delta \chi \ge 1,7\) |
Ion |
- Các phân tử chỉ gồm 2 nguyên tử của 1 nguyên tố có liên kết cộng hóa trị không phân cực. Ví dụ như: H2, Cl2, O2,…
- Tổng moment lưỡng cực của một phân tử bằng 0 thì phân tử không phân cực
Lời giải chi tiết:
3.5
Phân tử sodium fluoride (NaF) và magnesium oxide (MgO) có cùng 20 electron và khoảng cách giữa các hạt nhân là tương tự nhau (235 pm và 215 pm). Giải thích tại sao nhiệt độ nóng chảy của NaF và MgO lại chênh lệch nhiều (992°C so với 2642°C).
Phương pháp giải:
- Bước 1: So sánh điện tích nguyên tử của các nguyên tố
- Bước 2: So sánh bán kính nguyên tử của các nguyên tố/ Khoảng cách giữa các hạt nhân
- Bước 3: Dựa vào nhận xét
Lời giải chi tiết:
- Ion O2- có điện tích lớn hơn F-
- Ion Mg2+ có điện tích lớn hơn Na+
=> Liên kết trong MgO bền hơn so với NaF => MgO có nhiệt độ nóng chảy cao hơn so với NaF
3.6
Lithium fluoride (LiF) và sodium chloride (NaCl) đều là các hợp chất ion. Dự đoán nhiệt độ sôi và nhiệt độ nóng chảy của chất nào cao hơn. Giải thích.
Phương pháp giải:
- Bước 1: So sánh điện tích nguyên tử của các nguyên tố
- Bước 2: So sánh bán kính nguyên tử của các nguyên tố/ Khoảng cách giữa các hạt nhân
- Bước 3: Dựa vào nhận xét
Lời giải chi tiết:
- Ion F- có điện tích bằng Cl-
- Ion Li+ có điện tích bằng Na+
- Bán kính nguyên tử F < bán kính nguyên tử Cl
- Bán kính nguyên tử Li < bán kính nguyên tử Na
=> Độ dài liên kết giữa LiF sẽ ngắn hơn độ dài liên kết giữa NaCl
=> nhiệt độ sôi và nhiệt độ nóng chảy của LiF cao hơn NaCl
3.7
Sodium peroxide (Na2O2) là một chất rắn màu vàng, thu được khi đốt sodium trong khí oxygen dư. Sodium peroxide được dùng để tẩy trắng gỗ, bột giấy,... Nêu rõ bản chất hoá học giữa các nguyên tử (hoặc nhóm nguyên tử) trong phân tử Na2O2
Phương pháp giải:
- Bước 1: Viết cấu hình electron của các nguyên tử và xác định số electron lớp ngoài cùng của các nguyên tử
- Bước 2: Viết sự hình thành ion
- Bước 3: Tạo liên kết ion giữa các nguyên tử
- Bước 4: Viết công thức cấu tạo của phân tử
Lời giải chi tiết:

3.8
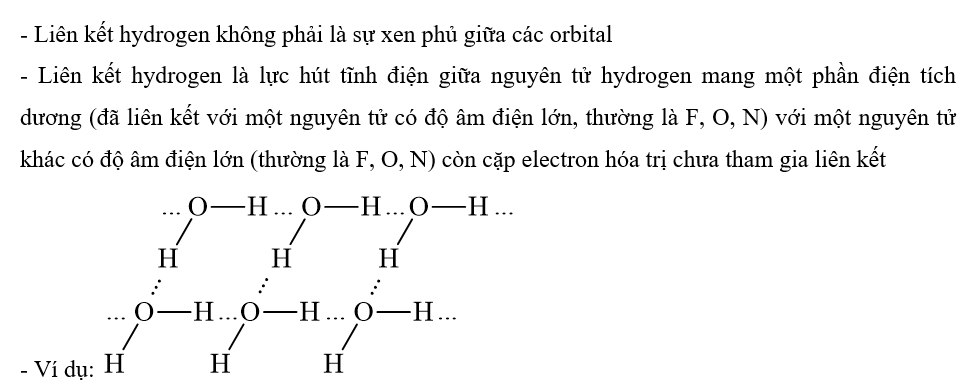
Liên kết hydrogen có phải là sự xen phủ giữa các orbital? Giải thích và cho ví dụ minh hoạ.
Phương pháp giải:
Dựa vào định nghĩa liên kết hydrogen: Liên kết hydrogen là một loại liên kết yếu, được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn, thường là F, O, N) với một nguyên tử khác có độ âm điện lớn (thường là F, O, N) còn cặp electron hóa trị chưa tham gia liên kết
Lời giải chi tiết:
3.9
Năng lượng liên kết và độ dài liên kết của C-C, C=C và C≡C trong các phân tử C2H6, C2H4 và C2H2 được cho bởi bảng sau:
|
Liên kết |
C-C trong C2H6 |
C=C trong C2H4 |
C≡C trong C2H2 |
|
Năng lượng liên kết (kJ/mol) |
347 |
614 |
839 |
|
Độ dài liên kết (nm) |
0,154 |
0,134 |
0,121 |
a) Nêu mối quan hệ giữa chiều dài liên kết và năng lượng liên kết giữa các nguyên tử carbon trong các hydrocarbon đã cho.
b) Giải thích vì sao giá trị năng lượng liên kết tăng theo thứ tự C-C, C=C, C≡C.
Phương pháp giải:
- Độ dài liên kết và năng lượng liên kết tỉ lệ nghịch với nhau
- Độ bền của liên kết tăng khi độ dài của liên kết tỉ lệ nghịch với nhau
- Giữa 2 nguyên tử chứa càng nhiều liên kết thì độ bền của phân tử đó càng lớn => Sắp xếp về độ bền theo thứ tự giảm dần: Liên kết ba > Liên kết đôi > Liên kết đơn
Lời giải chi tiết:
a) Chiều dài liên kết và năng lượng liên kết giữa các nguyên tử carbon trong các hydrocarbon tỉ lệ nghịch với nhau
b) - Giữa 2 nguyên tử chứa càng nhiều liên kết thì độ bền của phân tử đó càng lớn
- Độ bền càng cao thì giá trị năng lượng liên kết càng cao
=> Giá trị năng lượng liên kết tăng dần theo thứ tự: Liên kết đơn > Liên kết đôi > Liên kết ba
3.10
Ethane (C2H6) và fluoromethane (CH3F) có kích thước tương đương nhau và đều có 18 electron. Như vậy khả năng hình thành các lưỡng cực tạm thời và lưỡng cực cảm ứng ở cả hai phân tử là như nhau dẫn đến nhiệt độ sôi của chúng phải tương tự nhau. Tuy nhiên, C2H6 có nhiệt độ sôi là -89,0°C thấp hơn so với CH3F là -78,3°C. Giải thích.
Phương pháp giải:
- Các yếu tố ảnh hưởng đến tương tác van der Waals
+ Số electron trong các phân tử: Phân tử nào có nhiều electron hơn => tương tác van der Waals mạnh hơn
+ Kích thước/ diện tích tiếp xúc của phân tử: Phân tử nào có kích thước/ diện tích tiếp xúc lớn hơn " tương tác van der Waals mạnh hơn
+ Độ phân cực của phân tử: Phân tử nào phân cực hơn => tương tác van der Waals mạnh hơn
- Đặc điểm của tương tác van der Waals:
+ Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất
+ Khi khối lượng phân tử tăng, kích thước phân tử tăng thì tương tác van der Waals tăng
Lời giải chi tiết:
- C2H6 và CH3F có kích thước (phân tử khối) xấp xỉ nhau
- C2H6 và CH3F đều có cùng số electron (14 electron)
- C2H6 là phân tử không phân cực và CH3F là phân tử phân cực => Nhiệt độ sôi của CH3F cao hơn nhiệt độ sôi của C2H6
- Bài 11. Liên kết Hydrogen và tương tác van der Waals trang 39, 40, 41 SBT Hóa 10 Chân trời sáng tạo
- Bài 10. Liên kết cộng hóa trị trang 34, 35, 36 SBT Hóa 10 Chân trời sáng tạo
- Bài 9. Liên kết ion trang 30, 31, 32 SBT Hóa 10 Chân trời sáng tạo
- Bài 8. Quy tắc Octet trang 28, 29 SBT Hóa 10 Chân trời sáng tạo
Luyện Bài Tập Trắc nghiệm Hóa 10 - Chân trời sáng tạo - Xem ngay
Các bài khác cùng chuyên mục
- Ôn tập chương 7 trang 83, 84 SBT Hóa 10 Chân trời sáng tạo
- Bài 18. Hydrogen halide và một số phản ứng của ion halide trang 79, 80, 81 SBT Hóa 10 Chân trời sáng tạo
- Bài 17. Tính chất vật lí và hóa học các đơn chất nhóm VIIA trang 75, 76, 77 SBT Hóa 10 Chân trời sáng tạo
- Ôn tập chương 6 trang 73, 74 SBT Hóa 10 Chân trời sáng tạo
- Bài 16. Các yếu tố ảnh hường đến tốc độ phản ứng hóa học trang 67, 68, 69 SBT Hóa 10 Chân trời sáng tạo
- Ôn tập chương 7 trang 83, 84 SBT Hóa 10 Chân trời sáng tạo
- Bài 18. Hydrogen halide và một số phản ứng của ion halide trang 79, 80, 81 SBT Hóa 10 Chân trời sáng tạo
- Bài 17. Tính chất vật lí và hóa học các đơn chất nhóm VIIA trang 75, 76, 77 SBT Hóa 10 Chân trời sáng tạo
- Ôn tập chương 6 trang 73, 74 SBT Hóa 10 Chân trời sáng tạo
- Bài 16. Các yếu tố ảnh hường đến tốc độ phản ứng hóa học trang 67, 68, 69 SBT Hóa 10 Chân trời sáng tạo












