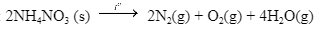Đốt cháy hoàn toàn 1 gam (ở thể hơi) mỗi chất trong dãy CH4, CH3Cl, CH2Cl2, CHCl3, CCl4 sẽ tỏa ra bao nhiêu kilôJun nhiệt lượng trong điều kiện chuẩn? Biết sản phẩm phản ứng là CO2, H2O, HCl, Cl2 đều ở thể khí. Năng lượng của một số liên kết được cho ở Phụ lục 3.
Áp dụng công thức:
\({\Delta _r}H_{298}^0 = a \times {E_b}(A) + b{E_b}(B) - m{E_b}(M) - n{E_b}(N)\)
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
\(\begin{array}{l}{\Delta _r}H_{298}^0 = {E_b}(C{H_4}) + 2{E_b}({O_2}) - {E_b}(C{O_2}) - 2{E_b}({H_2}O)\\ = > {\Delta _r}H_{298}^0 = 4{E_{C - H}} + 2.{E_{O = O}} - 2.{E_{C = O}} - 2.2{E_{H - O}}\\ = > {\Delta _r}H_{298}^0 = 4.414 + 2.498 - 2.736 - 2.2.464 = - 676(kJ)\end{array}\)
=> Đốt cháy 1 mol CH4(g) tỏa ra 676 kJ nhiệt lượng
⇒ Đốt cháy 1 gam (ứng với \(\frac{1}{{16}}\)mol) CH4 tỏa ra: \(676.\frac{1}{{16}} = 42,25(kJ)\)
2CH3Cl(g) + 3O2(g) → 2CO2(g) + 2H2O(g) + 2HCl(g)
\({\Delta _r}H_{298}^0 = 2{E_b}(C{H_3}Cl) + 3{E_b}({O_2}) - 2{E_b}(C{O_2}) - 2{E_b}({H_2}O) - 2{E_b}(HCl)\)
\( = > {\Delta _r}H_{298}^0 = 2.(3{E_{C - H}} + {E_{C - Cl}}) + 3.{E_{O = O}} - 2.2.{E_{C = O}} - 2.2{E_{H - O}} + 2.{E_{H - Cl}}\)
\( = > {\Delta _r}H_{298}^0 = 2(3.414 + 339) + 3.498 - 2.2.736 - 2.2.464 - 2.431 = - 1006(kJ)\)
=> Đốt cháy 2 mol CH3Cl(g) tỏa ra 1006 kJ nhiệt lượng
=> Đốt cháy 1g CH3Cl(g) ứng với \(\frac{1}{{50,5}}\)mol CH3Cl(g) tỏa ra \(\frac{{1006}}{{50,5 \times 2}} = 9,96\) (kJ)
2CH2Cl2(g) + 3O2(g) → 2CO2(g) + 2H2O(g) + 2Cl2(g)
\(\begin{array}{l}{\Delta _r}H_{298}^0 = 2{E_b}(C{H_2}C{l_2}) + 3{E_b}({O_2}) - 2{E_b}(C{O_2}) - 2{E_b}({H_2}O) - 2{E_b}(C{l_2})\\ = > {\Delta _r}H_{298}^0 = 2.(2{E_{Cl - Cl}} + 2{E_{C - H}}) + 3.{E_{O = O}} - 2.2.{E_{C = O}} - 2.2{E_{O - H}} - 2{E_{Cl - Cl}}\\ = > {\Delta _r}H_{298}^0 = 2.(2.339 + 2.414) + 3.498 - 2.2.736 - 2.2.464 - 2.243 = - 780(kJ)\end{array}\)
=> Đốt cháy 2 mol CH2Cl2(g) tỏa ra 780 kJ nhiệt lượng
=> Đốt cháy 1g CH2Cl2 (g) ứng với \(\frac{1}{{85}}\)mol CH2Cl2 (g) tỏa ra \(\frac{{780}}{{2 \times 85}} = 4,59(kJ)\)
4CHCl3(g) + 5O2(g) → 4CO2(g) + 2H2O(g) + 6Cl2(g)
\(\begin{array}{l}{\Delta _r}H_{298}^0 = 4{E_b}(CHC{l_3}) + 5{E_b}({O_2}) - 4{E_b}(C{O_2}) - 2{E_b}({H_2}O) - 6{E_b}(C{l_2})\\ = > {\Delta _r}H_{298}^0 = 4.(3{E_{C - Cl}} + {E_{C - H}}) + 5.{E_{O = O}} - 4.2.{E_{C = O}} - 2.2{E_{O - H}} - 6{E_{Cl - Cl}}\\ = > {\Delta _r}H_{298}^0 = 4.(3.339 + 414) + 5.498 - 4.2.736 - 2.2.464 - 6.243 = \\ = > {\Delta _r}H_{298}^0 = - 988(kJ)\end{array}\)
=> Đốt cháy 4 mol CHCl3(g) tỏa ra 988 kJ nhiệt lượng
=> Đốt cháy 1g CHCl3(g) ứng với \(\frac{1}{{119,5}}\)mol CHCl3 (g) tỏa ra \(\frac{{988}}{{4.119,5}} = 2,07(kJ)\)
CCl4(g) + O2(g) → CO2(g) + 2Cl2(g)
\(\begin{array}{l}{\Delta _r}H_{298}^0 = {E_b}(CC{l_4}) + {E_b}({O_2}) - {E_b}(C{O_2}) - 2{E_b}(C{l_2})\\ = > {\Delta _r}H_{298}^0 = (4{E_{C - Cl}}) + {E_{O = O}} - 2.{E_{C = O}} - 2{E_{Cl - Cl}}\\ = > {\Delta _r}H_{298}^0 = 4.339 + 498 - 2.736 - 2.243 = - 104(kJ)\end{array}\)
=> Đốt cháy 1 mol CCl4(g) tỏa ra 104 kJ nhiệt lượng
=> Đốt cháy 1g CCl4 (g) ứng với \(\frac{1}{{154}}\)mol CCl4 (g) tỏa ra \(\frac{{104}}{{154}} = 0,68(kJ)\)

Các bài tập cùng chuyên đề
Khi thể tích oxygen giảm còn 15% thể tích không khí thì nồng độ mol/L của oxygen là bao nhiêu?
Ở điều kiện thường (298K), oxygen chiếm khoảng 20,9% theo thể tích trong không khí, tương đương với áp suất 0,209 atm. Tính nồng độ mol/L của oxygen trong không khí.
Tính biến thiên enthalpy của phản ứng đốt cháy 1 mol octane (C8H18, chất có trong xăng) và 1 mol methane (thành phần chính của khí thiên nhiên). Dự đoán mức độ mãnh liệt của các phản ứng này.
Dựa vào dự liệu Bảng 7.1 và 7.2, em hãy tính biến thiên enthalpy của phản ứng đốt cháy 1 mol ethanol và 1 mol khí gas.
Các hiện tượng cháy, nổ xảy ra hầu hết do các phản ứng hóa học gây nên, tỏa nhiều nhiệt, tốc độ phản ứng lớn. Do đó, hóa học đóng vai trò rất quan trọng trong việc nghiên cứu nguyên nhân, đưa ra các biện pháp phòng chống cũng như xử lí khi xảy ra hỏa hoạn một cách hiệu quả và an toàn nhất. Nhiệt của phản ứng cháy, nổ được xác định như thế nào? Các yếu tố nào ảnh hưởng đến mức độ mãnh liệt của phản ứng cháy, nổ?
Hexachlorobenzene rắn (C6Cl6) là chất cực kì độc hại với con người nên được bảo quản rất kĩ lưỡng. Nếu xảy ra hỏa hoạn nhà kho có chứa C6Cl6 thì chất này có dễ dàng bị tiêu hủy bởi phản ứng cháy với oxygen hay không? Hãy dự đoán bằng cách tính biến thiên enthalpy của phản ứng. Biết rằng phản ứng cháy sinh ra CO2 và Cl2.
Hỗn hợp bột Al và NH4ClO4 được dùng làm nhiên liệu rắn cho tên lửa. Hỗn hợp bột Al và Fe2O3 được dùng để hàn kim loại. Phản ứng xảy ra khi sử dụng các hỗn hợp bột này như sau:
3Al(s) + 3NH4ClO4(s) → Al2O3(s) + AlCl3(s) + 3NO(g) + 6H2O(g) (1)
2Al(s) + Fe2O3(s) → Al2O3(s) + 2Fe(l) (2)
Các giá trị \({\Delta _f}H_{298}^0\)(kJ/mol) tra ở Phụ lục 2.
a) Bằng tính toán hãy cho biết: 1 gam hỗn hợp bột nào (trộn theo đúng tỉ lệ phản ứng) tỏa ra nhiều nhiệt hơn. Từ đó dự đoán phản ứng nào xảy ra mãnh liệt hơn.
b) Có thể dùng hỗn hợp bột Al và Fe2O3 làm nhiên liệu trong động cơ tên lửa được không?
Hãy tính ứng với 1 gam chất muối mỗi phản ứng (1’), (2’), (3’)
Xác định nhiệt lượng (kJ) tỏa ra khi đốt cháy hoàn toàn 1 gam mỗi chất CH4, C2H2 ở điều kiện chuẩn. Biết các sản phẩm thu được đều ở thể khí.
So sánh mức độ mãnh liệt của phản ứng đốt cháy các chất trên
Nhắc lại cách tính biến thiên theo enthalpy phản ứng theo năng lượng liên kết.
Có những cách nào để tính biến thiên enthalpy của phản ứng?
Ngày 04 tháng 8 năm 2020 đã xảy ra một vụ nổ kinh hoàng ở nhà kho tại cảng Beriut của Lebanon. Đây là nhà kho chứa khoảng 2700 tấn NH4NO3, một loại hóa chất vừa được sử dụng làm phân bón, vừa được dùng làm thuốc nổ do có khả năng phân hủy thành khí và hơi, kèm theo tỏa nhiệt mạnh:
Xét phản ứng: CH4(g) + O2(g) → CO2(g) + 2H2O(g) \({\Delta _r}H_{298}^0 = - 802\) kJ
Tính \({\Delta _f}H_{298}^0\)CH4(g), biết \({\Delta _f}H_{298}^0\)của CO2 (g) và H2O (g) lần lượt là -394 kJ/mol và -242 kJ/mol.
Phản ứng cháy, nổ được đặc trưng bởi hiệu ứng tỏa nhiệt mạnh, tốc độ phản ứng nhanh, phản ứng trước cung cấp nhiệt cho phản ứng sau và xảy ra nối tiếp. Vậy, hiệu ứng nhiệt của phản ứng đốt cháy một số nhiên liệu phổ biến được xác định như thế nào và giá trị thu được có ý nghĩa gì?
Cho các hiện tượng nổ sau : (a) Nổ cốc thí nghiệm khi cho lượng sodium quá lớn vào cốc thủy tính chứa nước, (b) nổ nồi hơi, (c) nổ thuốc súng (potassium, carbon và sulfur), (d) nổ bình khí nén, (e) nổ đường ống dẫn khí, (f) nổ thuốc nổ TNT (trinitrotoluene), (g) nổ khoang tàu chứa dầu đã hút cạn dầu. Số hiện tượng nổ hóa học là ?