Bài 29. Một số tính chất và ứng dụng của phức chất trang 138, 139, 140 Hóa 12 Kết nối tri thức
Thuốc thử Tollens là phức chất được sử dụng rộng rãi trong hoá học hữu cơ.
CH tr 138
Trả lời câu hỏi Mở đầu trang 138 SGK Hóa 12 Kết nối tri thức
Thuốc thử Tollens là phức chất được sử dụng rộng rãi trong hoá học hữu cơ. Thuốc thử Tollens thưởng được dùng để phân biệt aldehyde với ketone. Vậy, phức chất có tính chất và ứng dụng trong thực tiễn như thế nào?
Phương pháp giải:
Nêu tính chất và ứng dụng của phức chất trong thực tiễn.
Lời giải chi tiết:
- Tính chất: Phức chất thường có màu đặc trưng và có phản ứng thế phối tử trong phức chất.
- Ứng dụng:
+ Trong y học, nhiều phức chất có khả năng chữa trị hoặc kiểm soát bệnh.
+ Trong công nghiệp hoá chất, nhiều hợp chất hoá học được điều chế khi có mặt chất xúc tác là phức chất.
+ Trong hoá học, phức chất được dùng để nhận biết và xác định hàm lượng các ion kim loại chuyển tiếp trong dung dịch.
CH tr 139 CH1
Trả lời câu hỏi 1 trang 139 SGK Hóa 12 Kết nối tri thức
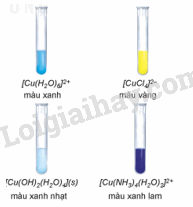
Có 3 lọ hoá chất, mỗi lọ đựng dung dịch của một trong các phức chất sau: [Ag(NH3)2]+, [Cu(H2O)]2+, [Cu(NH3)4(H2O)2]2+. Hãy nhận biết phức chất có trong mỗi lọ dựa vào màu sắc đặc trưng của chúng.
Phương pháp giải:
Lời giải chi tiết:
- Dung dịch chứa [Ag(NH3)2]+ trong suốt không màu.
- Dung dịch chứa [Cu(H2O)6]2+ màu xanh.
- Dung dịch chứa [Cu(NH3)4(H2O)2]2+ màu xanh lam.
CH tr 139 CH2
Trả lời câu hỏi 2 trang 139 SGK Hóa 12 Kết nối tri thức
CuSO4 khan màu trắng, khi hoà tan trong nước, các phân tử nước liên kết với ion Cu2+ tạo phức chất aqua [Cu(H2O)6]2+. Hãy cho biết dấu hiệu nào chứng tỏ phức chất aqua đã tạo thành.
Phương pháp giải:
Dấu hiệu chứng tỏ phức chất được tạo thành: xuất hiện kết tủa, hòa tan kết tủa và thay đổi màu sắc.
Lời giải chi tiết:
CuSO4 khan màu trắng, khi hoà tan trong nước, tạo thành dung dịch màu xanh, chứng tỏ các phân tử nước liên kết với ion Cu2+ tạo phức chất aqua [Cu(H2O)6]2+.
CH tr 139 HĐ
Trả lời câu hỏi Hoạt động trang 139 SGK Hóa 12 Kết nối tri thức
Thí nghiệm: Sự tạo thành phức chất của Cu2+
- Chuẩn bị:
+ Hoá chất: dung dịch CuSO4 5%, dung dịch NaOH 10%, dung dịch NH3 10%, dung dịch HCl đặc.
+ Dụng cụ: ống nghiệm.
- Tiến hành.
+ Cho khoảng 1 mL dung dịch CuSO4 5% vào ống nghiệm (1). Cho tiếp 3 giọt dung dịch NaOH 10% vào ống nghiệm, lắc đều. Nhỏ từ từ dung dịch NH3 10% vào ống nghiệm, vừa nhỏ vừa lắc đều đến khi kết tủa tan hoàn toàn.
+ Cho khoảng 1 mL dung dịch CuSO4 5% vào ống nghiệm (2). Nhỏ từ từ dung dịch HCl đặc vào ống nghiệm, vừa nhỏ vừa lắc đều đến khi dung dịch chuyển màu hoàn toàn.
Quan sát hiện tượng và viết phương trình hoá học của các phản ứng xảy ra.
Phương pháp giải:
Trong dung dịch xảy ra phản ứng thế phối tử của phức chất.
Lời giải chi tiết:
- Ống nghiệm (1):
+ Ban đầu, khi nhỏ dung dịch NH3 vào dung dịch CuSO4 thì xuất hiện kết tủa xanh Cu(OH)2.
\({{\mathop{\rm CuSO}\nolimits} _4} + 2{\rm{N}}{{\rm{H}}_{\rm{3}}} + 2{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{Cu(OH}}{{\rm{)}}_{\rm{2}}} \downarrow + {\rm{ (N}}{{\rm{H}}_{\rm{4}}}{{\rm{)}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}\)
+ Tiếp tục nhỏ dung dịch NH3 đến dư, kết tủa xanh Cu(OH)2 tan trong dung dịch NH3 tạp phức chất màu xanh lam \(\left[ {{\rm{Cu}}{{\left( {{\rm{N}}{{\rm{H}}_{\rm{3}}}} \right)}_{\rm{4}}}} \right]{({\rm{OH)}}_{\rm{2}}}\).
\({\rm{Cu}}{\left( {{\rm{OH}}} \right)_{\rm{2}}} + {\rm{ }}4{\rm{N}}{{\rm{H}}_{\rm{3}}} \to \left[ {{\rm{Cu}}{{\left( {{\rm{N}}{{\rm{H}}_{\rm{3}}}} \right)}_{\rm{4}}}} \right]{({\rm{OH)}}_{\rm{2}}}\)
- Ống nghiệm (2): Dung dịch màu xanh đổi màu thành dung dịch màu vàng.
\({\left[ {{\rm{Cu}}{{\left( {{{\rm{H}}_{\rm{2}}}{\rm{O}}} \right)}_{\rm{6}}}} \right]^{{\rm{2 + }}}} + {\rm{4C}}{{\rm{l}}^ - } \to {\left[ {{\rm{CuC}}{{\rm{l}}_{\rm{4}}}} \right]^{{\rm{2 - }}}} + 6{{\rm{H}}_{\rm{2}}}{\rm{O}}\)
CH tr 140
Trả lời câu hỏi trang 140 SGK Hóa 12 Kết nối tri thức
a) Trong dung dịch, ion Co2+ tạo thành phức chất aqua có dạng hình học bát diện. Hãy viết công thức hoá học của phức chất.
b) Khi cho một lượng dư NH3 vào dung dịch muối CoCl2, thấy màu sắc của dung dịch bị thay đổi. Hiện tượng xảy ra là do toàn bộ các phối tử H2O trong phức chất aqua bị thay thế bởi các phối tử NH3, tạo thành phức chất mới có dạng bát diện. Viết phương trình hoá học của phản ứng thế phối tử đã xảy ra.
Phương pháp giải:
Trong dung dịch xảy ra phản ứng thế phối tử của phức chất.
Lời giải chi tiết:
a) Công thức hoá học của phức chất: [Co(H2O)6]2+.
b) \({\left[ {{\rm{Co}}{{\left( {{{\rm{H}}_{\rm{2}}}{\rm{O}}} \right)}_{\rm{6}}}} \right]^{2 + }}(aq) + {\rm{ 6N}}{{\rm{H}}_{\rm{3}}}(aq) \to {\left[ {{\rm{Co}}{{\left( {{\rm{N}}{{\rm{H}}_{\rm{3}}}} \right)}_{\rm{6}}}} \right]^{2 + }}(aq) + {\rm{ 6}}{{\rm{H}}_{\rm{2}}}{\rm{O}}(l)\)
CH tr 141
Trả lời câu hỏi trang 141 SGK Hóa 12 Kết nối tri thức
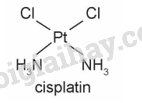
Hãy cho biết dạng hình học, nguyên tử trung tâm và các phối tử có trong phức chất cisplatin.
Phương pháp giải:
- Phức chất có các dạng hình học phổ biến sau:
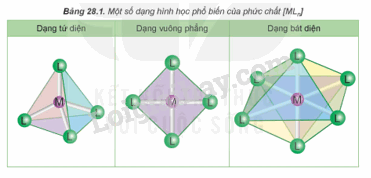
- Phức chất là hợp chất có chứa nguyên tử trung tâm (thường được kí hiệu là M) và các phối tử (thường được kí hiệu là L). Trong đó, nguyên tử trung tâm là cation kim loại hoặc nguyên tử kim loại liên kết với các phối tử. Phối tử là anion hoặc phân tử.
Lời giải chi tiết:
Phức chất cisplatin có dạng tứ vuông phẳng, nguyên tử trung tâm là Pt, phối tử là Cl và NH3.
Lý thuyết
>> Xem chi tiết: Lý thuyết Một số tính chất và ứng dụng của phức chất - Hóa 12 Kết nối tri thức
Luyện Bài Tập Trắc nghiệm Hóa 12 - Kết nối tri thức - Xem ngay
Các bài khác cùng chuyên mục
- Lý thuyết Một số tính chất và ứng dụng của phức chất - Hóa 12 Kết nối tri thức
- Lý thuyết Sơ lược về phức chất - Hóa 12 Kết nối tri thức
- Lý thuyết Đại cương về kim loại chuyển tiếp dãy thứ nhất - Hóa 12 Kết nối tri thức
- Lý thuyết Nguyên tố nhóm IIA - Hóa 12 Kết nối tri thức
- Lý thuyết Nguyên tố nhóm IA - Hóa 12 Kết nối tri thức
- Lý thuyết Một số tính chất và ứng dụng của phức chất - Hóa 12 Kết nối tri thức
- Lý thuyết Sơ lược về phức chất - Hóa 12 Kết nối tri thức
- Lý thuyết Đại cương về kim loại chuyển tiếp dãy thứ nhất - Hóa 12 Kết nối tri thức
- Lý thuyết Nguyên tố nhóm IIA - Hóa 12 Kết nối tri thức
- Lý thuyết Nguyên tố nhóm IA - Hóa 12 Kết nối tri thức












