Câu hỏi
Nhỏ từ từ đến dư dung dịch H2SO4 vào dung dịch chứa đồng thời NaAlO2;Ba(AlO2)2; Ba(OH)2. Sự phụ thuộc của khối lượng kết tủa (y gam) vào số mol H2SO4 tham gia phản ứng (x mol) được biểu diễn bằng đồ thị sau:
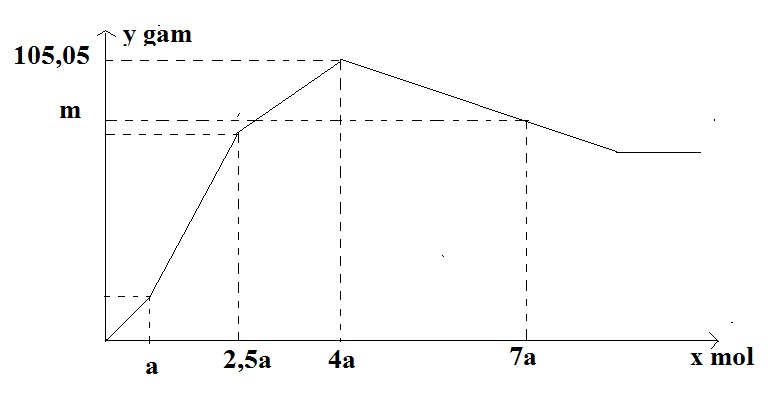
Giá trị của m là
- A 89,45
- B 77,7
- C 93,35
- D 81,65
Phương pháp giải:
Thứ tự PTHH xảy ra là Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
Ba(AlO2)2 + H2SO4 + 2H2O → BaSO4 + 2Al(OH)3
2NaAlO2 + H2SO4 + 2H2O → Na2SO4 + 2Al(OH)3
Tại thời điểm kết tủa max thì →phương trình của a → a
Tại thời điểm 7a mol H2SO4 thì nH2SO4 = ? mol
So với thời điểm kết tủa max thì nH2SO4 (thêm) = ? mol
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 3H2O
→ mkết tủa = mkết tủa max – mAl(OH)3 hòa tan thêm
Lời giải chi tiết:
Thứ tự PTHH xảy ra là Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
a a a
Ba(AlO2)2 + H2SO4 + 2H2O → BaSO4 + 2Al(OH)3
1,5a 1,5a 3a
2NaAlO2 + H2SO4 + 2H2O → Na2SO4 + 2Al(OH)3
1,5a 3a
Tại thời điểm kết tủa max có mkết tủa = mBaSO4 + mAl(OH)3 = (a + 1,5a).233 + 78.(3a + 3a) → a = 0,1 mol
Tại thời điểm 7a mol H2SO4 thì nH2SO4 = 0,7 mol
So với thời điểm kết tủa max thì nH2SO4 (thêm) = 0,3 mol
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 3H2O
0,2 ← 0,3
→ mkết tủa = mkết tủa max – mAl(OH)3 hòa tan thêm = 105,05 – 0,2.78 = 89,45
Đáp án A







